【35 under 35】风采展示第二轮已经开始啦!本轮正经名叫“病例实战分析”,不正经名叫“互相伤害”,哈哈哈~100位入围选手每人提交一个有意思的病例,并就病例提出一个问题,形成一个病例库!然后100位入围选手从病例库中任意选择一个非自己提供的病例进行解读并回答问题!最后,我们将呈现病例+别人的点评+病例提供者自己的点评,同步展示!
 100位小伙伴已将自己的病例提交,并提出了问题,让我们一起先阅读下精彩病例吧!
100位小伙伴已将自己的病例提交,并提出了问题,让我们一起先阅读下精彩病例吧!
个人信息
患者,男性,59岁,因“大便带血1年余”为主诉入院。
入院评估:
一般情况:体质指数(BMI)17.9kg/m2,营养风险评分0分,日常活动能力(ADL)评分I级,东部肿瘤协作组(ECOG)评分0分,体表面积(BSA):1.51 m2。
体格检查:PS评分0分,血压124/84mmHg,全身皮肤黏膜无黄染,头颅无畸形、压痛、包块,胸廓对称,无局部隆起、塌陷、压痛,腹平坦,无腹壁静脉曲张,无胃肠型,无蠕动波,腹式呼吸存在,脐正常、无分泌物,腹壁无压痛、反跳痛,腹部柔软、无包块,肝脾肋缘下未触及。
肛门指诊:(胸膝位)肛门外观未见异常,肛门收缩性可,距肛门约8cm、2点至7点,可触及肿瘤下缘,质硬,活动性可,有轻度触疼,未及肠腔狭窄,指套退出可见血染。
入院检查:血常规、尿常规未见异常,便潜血阳性,癌胚抗原(CEA)14ng/ml,AFP及CA199未见异常。
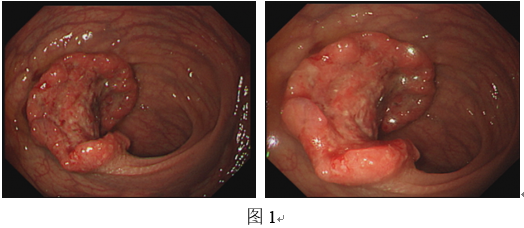
电子结肠镜检查(图1):距肛门9-10cm直肠左侧壁可见一结节样隆起,粘膜表面溃疡,进镜尚可,余所见结肠粘膜光滑,血管纹理清晰,未见充血、糜烂、溃疡等病变。
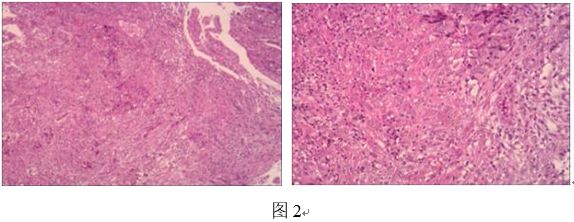
 活检病理提示为(图2):(直肠)腺癌。
活检病理提示为(图2):(直肠)腺癌。
 影像学评估:
影像学评估:
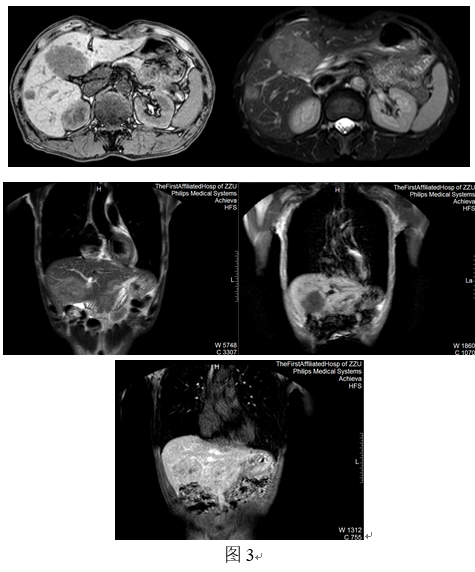
肝脏磁共振成像(MRI)(图3):影像表现为肝内可见多发类圆形长T1稍长T2信号影,DWI上弥散受限呈高信号,边界较清晰。最大者大小约65mm×56mm×52mm(左右径×上下径×前后径)。
静脉注入对比剂后:肝内多发病变动脉期边缘见环状强化,门静脉期、延迟期呈环状不均匀轻度强化,内可见斑片状相对低信号。
影像诊断:肝内多发病变,结合病史,考虑转移瘤。
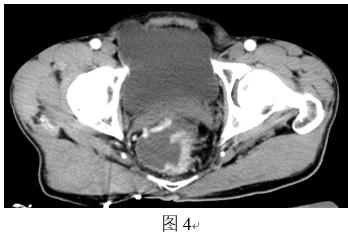
 每部位16层CT增强扫描:
每部位16层CT增强扫描:
中段直肠左侧壁可见一肿物,大小约2.2cm×2.5cm,明显强化,肠壁外缘毛糙。直肠周围、腹股沟区、腹膜后均未见肿大淋巴结。肺部未见明显异常。
 诊断:直肠癌肝转移(cT3N0M1)
诊断:直肠癌肝转移(cT3N0M1)
问题:请问该患者下一步治疗方案及治疗依据?
此病例共有1位入围选手点评:72-李大卫 ;病例提供作者为:85-孙振强。详情如下:
点评医生简介:72-李大卫
 点评内容分享:
点评内容分享:
该病例是一例典型的直肠癌合并肝转移病例。首先,定性方面,直肠腺癌病理明确,MRI提示肝转移,临床诊断明确;其次,定位方面,直肠癌病灶位于腹膜反折处(指诊可以扪及肿块,影响学显示病灶位于精囊水平),应属于中低位直肠癌,肝脏病灶主要有两个,位于肝Ⅳ和Ⅵ段;再次,定量方面,直肠病灶属于T3期,肝脏转移灶主要有两个。
在MDT讨论以前,可能仍需要补充部分检查资料。首先,直肠分期推荐直肠增强MRI,这是目前NCCN、ESMO和中国临床肿瘤学会CSCO专家共识等的标准推荐。因为直肠增强MRI对于准确判断T、N分期,CRM(环周切缘)、MRF(直肠系膜筋膜),EMVI(肠壁外血管浸润)距肛距离等具有显著优势,对于评估直肠复发风险分级,制定术前治疗策略方面具有重要意义。本病例中直肠T分期似乎更靠近T3a/3b,按照2017ESMO指南,对中低位T3a/3b重新进行了复发风险分组。2013版的"中期(差)"组(极低位cT2, cT3且MRF-(除非中高位cT3a/b直肠癌),N1-2,EMVI+,局限性cT4aN0)进一步分为两组:中期组(中)和局部进展期组(差),其中低位cT3a/b,肛提肌-,MRF-或中高位cT3a/b,cN1-2(非结外种植),EMVI-被重新划分为复发风险中组,按照指南可以直接行TME手术。其次,建议完善PET-CT检查。尽管目前各个指南并未对晚期肠癌PET-CT检查作为常规推荐,同时,PET-CT是否可以显著改善隐性病灶检出率并改变治疗策略进而影响预后目前仍存争议,但对于以NED(无肿瘤残留)为治疗目的的可切除/潜在可切除肠癌肝转移病人,PET-CT仍然是有益的选择。当然,由于对1cm以下转移灶或化疗后转移灶的灵敏度不足(约30%),如结合高分辨率MRI(普美显造影剂)将对于制定准确的肝脏治疗策略提供更大的价值。
在完善检查基础上该病例分期可能为cT3a/bN0M1a,肝脏病灶为潜在可切除,CRS评分为3分(转移灶多发,大于5cm,同时性转移)。Ras、B-raf等分子特征不详。整体治疗目的为治愈性。
直肠癌合并同时性肝转移病人是目前临床MDT讨论中较为复杂的病例,因为往往涉及到直肠癌的术前放化疗,肝转移的术前系统化疗两者的协调问题,同时还需要兼顾到病灶特点(原发灶有无出血、梗阻、穿孔,病期等)、疾病特征(分子特征、治疗反应性等)和病人特征(身体耐受力、意愿等)等因素,需要按照目标导向,全程管理的策略进行综合考量和策略制定。
NCCN指南并未对直肠癌肝转移提供具体的分层治疗意见,ESMO指南将同时性直肠mCRC分为如下三种临床情形,并给出相应的治疗建议:
a)原发性肿瘤和转移灶都可以初始手术切除,可以先采用5×5 Gy的方案对原发性肿瘤和受累的邻近淋巴结放疗,然后采用联合化疗,约3个月后手术切除转移灶和原发性肿瘤。
b)原发性肿瘤是局部晚期(很差)且转移灶可手术切除,可采用上述治疗策略,即采用短程放疗,11-18天后开始联合化疗,与采用氟尿嘧啶类的放化疗相比,这会导致全身治疗的剂量强度升高。放疗结束至少5到6个月后,行原发灶的手术治疗。
c)转移灶无法切除,需要缩小后再择期手术,同样可采用与上述相同的策略。另外,也可以先开始联合化疗,定期评价,继续化疗,直到肿瘤充分消退。然后,如果需要,可给予5× 5 Gy的放疗,进行肝脏/直肠癌的同期或分期手术。
因此,在ESMO指南看来,传统长程CRT对于转移性直肠癌的价值相对有限。根据Polish II的初步结果,在局部进展期直肠癌中,短程放疗加延迟化疗(3次FOLFOX4)对比常规放化疗两组R0切除率和pCR率、DFS和累积复发率均无明显差异,同时治疗毒性更低。而短程放疗加延迟化疗所带来的时间效益和全身病灶的兼顾,使其在晚期直肠癌的治疗中显示出更大的优势。当然,考虑到放疗本身的毒性反应,对于局部复发风险较低的直肠癌,术前单纯化疗加高质量的TME手术也是一种可能的尝试,FOWARC研究的初步结果也显示了局部进展期直肠癌术前单纯化疗与新辅助放化疗接近的肿瘤降期率和有效率。
当然,如果直肠病灶属于复发风险极差组(如MRF+,cT4,侧方淋巴结转移),短程放疗加延迟化疗是否能够非劣效与长程放化疗,目前尚无定论。复旦大学附属肿瘤医院章真教授团队对直肠癌合并远处转移病人,采用相当于全剂量强度的联合方案(CAPEOX或mFOLFOX6)同步长程放疗,在局部控制的同时,远处病灶也能得到兼顾,值得探索和实践。
本例病例的特点为直肠病灶属于复发风险中组,而肝转移病灶属于CRS评分较高,且Ⅳ段病灶累计第一肝门可能,为潜在可切除,建议术前新辅助化疗。按照ESMO指南,对于技术上有难度,预后差的可考虑最佳系统化疗方案。因此,对于该病例,本人建议可以考虑两种方案:(一)首先进行全身系统化疗,建议明确Ras基因状态,必要时可考虑联合西妥昔单抗;(二)先行短程放疗,延迟期加用4-6个疗程全身化疗,根据肝脏病灶退缩情况决定后续治疗方案。如肝脏肿瘤退缩理想,可考虑同期或分期行直肠原发灶和肝转移灶切除。
--------------------------------------
病例提供作者简介:85-孙振强
 病例提供作者自评:
病例提供作者自评:
该病例有如下特点:
1、直肠癌同时性肝转移
2、原发灶小,转移灶较大
3、无肠梗阻、出血、穿孔
4、肝转移灶难以切除,转化治疗治疗后尚有潜力切除
5、未见明显淋巴结转移
下一步治疗方案及依据:
1、行MDT讨论。目前对于较复杂的、转移性的,尤其是不能同期切除的转移性的直肠癌,推荐首先行MDT讨论,先手术后转化治疗vs先转化治疗、全身化疗、放疗、肝脏是否采取措施?
2、行基因检测及微卫星不稳定检测。基因检测如RAS、BRAF等,有利于靶向药物的选择;微卫星不稳定(MSI)对判断预后非常有利,目前已有大量证据表明,dMMR/MSI-H是II期CRC患者预后良好的一个标志物;MSI具有指导治疗作用,一项回顾性研究结果显示,MSI-H患者并不能从5-FU的辅助化疗中获益。亦有报道,MSI-H可作为5-FU辅助治疗CRC无效的预测标志物,同时有研究报道,MSI-H对伊立替康的辅助化疗敏感。
3、根据MDT讨论结果,行相应的治疗方案。目前尚无肠梗阻、出血、穿孔,原发灶小,可考虑先行转化治疗。若基因检测结果为MSI-H,则考虑FOLFIRI方案化疗,若基因检测结果为MSS,这考虑FOLFOX6方案或CAPOX方案化疗。待评估肝脏达到可切除的程度,择期行直肠癌切除,同期行肝切除。
-------------------------------------
以上为【35 under 35】的观点,您怎么看?欢迎广大肿瘤医生在下方留言发表您的观点!
以上所有点评参考文献略。












 苏公网安备32059002004080号
苏公网安备32059002004080号


