【35 under 35】风采展示第二轮已经开始啦!本轮正经名叫“病例实战分析”,不正经名叫“互相伤害”,哈哈哈~100位入围选手每人提交一个有意思的病例,并就病例提出一个问题,形成一个病例库!然后100位入围选手从病例库中任意选择一个非自己提供的病例进行解读并回答问题!最后,我们将呈现病例+别人的点评+病例提供者自己的点评,同步展示!
 100位小伙伴已将自己的病例提交,并提出了问题,让我们一起先阅读下精彩病例吧!
100位小伙伴已将自己的病例提交,并提出了问题,让我们一起先阅读下精彩病例吧!
患者病史摘要
男,74岁,因“淋巴瘤11月,化疗后3周”于2016年2月13日收治入院。
现病史:患者2015-01-08无明显原因及诱因出现左侧鼻出血,伴鼻塞,时有流涕。
2015-01-29 CT:左侧上颌窦、筛窦、鼻腔内见软组织密度影充填,局部呈肿块样改变,肿块破坏中鼻甲、左侧眼眶上壁、内侧壁、鸡冠且向眼眶内生长,向后阻塞后鼻孔。
2015-02-05鼻咽镜:左鼻腔见息肉样新生物,咽后壁及舌根部淋巴滤泡增生。眼科超声:双眼玻璃体混浊;左眼眶内占位性病变待查。鼻腔病灶活检:(左侧中鼻道)查见成片异型的淋巴细胞,符合非霍奇金淋巴瘤,结合免疫标记结果,首选弥漫大B细胞淋巴瘤(DLBCL,生长中心外亚型)。免疫组化:CK(-),CD3(-),CD5(+/-),CD20(++),PAX-5(++),CD30(-),CD56(-),GramB(-),Ki-67(80%),EBER(-),MUM-1(++),Bcl-6(+),CD10(-),CyclinD1(-),S-100(-),Syn(-)。
2015年2月初,患者无意间发现左侧颌下有一质硬包块。2015-02-11、03-10、04-02、04-25给予CHOP方案行四周期化疗。患者化疗后左侧颌下包块明显缩小。
2015-03-06骨髓穿刺检查提示增生性骨髓象。末次化疗结束后开始予以放射治疗,放射治疗过程中出现放射性口腔、咽喉黏膜反应,经对症处理后好转不明显,放疗13次后因不能耐受拒绝进一步放疗。
患者因左侧上肢持续性胀痛于2015-12-16 PET-CT检查提示:1.右侧锁骨上窝、右肺门、左侧骨盆底淋巴结显示、增大,右侧腹腔、腹膜后右输尿管走行区不规则软组织肿块,上述病灶糖代谢均增高,符合淋巴瘤表现;2.左侧肱骨上段多发骨质破坏,髓腔内软组织密度填充影,糖代谢增高,考虑淋巴瘤侵犯;3.右侧输尿管受压,右肾盂及右侧输尿管上段轻度扩张、积液。2015-12-23和2016-1-22再予以CHOP方案(CTX 800mg VD D1,THP 50mg VD D1,VCR 2mg IV D1,PDN 100mg PO D1-5)化疗两周期,并给予盐酸羟考酮缓释片30mg bid止痛、对症支持等治疗。现为进一步诊治收入我科。
既往史、个人史、家族史无特殊。
体格检查:生命体征平稳,双肺呼吸音清,未闻及干、湿罗音及哮鸣音。心律齐,心尖部未闻及病理性杂音。腹部平坦,无压痛及反跳痛。
入院诊断:1.鼻腔非霍奇金淋巴瘤IV期 A组(弥漫大B细胞型)、 2.左侧肱骨浸润、 3.右肾盂、输尿管轻度积水、 4.中度癌痛 NRS评分:4分
入院前主要检查:
2015-12-16 PET-CT:1.右侧锁骨上窝、右肺门、左侧骨盆底淋巴结增大,右侧腹腔、腹膜后右输尿管走行区不规则软组织肿块,上述病灶糖代谢均增高,符合淋巴瘤表现;2.左侧肱骨上段多发骨质破坏,髓腔内软组织密度填充影,糖代谢增高,考虑淋巴瘤侵犯。

入院后实验室检查:
胸腹部CT:右前上纵隔肿块影;直肠壁增厚,新生物可能;下腔静脉旁淋巴结增大。
四肢平片:左侧肱骨骨质密度减低,其上段及下段骨质不连续,边缘见骨痂形成,上段骨折线模糊,下段骨折断端分离,周围软组织肿胀。[印象]左侧肱骨骨折,伴周围软组织肿胀。
血常规:白细胞(WBC)3.97×10^9/L;血红蛋白(HGB)83g/L;红细胞(RBC)2.74×10^12/L;血小板(PLT)230×10^9/L。
肝肾功能:前白蛋白 155 mg/L;乳酸脱氢酶(LDH)228.9 IU/L。
T细胞亚群:CD4 208;CD8 248;CD3 480;CD4/CD8 0.8。
入院评估:患者鼻腔弥漫大B细胞淋巴瘤放化疗后,伴腹腔淋巴结、左侧肱骨浸润,左侧肱骨病理性骨折。化疗两周期后,评估病灶变化不明显,疗效为PD。患者全身情况有下降趋势,难以耐受进一步化疗,且拒绝利妥昔单抗治疗。针对患者全身评估,向患者及家属充分交待进一步治疗的重要性和风险,征得患者及家属同意,拟入CAR-T治疗临床试验。
CAR-T治疗经过:
 1. 2016-02-29予以“环鳞酰胺 1200mg 氟达拉滨 40mg VD D1-3”预处理。回输CAR-T细胞前查血常规:C反应蛋白(CRP)76.0mg/L↑、白细胞(WBC)4.95×10^9/L、中性粒细胞百分率(NEUT%)96.4%↑、淋巴细胞百分率(LYM%)0.6%↓、淋巴细胞绝对值(LYM#)0.03×10^9/L、红细胞(RBC)2.81×10^12/L↓、血红蛋白(HGB)89g/L↓、红细胞压积(HCT)25.6%↓、血小板(PLT)152×10^9/L。
1. 2016-02-29予以“环鳞酰胺 1200mg 氟达拉滨 40mg VD D1-3”预处理。回输CAR-T细胞前查血常规:C反应蛋白(CRP)76.0mg/L↑、白细胞(WBC)4.95×10^9/L、中性粒细胞百分率(NEUT%)96.4%↑、淋巴细胞百分率(LYM%)0.6%↓、淋巴细胞绝对值(LYM#)0.03×10^9/L、红细胞(RBC)2.81×10^12/L↓、血红蛋白(HGB)89g/L↓、红细胞压积(HCT)25.6%↓、血小板(PLT)152×10^9/L。
2. 2016-03-04~06抗CD19-CART细胞回输,5.6e6 CART cell/kg,输注过程中体温波动在 36.0-36.6℃,呼吸波动在 11-21次/分,脉搏波动在 94-96次/分,血压波动在 148-139/77-68mmHg。考虑CAR-T细胞回输后可能出现CRS、溶瘤综合征、脱靶效应等不良反应,予以“一级护理”,持续心电血氧饱和度监测等辅助支持治疗,密切监测患者生命体征及及病情变化。
3. CAR-T细胞回输后第4天,血常规提示白细胞降低,考虑预处理化疗后出现骨髓抑制,予以“重组人粒细胞刺激因子”升白细胞,嘱患者避免外出,避免感染。第10天出现血压短暂升高至161/87 mmHg,为患者走动后所致,予以对症处理。CAR-T细胞回输后第14天,复查血常规、肝肾功、电解质、炎症标志物未见明显异常,患者精神、食欲尚可,未诉不适,要求出院,出院后嘱其随访。
CAR-T治疗前后CT监测(治疗前、治疗后4个月):
(1)左肱骨浸润


(2)右腹腔软组织肿块影
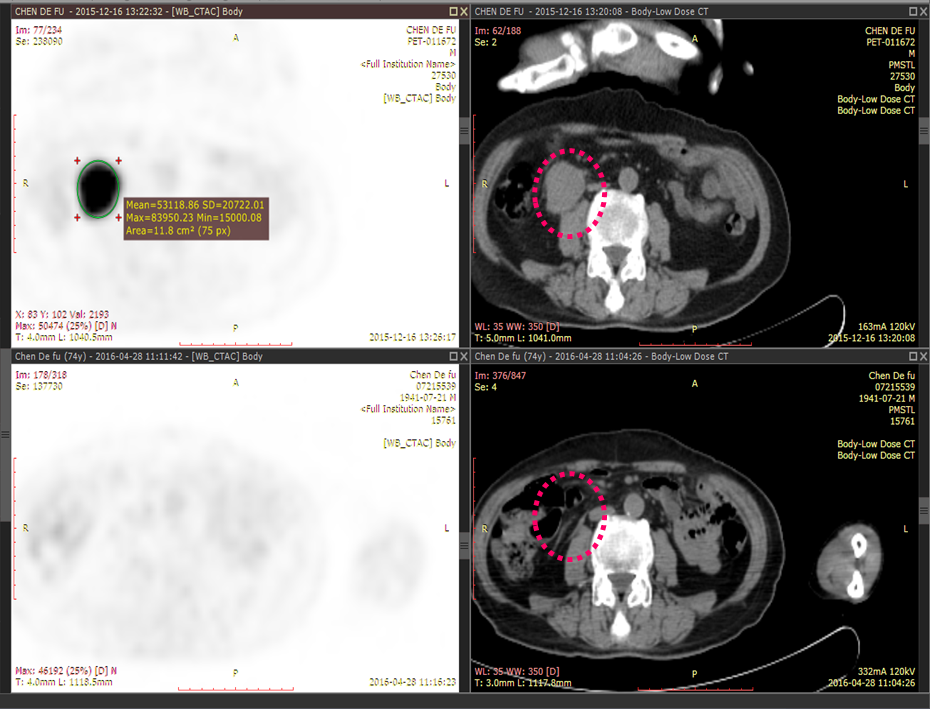
(3)右前上纵隔肿块影

CAR-T治疗转归:疗效评估(RECIST)CR;PFS时间17个月;PS评分0。
问题:该患者采用CAR-T治疗的原理及注意事项是什么,为何效果如此显著?
病例提供作者简介:37-李咏生
 病例提供作者自评:
病例提供作者自评:
该病例患者老年男性,鼻腔弥漫大B细胞淋巴瘤化疗后出现病情进展,胸腹腔多发淋巴结侵犯,左侧肱骨侵犯,需全身化疗控制病情,NCCN指南首选的化疗方案是CHOP方案,必要时可加利妥昔单抗。患者左侧肱骨侵犯,病灶处骨质破坏严重,范围较大,伴有明显疼痛症状和骨折风险,且由于病变广泛,以全身治疗为主,局部疗效不确切,故暂不考虑局部放射治疗。然而在经过6个周期CHOP治疗后,患者病情并未能得到有效控制,且进展迅速。经对患者全身情况进行综合评估和多学科会诊后,向患者及家属征得同意,2016-02-29予以“环鳞酰胺 1200mg 氟达拉滨 40mg VD D1-3”预处理后,本病例2016-03-04~06采用了当时作为临床试验的抗CD19的嵌合抗原受体(CAR)T细胞回输治疗,随访至今已17个月,疗效评估为完全缓解(CR)。
发挥抗肿瘤免疫的主要机制是T细胞免疫。T细胞的活化需要抗原肽-MHC分子复合物与T细胞受体TCR特异性识别结合,以及协同刺激信号的双信号刺激。肿瘤细胞可通过多种途径发生免疫逃逸:如在肿瘤微环境,肿瘤细胞的抗原性会被下调使其丢失抗原提呈能力,导致T细胞无法识别肿瘤细胞;肿瘤细胞和微环境中的抗原提呈细胞(APC)高表达免疫抑制性信号如PD-L1,介导肿瘤免疫抑制;肿瘤微环境中的T细胞受各种免疫抑制因子的调节,高表达PD-1、CTLA4等免疫抑制分子,与APC上相应配体结合后发生失能甚至进入衰竭状态。这些机制启发着人们对肿瘤免疫治疗方法的探索。
CAR-T疗法是近年来开发并迅速被批准上市的免疫治疗方法。CAR-T细胞治疗是通过基因工程技术,将肿瘤抗原的高亲和性和T细胞的杀伤机制相结合,通过基因转染T细胞,使其获得特异性杀伤肿瘤细胞的能力,不需要MHC分子限制性地识别肿瘤的抗原决定簇。CAR由3个部分组成:细胞内信号区、中间的跨膜区及细胞外抗原结合区,细胞内信号区介导T细胞内信号传导、活化、增殖从而最终完成杀伤肿瘤细胞的过程;胞外抗原结合区具有抗体单链可变区片段功能,即具有识别特定肿瘤抗原的功能。CAR结构已经发展至4代。由于第1代在细胞扩增、体内存活时间、细胞因子分泌等方面存在缺陷,临床疗效并没有达到预期的效果,第2代在第1代的基础上引入了共刺激分子CD28或者CD137(4-1BB),第2代CAR-T细胞与第1代相比能提高T细胞的细胞毒性、增殖性及延长T细胞的存活时间;第3代是加入CD28的同时也加入了CD137或CD134,可进一步延长体内T细胞的存活时间,增强清除肿瘤的能力。第3代CAR-T是否优于第2代还有待临床验证。第4代的CAR-T则加入了细胞因子或共刺激配体,进一步提升这些改造过的T细胞的扩增活性和寿命。
目前靶向CD19+ B细胞恶性肿瘤是应用CAR-T细胞技术最成功的疾病类型。还有另外一些CAR-T的靶向分子,包括靶向ERRB2(HER-2/neu)治疗肺癌,靶向前列腺特异性抗原治疗前列腺癌,靶向CAIX治疗肾细胞癌等等,但仍处于研究阶段。虽然CAR-T疗法在血液系统恶性肿瘤的治疗中显示出前所未有的疗效,但目前CAR-T细胞疗法在治疗过程中尚存在脱靶效应、细胞因子释放综合征、体内持续时间短、复发率高等问题,且在治疗实体瘤方面的疗效还有待提高。
总之,CAR-T免疫疗法在肿瘤治疗方面有着广阔的应用前景,也给广大的肿瘤患者带来了曙光,未来研究方向将是在提高抗肿瘤治疗有效性的同时尽量降低不良反应的发生。CAR-T疗法仅仅是肿瘤免疫治疗的开端,目前还在研究第5代CAR-T——通用型CAR-T(universal-CAR-T, uCAR-T)。另外,大家熟知的TCR-T 、PD-1抗体、PD-L1抗体等新型免疫疗法的出现也为肿瘤免疫治疗预示了光明的前景,Science杂志2013年也将肿瘤免疫治疗列为十大科学突破之首。CAR-T等新型有效的肿瘤免疫治疗在临床中的应用和推广非常值得期待。
欲了解更多血液肿瘤、淋巴瘤相关资讯,与全国各地血液肿瘤、淋巴瘤医生交流与讨论,请扫描以下二维码,添加肿瘤资讯小助手-Dinna微信,备注“血液肿瘤”!
1. Garfall AL, Maus MV, Hwang WT, Lacey SF, Mahnke YD, Melenhorst JJ, Zheng Z, Vogl DT, Cohen AD, Weiss BM, Dengel K, Kerr ND, Bagg A, Levine BL, June CH, Stadtmauer EA. Chimeric Antigen Receptor T Cells against CD19 for Multiple Myeloma. N Engl J Med. 2015 Sep 10;373(11):1040-7.
2. Kochenderfer JN, Dudley ME, Kassim SH, et al. Chemotherapy-refractory diffuse large B-cell lymphoma and indolent B-cell malignancies can be effectively treated with autologous T cells expressing an anti-CD19 chimeric antigen receptor. J Clin Oncol. 2015 Feb 20;33(6):540-9.
3. Ahmed N, Brawley VS, Hegde M, et al. Human Epidermal Growth Factor Receptor 2 (HER2) -Specific Chimeric Antigen Receptor-Modified T Cells for the Immunotherapy of HER2-Positive Sarcoma. J Clin Oncol. 2015 May 20;33(15):1688-96.
4. Brentjens RJ1, Davila ML, Riviere I, et al. CD19-targeted T cells rapidly induce molecular remissions in adults with chemotherapy-refractory acute lymphoblastic leukemia. Sci Transl Med. 2013 Mar 20;5(177):177ra38.
5. Couzin-Frankel J. Breakthrough of the year 2013. Cancer immunotherapy. Science. 2013 Dec 20;342(6165):1432-3.
















 苏公网安备32059002004080号
苏公网安备32059002004080号


