【35 under 35】风采展示第二轮已经开始啦!本轮正经名叫“病例实战分析”,不正经名叫“互相伤害”,哈哈哈~100位入围选手每人提交一个有意思的病例,并就病例提出一个问题,形成一个病例库!然后100位入围选手从病例库中任意选择一个非自己提供的病例进行解读并回答问题!最后,我们将呈现病例+别人的点评+病例提供者自己的点评,同步展示!
 100位小伙伴已将自己的病例提交,并提出了问题,让我们一起先阅读下精彩病例吧!
100位小伙伴已将自己的病例提交,并提出了问题,让我们一起先阅读下精彩病例吧!
患者一般情况介绍
患者,男性,58岁
主诉:反复上腹部隐痛2年,加重伴纳差、消瘦1月。
查体:体质指数(BMI)24.33kg/m²,营养风险评分1分,日常活动能力(ADL)评级I级,东部肿瘤协作组(ECOG)评分0分。浅表LN — ,腹部未及肿块 ,肛查:—
检查情况介绍
血常规:Hb 94g/L,WBC、NE、PLT正常
肿瘤标记物:CEA、CA19-9、CA15-3、CA72-4均在参考值范围内
其他检查:粪便潜血(+),生化、尿常规、凝血指标、肝炎、结核相关检查均未见异常
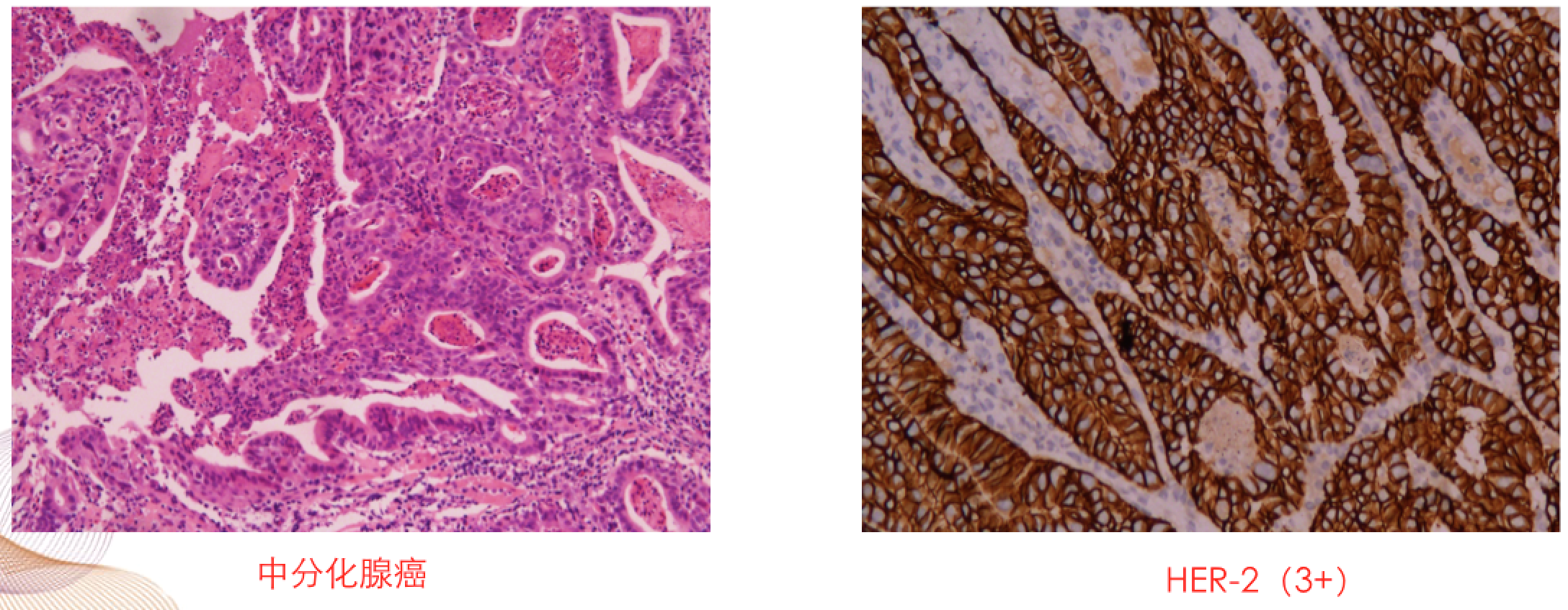
胃镜:胃底体交界大弯侧及前壁见隆起溃疡型肿物。诊断:胃癌


病理活检:中分化腺癌,Lauren分型:肠型,HER2 (3+)。
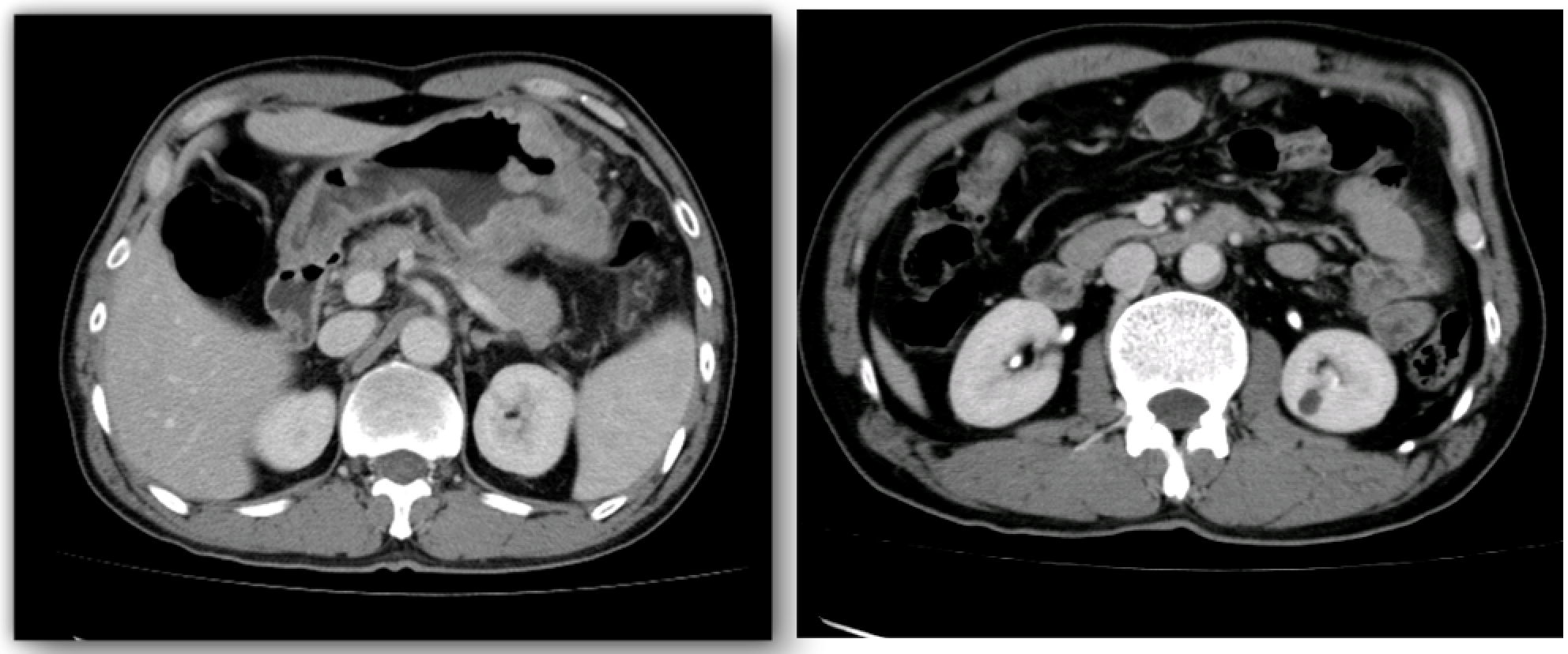
2013-11-07 胸-腹-盆CT:


问题:
1.为完善患者的分期还需要进行什么检查?
2.若完善检查后排除远处转移,患者为局部晚期胃癌,下一步如何治疗?
A.手术—辅助治疗
B.新辅助治疗-手术-辅助治疗,如果选择B,选用什么新辅助方案?
C.其他?
此病例共有3位入围选手点评,分别为19-文凤、21-薛俊丽、49-邱海波 ;病例提供作者为:11-邱妙珍 。详情如下:
点评医生简介:19-文凤
 点评内容分享:
点评内容分享:
患者目前诊断为胃底体中分化腺癌(cT2~4 NXMX, Lauren分型:肠型,HER2 (3+))首先应该明确分期,才能制定个体化的治疗方案。因为CT在诊断cT分期中仍有一定局限性,根据第八版AJCC的胃癌TNM分期,强调超声内镜(EUS)对决定cT分期至关重要。但是胸、腹、盆腔CT和增强可以评估异常淋巴结(cN)的大小、外观和数目,以及发现远处转移(cM1)有十分重要的作用。
此外,本案例中患者盆腔CT发现盆底见少量积液,对于T3、T4和N+的患者来说腹膜转移发生率为25%。同时患者腹部CT发现大网膜增厚,胃大弯侧、肠系膜见多发淋巴结肿大,都提示患者可能存在胃癌腹膜转移的可能。故为了对腹腔内的转移情况进行评估,了解腹膜转移的分布和大小,并获得明确的组织学及细胞学证据,用于指导制定临床治疗策略,应采用诊断性腹腔镜探查和腹腔灌洗液评价。因为诊断性腹腔镜检查是有创检查,。目前主要适用于进展期胃癌(cT2~4及任何N和M)的治疗前诊断、术前治疗后的疗效评价。
故本案例中,为了明确患者分期还应该进行超声内镜和腹腔镜探索检查。同时胃癌患者应常规做肛门指检。
下一步治疗:
从影像学上,可以看到胃上的病灶胃粘膜不均匀增厚,周围脂肪间隙不清,和胰腺分界不清,本案例的患者不排除cT4b的可能。根据新版分期的指南,所有cT4b的病人均归为IVA期(图1),因为此类病人预后较差,也可能与较高的腹膜转移率有关。故此类局部晚期病人外科手术不是首选治疗决策,因此转化治疗应该适时地介入,或经MDT讨论最佳的治疗模式。故T4b的胃癌联合脏器切除,如横结肠部分切除或者胰体尾脾切除等暂时不考虑。该患者主要考虑以下两种情况:
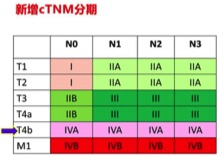
图1. 第八版AJCC的胃癌TNM分期
情况1:P1 CY0/1 晚期一线化疗
腹膜转移是晚期胃癌患者死亡的首要原因之一,胃癌腹膜转移的发生机制尚不完全明确,"种子土壤"学说是目前较为认可的机制。胃癌腹膜播散转移过程中,粘附分子、蛋白水解酶、细胞动力因子、血管生成因子等都发挥了重要作用,同时腹膜自身特异性结构(淋巴孔和乳斑区)也使得癌细胞易于"播种"[1, 2]。游离癌细胞聚集于连接乳斑区和腹膜下淋巴管的淋巴孔处,因淋巴孔特异性分布于横膈膜、肠系膜、网膜和盆腔腹膜的浆膜表面,故而这些部位在腹膜转移的早期就易受到累及。虽然防治胃癌腹膜转移的方法很多,但总体疗效不佳[3, 4]。
本案例中,患者为少量腹水的晚期胃癌患者,全身系统化疗是核心治疗,疗效优于最佳支持治疗。目前,临床常用的氟尿嘧啶类联合铂类的两药方案疗效优于单药方案,毒性小于三药方案。推荐方案:S-1+CDDP(Ⅱ级,Grade A)、S-1+OXA(Ⅱ级,Grade A)、PTX(Ⅲ级,Grade A)、S-1单药(Ⅲ级,Grade A)、5-FU持续静脉滴注(Ⅲ级,Grade A)等。但是考虑到患者有腹水,因为SP方案中顺铂的水化可能会导致腹水增多,故更加推荐该患者使用SOX方案。同时该患者为HER2(3+),根据TOGA研究结果,推荐使用化疗联合靶向治疗[5]。
情况2:P0 CY0 新辅助化疗
根据2017年CSCO胃癌指南,对于临床分期III期胃底体癌患者推荐先予以围手术期化疗,是胃癌综合治疗的重要组成部分,可以达到使肿瘤降期、提高R0切除率和改善整体生存的目的,同时不会增加术后并发症级病死率。除此以外,新辅助化疗还可以获得明确的疗效判断,对于术后辅助的化疗方案的选择提供的依据。可选的方案见下表,对于本患者来说属于淋巴结阳性的III期胃癌,SP方案较优,但考虑到患者有少量盆腔积液,可以改用SOX方案[6, 7]。新辅助化疗的周期数尚无定论,对于T3N1的患者一般需要8-9周的术前辅助化疗;对于T3N2或者T4以上分期的患者应该适当延长新辅助化疗的时间,需要8-9周及以上。
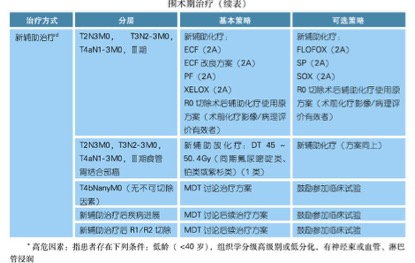 图2. 2017年CSCO胃癌指南中不可切除的胃癌围手术期治疗方案
图2. 2017年CSCO胃癌指南中不可切除的胃癌围手术期治疗方案
对于该患者是否需要接受赫赛汀靶向治疗联合化疗的新辅助治疗存在较大争议。日本有个案报道,对于Ⅲc (T4aN3M0)的胃癌患者采用S-1/CDDP/赫赛汀的化疗联合靶向治疗2周期后,取的了PR的临床疗效,患者接受了远端胃D2根治性切除+淋巴结清扫术,病理缓解分级Grade 3: pCR。术后患者没有进行术后辅助治疗,DFS为10个月[8]。故本案例中的患者HER2 (3+),也可以考虑赫赛汀靶向治疗联合化疗的新辅助治疗方式。
本案例中值得注意的是:
1. 患者胃镜发现的为溃疡性胃癌,要警惕患者在治疗过程中发生胃癌穿孔的风险。日本有学者报道在进展期HER2阳性胃癌患者中,使用卡培他滨、顺铂联合曲妥珠单抗(HXP治疗),患者发生了穿孔,但最终患者都接受了根治性切除术[9]。故本病例中患者如果接受高强度的术前治疗也要考虑是否有发生穿孔的风险。
2. 患者以“反复上腹部隐痛2年,加重伴纳差、消瘦1月”入院,病史比较长,营养风险评分1分,实验室检查:Hb 94g/L。故患者存在胃癌相关性营养不良,与患者预后密切相关[10]。 胃癌相关性营养不良不仅可以削弱化疗的疗效,还可能增加药物不良反应风险,降低骨骼肌质量和功能,增加术后并发症及院内感染的机会,延长住院时间,升高术后以及化疗后并发症发生率和病死率,恶化患者的生活质量,增加医疗费用。故适时地营养干预对于患者的预后非常重要。“术前免疫营养支持5~7天被推荐用于营养不良和非营养不良的胃癌患者,对营养不良的患者手术后至少继续使用7天的营养支持(肠内营养和/ 或肠外营养)”是法国的A级推荐[11]。
--------------------------------------
点评医生简介:21-薛俊丽
 点评内容分享:
点评内容分享:
该患者为中老年男性患者,经胃镜证实为胃癌(胃体 腺癌),Lauren分型为肠型。根据胸-腹-盆CT结果,考虑为局部晚期胃癌,所提供CT资料看,胃周淋巴结受累(已有第10组淋巴结受增大),脾门淋巴结也增大,病例经请示外科主任医师后考虑目前手术条件不甚成熟。因患者目前肺部CT结果不详,尚不清楚是否有肺部转移灶。为进一步评估患者全身病情,在患者经济条件允许前提下,可考虑行PET-CT进一步明确。
若患者目前无远隔部位转移,肿瘤局限于胃及周围淋巴结,下步治疗可考虑行转化治疗。但胃癌术前新辅助治疗药物选择及化疗周期选择仍存在一定争议。
胃癌新辅助研究中,近年来较为重要的结果为2016年发表与Lancet Oncology的FLOT4 II期研究结果[1]。该研究显示,对可切除的胃或胃食管结合部腺癌,FLOT方案(氟尿嘧啶+亚叶酸钙+奥沙利铂+多西他赛)与ECX(表柔比星+顺铂+卡培他滨)方案相比,病理完全缓解率更高,尤其是在肠型胃癌中。但是,该结果能否真正应用于临床还要慎重考虑。首先,pCR作为主要终点能否转化为病人的生存获益?目前Ⅱ期研究没有OS或PFS改善这样的确定性证据,最终结果还要等Ⅲ期研究。其次,围手术期化疗的pCR率通常不会超过10%,FLOT方案16%的pCR率可能存在异常。第三,对于FLOT方案本身,4周期是否合适仍不清楚,且三种细胞毒药物联合治疗的潜在毒性也令人担忧。
针对紫杉类药物在胃癌新辅助治疗中的作用,2017年日本的Aoyama教授在Annals of Oncology上发表一项II期研究结果(该研究比较2或4周期CS(顺铂60mg/m2第1天,S-1 80mg/m2 21天,休息1周)或DCS(多西他赛40mg/m2第1天,顺铂60mg/m2第1天,S-1 80mg/m2 14天,休息2周),新辅助化疗后行D2切除和辅助性S1化疗1年,主要研究终点是3年总生存)。该结果从病理反应率上看,不支持含紫杉类的三药作为新辅助化疗,也不支持2疗程以上的新辅助化疗[2]。而2017年一项韩国研究也揭示,在局部晚期胃癌患者中,SOX方案可作为新辅助治疗之选[3]。
通过比较FLOT4研究和Aoyama教授的研究发现,二项研究中氟脲嘧啶和S-1的剂量强度(DI)存在差别,FLOT4研究中二组的氟脲嘧啶DI相似,而Aoyama教授研究中CS组S1的DI为60mg/m2/周,而DCS组为40mg/m2/周,DCS组S-1的DI减低可能削弱了紫杉类药物的作用。
不过,有另外2项III期术后辅助化疗研究——ITACA-S研究和SAMIT研究[4, 5]也显示加入紫杉类药物患者无获益。ITACA-S研究中采用FOLFIRI序贯多西他赛+顺铂与5-Fu/LV相比较,无论是DFS还是OS均无改善;SAMIT研究中采用5-Fu序贯紫杉醇与5-Fu相比较,也无生存获益。所以氟脲嘧啶的DI和紫杉类药物联合还是序贯使用可能是影响治疗反应率或生存的关键因素。
对于化疗周期,OEO5随机研究显示4疗程ECX化疗的肿瘤完全和次完全退缩率高于2疗程的顺铂+5氟脲嘧啶化疗;但Aoyama教授的研究2疗程和4疗程DCS和CS化疗的病理反应率相似。因新辅助化疗对对预后是否有不同影响仍不清楚,还需长期研究结果进一步证实。
基于以上分析,结合该患者病情,可考虑行术前新辅助治疗,同时依据2017年NCCN指南(V2),对胃癌的新辅助治疗可采用5-Fu+顺铂或5-Fu+奥沙利铂方案进行3周期治疗(I类推荐)[6]。该患者可先行2周期氟尿嘧啶+顺铂/奥沙利铂方案化疗,同时因患者HER-2(3+),推荐联合赫赛汀靶向治疗,2周期后进行复查评价病情。若疾病缓解,可行手术切除;若患者转化治疗效果不明显,在毒副反应可耐受前提下增加1-2次术前新辅助治疗。术后继续行氟尿嘧啶+顺铂/奥沙利铂方案辅助治疗。
--------------------------------------点评医生简介:49-邱海波

点评内容分享:
根治性手术仍是胃癌唯一可能的治愈手段。我国住院胃癌患者中,Ⅲ、Ⅳ期占50%-60%,此类患者手术切除率低,获得根治性切除的比例更少,即便扩大切除和淋巴结清扫范围,术后局部复发及远处转移的发生率仍然较高,5年生存率一般为30%-50%,治疗效果差。如何提高这部分患者的手术R0切除率以及总体生存时间,是我国胃癌研究者的重要使命。
这是一例58岁的男性患者,因“反复上腹隐痛两个月”入院,体检无明显阳性体征,胃镜显示胃底体溃疡型肿物,病理是:中分化腺癌,Lauren分型:肠型,HER2(3+)。胸腹盆CT提示:胃底体胃壁粘膜增厚,符合胃癌表现,胃周围间隙不清楚,大网膜增厚,肠系膜见多发淋巴结肿大,最大者位于胃大弯侧。
通过仔细阅片,会发现CT报告可能有些出入,该患者肠系膜并无肿大淋巴结,在胃体大弯侧第4组、腹腔干第9组、脾门第10组淋巴结肿大,尚属于胃周第2站淋巴结范围内,但部分层面显示与胰腺尾部分界不清。术前分期还需要完善:超声胃镜检查,进一步了解胃壁浸润深度以及胃周淋巴结肿大情况。
从现有的检查来看,患者属于局部进展期胃癌,下一步该如何治疗,有几个选择:1. 手术+术后辅助治疗,2.新辅助治疗-手术-辅助治疗。选择第一种,首先通过手术切除肿瘤,再进一步行辅助化疗,这也是目前东亚国家(中日韩)对于局部进展期胃癌治疗的标准模式。ACTS-GC及CLASSIC进一步确认了对II期/lllA期患者给予术后S-1口服1年或者8周期Xelox辅助化疗可以改善患者的无病生存期,然而对于IIIB/IIIC期患者,无论是ACTS-GC及CLASSIC研究均未显示具有明显的提高无病生存期。选择第二种治疗模式,新辅助治疗-手术-辅助治疗。对于术前化疗是否应该施行,因欧洲国家进行的MAGIC研究与东方国家的临床实践存在较大差距,而无法在日本、韩国及中国广泛推广。能否将化疗用于术前,以提高手术率和延长生存期,以造福更多难以手术的患者,需要进行大规模随机临床研究进行验证。
作者所在的中山大学肿瘤医院目前术前治疗正在开展了两个临床研究:
(1)曲妥珠单抗用于HER2阳性的局部进展期胃癌患者。ToGA是第一个在不能手术的局部晚期、复发和/或转移性HER2阳性胃癌患者中,使用曲妥珠单抗进行治疗的随机III期研究,可明显提高患者的生存期。曲妥珠单抗联合化疗用于新辅助治疗或能提高R0手术切除率及提高患者生存期。该例患者HER2阳性,可考虑给予曲妥珠单抗联合传统化疗(如XELOX方案)进行术前治疗2-4周期,评估后再行D2手术。
(2)局部进展期胃癌行术前放化疗后再接受D2手术。D2术前接受放化疗是否能够提高R0手术切除率及提高患者生存期目前正在研究中,该患者同样可以入组该研究,考虑接受术前放化疗后再行D2手术。
总而言之,这是一个经典的局部进展期胃癌病例,也是国内最常遇见的胃癌病例,提供了很多思考,更对中国的医生提出了更高的要求,积极开展符合中国国情的临床研究,进一步提高我国胃癌患者的总体疗效,路漫漫其修远兮。
------------------------------------
病例提供作者简介:11-邱妙珍

病例提供作者自评:
患者为58岁男性,目前胃镜、病理和CT提示胃底体大弯侧中分化腺癌,HER2阳性,胃大弯处淋巴结转移可能性大。CT未发现远处转移。临床分期cT4bN+Mx.为了进一步明确分期,建议再行超声胃镜检查了解T和N分期,腹腔镜探查和腹腔灌洗液细胞学检查排除潜在腹腔播散。CT在术前分期的准确率为43%-82%,对腹膜转移的检出率不高。而腹膜是胃癌常见的转移部位。术前或术中诊断腹膜转移的发生率高达20%。Memorial Sloan Kettering癌症中心对657例潜在可切除胃腺癌患者采用腹腔镜探查发现31%的患者存在转移,腹膜转移或腹腔灌洗液细胞学阳性则分期为IV期,这部分患者预后差,治疗以全身化疗为主。因此NCCN指南(2B类证据)和中国CSCO指南(1类证据)都推荐T3和或N+的胃癌患者在术前采用腹腔镜探查和腹腔灌洗液细胞学检查以协助发现潜在的转移病灶。此外肛门指检有助于发现盆腔播散病灶。
若完善检查后排除远处转移,患者为局部晚期胃癌,下一步治疗建议进行MDT讨论,根据我国CSCO指南推荐,cT4bNanyM0患者,推荐进行MDT讨论,并鼓励患者参加临床研究。
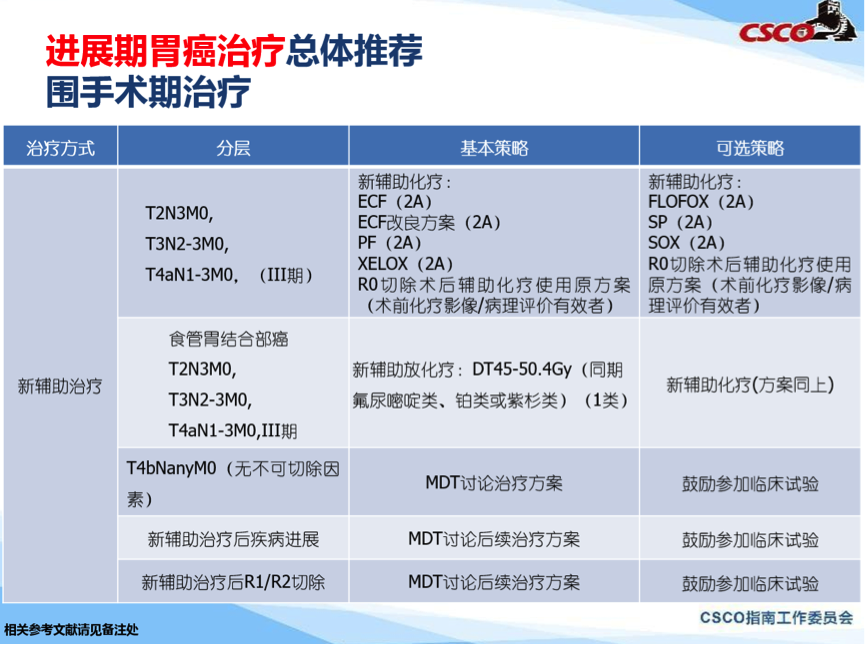 本例患者MDT讨论后选择新辅助治疗-手术-辅助治疗策略的可能性比较大。根据MAGIC和FNCLCC/FFCD研究以及今年ASCO报导的FLOT研究结果,都显示围手术期化疗较单纯手术可以改善局部晚期胃癌患者的预后。NCCN指南和我国CSCO指南均推荐局部晚期胃癌接受围手术期化疗,由于三药方案的不良反应大,目前ECF方案的证据级别是2B类而PF方案的证据级别是1类。胃癌术前放化疗的证据不多,主要依据来源于食管腺癌或胃食管结合部腺癌的数据(Cross研究),本例为胃底体胃大弯病变,暂时不考虑术前放化疗,除非是参加临床研究。
本例患者MDT讨论后选择新辅助治疗-手术-辅助治疗策略的可能性比较大。根据MAGIC和FNCLCC/FFCD研究以及今年ASCO报导的FLOT研究结果,都显示围手术期化疗较单纯手术可以改善局部晚期胃癌患者的预后。NCCN指南和我国CSCO指南均推荐局部晚期胃癌接受围手术期化疗,由于三药方案的不良反应大,目前ECF方案的证据级别是2B类而PF方案的证据级别是1类。胃癌术前放化疗的证据不多,主要依据来源于食管腺癌或胃食管结合部腺癌的数据(Cross研究),本例为胃底体胃大弯病变,暂时不考虑术前放化疗,除非是参加临床研究。
该病例还有一个特殊之处为HER2阳性。ToGA研究结果显示在一线化疗基础上加上曲妥珠单抗可以改善HER2阳性晚期胃癌患者的预后,而曲妥珠单抗能否用于HER2阳性胃癌的新辅助治疗还需要三期临床研究的证据。2014年ASCO会议报道了HERFLOT(II期)研究的结果,这项研究探索的是曲妥珠单抗联合FLOT方案在HER2阳性局部进展期胃癌中的疗效,pCR率为23%;2015年ASCO-GI报道了NEOHX研究的结果,这是一项II期临床研究,旨在探索曲妥珠单抗联合xelox方案在潜在可切除HER2阳性胃癌患者中的疗效,结果发现有效率为39%,R0切除率78%。尽管这两项研究都提示曲妥珠单抗联合化疗在胃癌新辅助治疗中有一定疗效,但仍缺乏III期临床研究的证据,因此除非是参加临床研究,否则暂不考虑曲妥珠单抗作为新辅助治疗的一部分。
综上,我推荐该患者先接受3个疗程的铂类联合氟尿嘧啶方案(PF或xelox方案)化疗,后进行疗效评价,如果有效再进行D2手术切除,R0切除后再行原方案化疗三个疗程。如果是R1/R2切除,可考虑术后放化疗(证据来源INT0116研究)。
1.Nashimoto A, Akazawa K, Isobe Y, et al. Gastric cancer treated in 2002 in Japan: 2009 annual report of the JGCA nationwide registry. Gastric Cancer. 2013 Jan;16(1):1-27.
2.Abdalla EK, Pisters PW. Staging and preoperative evaluation of upper gastrointestinal malignancies. Semin Oncol. 2004 Aug;31(4):513-29.
3.Sarela AI, Lefkowitz R, Brennan MF, Karpeh MS. Selection of patients with gastric adenocarcinoma for laparoscopic staging. Am J Surg. 2006 Jan;191(1):134-8.
4.Cunningham D, Allum WH, Stenning SP, et al. Perioperative chemotherapy versus surgery alone for resectable gastroesophageal cancer. N Engl J Med. 2006 Jul 6;355(1):11-20.
5.Ychou M, Boige V, Pignon JP, et al. Perioperative chemotherapy compared with surgery alone for resectable gastroesophageal adenocarcinoma: an FNCLCC and FFCD multicenter phase III trial. J Clin Oncol. 2011 May 1;29(13):1715-21.
6.2014 ASCO General poster session,Abs 4073.
7.2015 ASCO-GI, General Poster Session, 107.
8.Smalley SR, Benedetti JK, Haller DG, et al. Updated analysis of SWOG-directed intergroup study 0116: a phase III trial of adjuvant radiochemotherapy versus observation after curative gastric cancer resection. J Clin Oncol. 2012 Jul 1;30(19):2327-33.
-------------------------------------
以上为【35 under 35】的观点,您怎么看?欢迎广大肿瘤医生在下方留言发表您的观点!
以上所有点评参考文献略。














 苏公网安备32059002004080号
苏公网安备32059002004080号


