Abstract 7000:momelotinib (MMB)对比芦可替尼(RUX)治疗JAK 抑制剂(JAKi)初治的骨髓纤维化(MF)患者的3期临床研究
背景:在早期的临床试验中,口服的JAKi显示可以缩小脾脏体积,改善疾病相关症状以及降低MF的患者的红细胞输注需求。该研究的目的是为了证实MMB在缩小脾脏体积和改善疾病相关症状症状方面不劣于RUX,而在降低输血需求方面优于RUX。
方法:研究入组标准:IPSS高危、中危2或有症状的中危1的患者;脾脏肋下5cm以上;血小板计数>50K/ul;无2级以上的周围神经病变(PN)。患者根据输血依赖性和血小板计数进行了分层 (<100, 100-200 和>200 K/ul)。所有的患者按照1:1的比例随机接受 MMB 200mg qd 联合 RUX安慰剂 或RUX 20 mg bid联合MMB安慰剂的治疗,治疗时间为24周(双盲期),随后所有患者接受非盲的MMB的治疗。评估项目包括:MRI测定的脾脏体积,患者通过改良的MPN-SAF总症状积分(TSS)报告的症状。主要研究终点是24周时的脾脏缓解率(SRR;较基线脾脏体积缩小35%以上):次要研究终点包括24周时:TSS反应率(较基线下降50%以上)、输血依赖、输血非依赖、输血负荷。
结果:随机到MMB组和随机到RUX组的患者分别有81%(175/215)和93%(201/217)的患者完成了24周的双盲期治疗。治疗效果如表1所示,在双盲期MMB组最常见的3级以上不良反应是血小板减少(7%)和贫血(6%),RUX组最常见的3级以上不良反应是贫血(23%),血小板减少(5%)和中性粒细胞减少(5%)。在MMB组,3级以上的感染的发生率为7%,而RUX组3级以上感染的发生率为3%。在MMB组中,22例患者(10%)需要对紧急出现的PN进行治疗(均<=2级),而在RUX组中为10例患者(9例<=2级,1例为3级),没有一例患者因为PN而停止使用研究药物。总体上来讲,在双盲期中,MMB组中有13%的患者因不良反应停止用药,而RUX组中6%的患者因不良反应停止用药。
结论:在未接受过JAKi治疗的MF患者,24周的MMB在缩脾方面的效果不劣于芦可替尼,但疾病症状控制不及芦可替尼。但MMB的应用可以显著降低输血需求。临床试验信息:NCT01969838.
表1. MMB与RUX的疗效对比

a. 非劣性检测,提示缩脾方面MMB不差于RUX,而症状控制差于RUX
b. 检测MMB是否具有优势,证实MMB在提高输血非依赖性,降低输血依赖,降低输血负荷方面均具有显著优势。
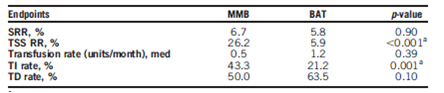
Abstract 7001:momelotinib (MMB)对比最佳可选治疗(BAT)治疗曾接受芦可替尼(RUX)治疗的骨髓纤维化(MF)患者
背景:在早期的临床试验中,口服的JAK抑制剂显示可以缩小脾脏体积,改善疾病相关症状以及降低MF的患者的红细胞输注需求。该研究的目的是为了证实,在用药24周时,在曾经接受过RUX治疗的患者中,MMB在缩小脾脏体积、改善疾病相关症状、降低输血需求方面优于BAT。
方法:研究的入组标准为:原发性MF或者PV/ET后的MF;DIPSS高危,中危2,或中危1伴有症状的患者;接受过4周以上的卢索替尼治疗但仍需输血或者因为3级以上的血小板减少、贫血或出血中的至少一项将药物减量至20mg BID以下的患者;脾脏肋下5cm以上;无2级以上的周围神经病变。研究根据输血依赖性和基线的TSS(改良的MPN-SAF总症状积分)<18或>=18进行分层。所有患者按照2:1的比例接受非盲的MMB 200mg QD治疗或BAT。评估项目包括:MRI测定的脾脏体积,患者通过TSS电子日志报告的疾病相关症状。主要研究终点是脾脏缓解率(SRR;较基线脾脏体积缩小35%以上):次要研究终点包括24周时:TSS反应率(TSS RR,较基线下降50%以上)、输血负荷、输血依赖(TI)、输血非依赖(TD)。
结果:MMB组和BAT组分别有70%(73/104)和77%(40/52)的患者完成了24周的治疗。BAT中88%的患者接受了RUX的治疗,27%的患者接受的为RUN联合其他药物的治疗。两组方法的疗效如表所示。在MMB组最常见的3级以上的不良反应为贫血(13%)和血小板减少(7%);在BAT组,最常见的3级以上的不良反应为贫血(13%),血小板减少(6%)和腹痛(6%),在MMB组,11例(11%)患者出现了治疗相关的周围神经毒性,在BAT组没有出现周围神经毒性。
结论:在曾接受RUX治疗的MF患者,24周MMB治疗在SRR方面不优于BAT,但是显著改善了疾病相关症状、降低了输血依赖性。临床试验信息:NCT02101268.
表2. MMB与BAT的疗效对比
Abstract 7002:伯舒替尼(BOS)对比伊马替尼(IM)治疗初诊的慢性髓细胞白血病(CML):BFORE试验的初步结果
背景:BOS是一种强效的SRC/ABL酪氨酸激酶的双重抑制剂,用于治疗耐药的或者现有治疗不能耐受的Ph+ CML。这项研究对比了BOS与IM一线治疗慢性期(CP)CML的有效性和安全性。
方法:在这项正在进行的,多国的,3期的开放标签的临床研究中,536例患者按1:1的比例随机接受BOS 400mg QD(n=268)或IM 400mg QD (n=268 [3例未治疗])。研究者在487例意向治疗(intent-to-treat,ITT)的患者中进行了进行了分析,疗效指标为e13a2/e14a2转录本的变化。
结果:在>=12个月的随访后,BOS和IM组分别仍有78%和73.2%的患者在接受治疗,中位治疗时长分别为14.1个月和13.8个月。在12个月时,BOS组的主要分子学缓解(MMR)(主要的研究终点)率显著高于IM组(47.2% vs. 36.9%; p=0.02),且BOS组至MMR的时间显著较短(HR 1.34;p<0.02);此外,BOS组12个月时完全细胞遗传学缓解(CCyR)也要显著高于IM组(77.2% vs 66.4%),BOS组至CCyR的时间显著亦显著较短(HR 1.38;P<=0.001)。在3个月时取得BCR-ABLIS <=10%(75.2% vs 57.3%),12个月时的MR4(20.7% vs 12%)与MR4.5(8.1% vs 3.3%)方面,BOS组都要显著优于IM组(p值均<0.025)。BOS组与IM组中分别有1例和4例患者因进展为加速期或发生急变而停止治疗,在BOS组末次用药28天未出现死亡病例而IM组中有4例死亡。安全性数据与既往所知BOS与IM的安全性数据一致。BOS组与IM组中分别有12.7%和8.7%的患者因药物相关毒性反应而停止治疗。BOS组中,3级以上的腹泻(7.8% vs 0.8%),ALT(19% vs 1.5%)与AST(9.7% vs 1.9%)升高更为常见。心血管、周围血管、脑血管不良事件并不常见(3%,1.5% 和 0% BOS vs 0.4%, 1.1% and 0.4% IM;3级以上: 1.5%, 0% 和 0% vs 0%, 0% 和 0.4%)。
结论:接受BOS治疗的患者在12个月时MMR和CCyR的比例显著高于接受IM治疗的患者,取得缓解的速度也要显著快于接受IM治疗的患者。但是BOS所引起的胃肠道不良反应与转氨酶升高更为常见。研究结果表明,BOS可作为一线治疗初诊CP CML的一个重要选择。临床试验信息:NCT02130557.
Abstract 7003:gilteritinib治疗取得的深度分子学缓解显著提高了FLT3突变的复发难治的急性髓细胞白血病的生存
背景:gilteritinib是一种高度选择性的FLT3/AXL抑制剂,在CHRYSALIS I/II 临床试验中(NCT02014558),gilteritinib在FLT3突变 (FLT3mut+)的难治复发(R/R)的AML患者中显示出抗白血病的疗效,特别是在剂量超过80mg/d的情况下。
方法:18岁以上的FLT3mut+的患者接受120或200 mg/d gilteritinib的治疗,利用基线的骨髓穿刺标本与用药后>=1个时间点的标本进行分子学缓解评估。使用120或200 mg/d剂量的原因是其可以产生持续的强有效的FLT3抑制,并具有很高的临床缓解率。通过二代测序的方法来进行FLT3-ITD与FLT定量以评估分子学缓解。使用Kaplan-Meier估计的Cox生存模型确定了FLT3-ITD/总FLT(ITD信号比值)阈值为10-2。
结果:在147例接受120或200 mg/d gilteritinib的FLT3-ITD mut+的患者中,共有80例患者纳入了分析。在80例患者中,55%的患者取得了不同程度的缓解,20例(25%)患者的ITD信号比值<=10-2,在这20例患者中,18例患者的比值<=10-3(主要分子学缓解[MMR]),13例患者的比值<=10-4(微小残留病[MRD]阴性)。取得最小信号比值的中位时间为54天,在ITD信号比例<10-2的患者中,80%的患者取得形态学的完全缓解。ITD信号比值<=10-2,取得MMR或者MRD阴性的患者,与其他患者相比具有更长的中位生存(表格)。
结论: FLT3-ITDmut+ R/R AML接受gilteritinib取得分子缓解与临床缓解及生存的提高显著相关。该研究首次证明AML中使用FLT3抑制剂可以取得分子学缓解,该研究表明ITD信号比值可以预测gilteritinib是否具有持续的临床疗效。临床试验
信息: NCT02014558。
表3.不同组间的生存对比

Abstract 7004: Enasidenib治疗IDH2突变的难治复发的急性髓细胞白血病(R/R AML):一期剂量爬坡试验和扩展研究结果
背景:8-15%的AML患者具有IDH2突变(mIDH2)。mIDH2合成一种致癌的代谢产物,2-羟基戊二酸(2-HG),2-HG导致了DNA和组蛋白的高甲基化,阻断了髓系分化。Enasidenib(AG-221)是一种口服的,选择性的mIDH2蛋白的小分子抑制剂。
方法:该1/2期临床研究评估了enasidenib的在mIDH2髓系肿瘤中的最大耐受剂量(MTD)、药代学、药动学数据、安全性以及临床效果。研究报道了1期试验和扩展研究中所有R/R AML患者的安全性和有效性。
结果:共有239例患者接受enasidenib,在剂量爬坡试验(n=113)中,每天650mg的剂量并未达到MTD。 在接受<100mg/d,100mg/d以及>100mg/d的患者中,2HG较基线下降幅度的中位值分别为92%,90%与93%。基于药代/药动以及有效性的数据100mg QD被确定为扩展研究(n=126)的剂量,enasidenib使用的中位疗程数为5(1-25)。3-4级药物相关的不良反应包括间接胆红素升高(12%)、IDH抑制剂相关的分化综合征(例如,维甲酸综合征;7%)。对于R/R AML患者,总的有效率(ORR)为40.3%,包括34例(19.3%)取得完全缓解(CR;见表格)。取得缓解与细胞分化显著相关,通常没有血细胞增生不良的表现。R/R AML的中位生存(OS)为9.3个月,对于取得CR的患者,中位OS为19.7个月。对于之前接受过>=2种方案的AML患者(n=94;53%),中位OS为8.0个月。
结论:enasidenib的耐受性良好,能够诱导CR。在原方案治疗失败的AML中可以取得大于9个月的中位生存。诱导原始细胞分化并且没有细胞毒性是enasidenib临床有效的关键。临床试验信息:NCT01915498。
表4.enasidenib的疗效数据

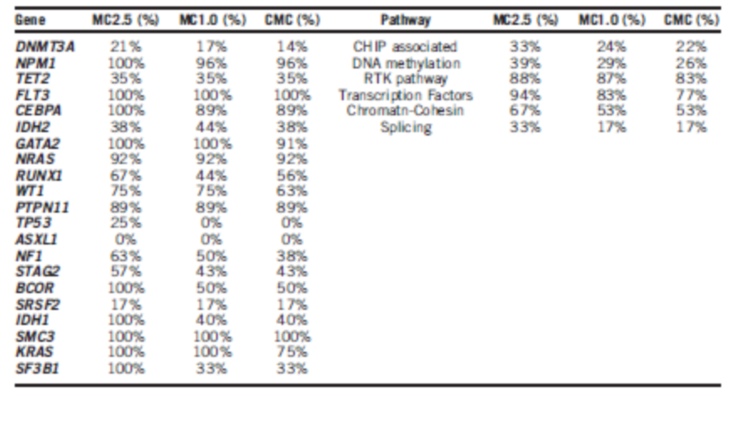
Abstract 7005:体细胞突变清除的不同模式与AML临床预后的相关性
背景:完全缓解(CR)时体细胞突变的持续检出与AML患者的不良预后相关。
方法:本研究中,研究者研究了95例接受一线诱导方案治疗并取得CR的AML患者。研究者通过靶向捕获测序的方法对治疗前与骨髓CR时的标本进行295个基因的测序(平均深度 280×)。研究者定义基于变异等位基因频率(VAF)定义了3个水平的突变清除:MC2.5,突变VAF<2.5%;MC1.0,突变VAF<1.0%;完全的突变清除(CMC)。
结果:在治疗前的标本中,研究者在87(92%)例标本中,检测到了78个基因的597个突变。 在配对的骨髓CR标本中,62(10%)个突变的VAF>=2.5%,而82(14%)个突变的VAF>=1%,相对应的,43 (49%),34 (39%)和 30 (34%)的患者取得了MC2.5,MC1.0和CMC。表1显示了基于突变和通路的不同突变清除(MC)的模式。与克隆性造血(CHIP)、DNA甲基化以及剪切通路有关的基因MC率较低,而转录因子或酪氨酸激酶相关的基因MC率较高。取得MC 1.0 (中位 31.2 vs. 12.5月, P =0.04)和CMC (31.2 vs. 12.5月, P = 0.049)的患者有着更好的无复发生存(RFS)。
结论:CR标本中 CHIP、DNA甲基化以及剪切通路有关的基因持续存在,提示这些突变在白血病发病前即存在。深度MC的患者有着更好的RFS,体细胞突变清除的检测能够用于AML的预后判断。
 Abstract 7006:异基因造血干细胞移植(alloHCT)治疗HIV感染的血液肿瘤:血液与骨髓移植网络(BMTCTN0903)/AIDS恶性肿瘤协作组(AMC-080)试验
Abstract 7006:异基因造血干细胞移植(alloHCT)治疗HIV感染的血液肿瘤:血液与骨髓移植网络(BMTCTN0903)/AIDS恶性肿瘤协作组(AMC-080)试验
背景:在HIV患者中进行alloHCT被认为存在风险,主要是可能出现致死性的感染。研究者首次在一个多中心的前瞻性的研究中,评估了alloHCT的可行性和安全性。
方法:研究的主要研究终点是100天的无复发死亡率(NRM)。入组的患者为:抗病毒药物治疗有效的HIV感染患者;年龄>=15岁;脏器功能正常;取得首次CR后的急性髓细胞白血病(AML)或急性淋巴细胞白血病(ALL),高危的骨髓增生异常综合征(MDS),或者霍奇金(HL)或非霍奇金淋巴瘤(NHL);具有8/8 HLA位点相合的相关供者或至少7/8 HLA位点相合的无关供者。所有患者接受清髓方案(MA)或者减低预处理强度(RI)的方案。在1年时检测不到HIV RNA的患者,使用其CD4细胞进行HIV生长试验(VOA)。
结果:在2012年5月至2015年12月期间,共有17患者进行了alloHCT,所有患者均为男性,其中白种人为11例,非洲裔美国人为3例,其他/未知占3例。中位年龄为47岁(25-64)。相关的血液肿瘤为AML(9),ALL(2),MDS(2),HL(1)和NHL(3)。中位CD4 T细胞的数值为224 (55-833)。8例患者接受MA、9例患者接受RI作为预处理方案。在100天时,无NRM的出现,13例患者处于CR,4例患者出现复发或进展。8例患者取得了完全嵌合。累计的II-IV级的移植物抗宿主反应(GHVD)发生率为41% (95%CI:18%-64%)。6个月时的OS率为82% (95% CI 55%-94%),9例患者取得完全嵌合。在1年时,OS率为57% (95% CI:31%-77%)。8例患者死亡,5例患者由于疾病进展或复发,1例由于急性的GVHD,1例死于成人呼吸窘迫综合征,1例死于肝衰竭。在混合嵌合的3例患者中,2例患者经VOA检测仍存在HIV感染;而在2例完全嵌合的患者中,VOA检测未能检测到HIV感染。存活的患者中位随访时间为24个月(7-27个月)。
结论:接受MA或RI alloHCT的伴HIV感染的血液肿瘤患者在100天时未出现NRM,在1年时未出现感染相关死亡。在符合标准的前提下,alloHCT可以作为HIV感染血液肿瘤患者的标准治疗。临床试验信息:NCT01410344。
Abstract 7007:奥英妥珠单抗(inotuzumab ozogamicin, InO)对比传统化疗(C)治疗难治/复发急性淋巴细胞白血病(R/R ALL):影响异基因造血干细胞移植(HSCT)结局的预后因素
背景:在3期的INO-VATE(NCT01564784; Kantarjian NEJM 2016)的临床试验中,InO治疗R/R ALL相比与C取得了更好的完全缓解(CR)/CR伴不完全血液学恢复(CRi);相比C,接受InO治疗的患者中,更多的患者接受了序贯的HSCT (41% [45/109] vs 11% [12/109]; P<0.001)。本研究描述了影响接受HSCT后结局的因素。
方法:研究的所有的数据均已发表,利用多因素Cox回归模型进行无复发死亡(NRM)和总生存(OS)的多因素分析。
结果:截止 2016年3月8日,326例患者中共有108例患者接受了异基因HSCT(InO:77;C:n=31)。除InO组的血小板要低于C组之外,InO与C组之间的基线特征相似。InO组相比C组,更多的患者取得了微小残留病阴性(MRDneg:71% vs 26%;p<0.0001)。在InO组中,在HSCT前接受其他方案治疗的比例于C组相比显著较低(14% vs 55%, P<0.0001)。InO组相比于C组,1年时(36% [95% CI 26–47] v 20% [8–36])和2年时(39%[27–51] v 31% [13–51])的非复发死亡率较高,但1年(23% [15–33] v 29% [13–48])与2年(33% [22–44] v 46% [24–65]) 时的疾病复发率显著较低。 两组患者在HSCT之后的生存无显著差异。但是,生存曲线表明,15个月前后两组的生存率之间的差异发生了显著变化(1 年, 44% [95% CI 33–55] v 65% [44–79];2年, 39% [28–50] v 34% [15–54])。在InO组中,5例患者出现了致死性的肝静脉闭塞病(VOD)(在HSCT后100天之内),C组患者内没有出现此类病例。多因素分析显示,移植方案中不包含两种烷化剂和塞替派与较低的NRM与HSCT后较好的生存相关。
结论:与C相比,接受InO的R/R ALL序贯 HSCT的患者中取得CR/CRi伴MRD阴性患者较高。尽管在InO组中,NRM与致死性VOD的患者较高,InO的患者能够取得长期生存。在之前接受过InO治疗的患者中,应该避免使用含有两种烷化剂特别是含塞替派的方案,以此来降低NRM及提高HSCT后的OS。临床试验信息:NCT01564784.
Abstract 7008:CD19 CAR(19-28z) T-细胞治疗成人复发B-ALL取得长期生存
背景:CD19特异的CAR-T细胞治疗复发的B-ALL患者取得很高的初始缓解率。然而,决定是否能够取得持久临床缓解的临床特征仍不清楚。因此,研究者报道了19-28z CAR T细胞治疗复发B-ALL的I期临床试验结果(NCT01044069),试图确定与长期生存和较低毒性相关的因素。
方法: 在接受预处理治疗后,复发的成人B-ALL患者接受自体CAR-T细胞回输。在T细胞回输之前,通过骨髓活检来评估疾病负荷。原始细胞<5%的患者被归为微小残留病(MRD)组,而原始细胞>=5%的患者形态学病变组(morphologic disease cohort)。在T细胞回输后4周时进行疗效评估。中位随访时间为18个月 (范围, 0.2-57.3)。
结果:51例患者接受了CAR-T细胞治疗,20例患者处于MRD状态而31例处于形态学病变状态。 两组患者接受CAR-T治疗后的完全缓解(CR)率相当(95%与77%)。但是,在取得MRD阴性CR的42例患者中,MRD组与形态学病变组在无事件生存(中位:未达到, 95% CI : 4.2-未达到; vs 6.3个月, 95% CI, 4.8-9.0;) (p = 0.0005) 和总生存(中位:未达到, 95% CI :15.3-未达到; vs 中位 17个月,95% CI, 8.5 – 36.2; )(p = 0.0189)。在两组患者中,随后的异基因HSCT均未能提高生存(p=0.8)。MRD组出现的严重的细胞因子释放综合征和神经毒性更低,这两种毒副反应的出现均与CAR T细胞扩增的峰值相关(p = 0.0326与 p = 0.0001)。
结论:尽管两组患者在CAR-T治疗取得的CR率方面没有显著差异,但是CAR-T细胞治疗前较低的疾病负荷与CAR-T 细胞治疗的持续缓解和较长的生存相关,同时,异基因移植似乎并不能提高CAR-T 细胞治疗的疗效。该研究强烈支持,应在B-ALL形态学复发之前使用CD19 CAR T细胞治疗。临床试验信息:NCT1044069。
ASCO点评专家评选:欢迎对以上ASCO研究进行留言点评,我们将评选出最好的3位给予奖励!
欲了解更多血液肿瘤、淋巴瘤相关资讯,与全国各地血液肿瘤、淋巴瘤医生交流与讨论,请扫描以下二维码,添加肿瘤资讯小助手-Dinna微信,备注“血液肿瘤”!
http://am.asco.org/abstracts











 苏公网安备32059002004080号
苏公网安备32059002004080号


