2026年美国临床肿瘤学会胃肠道肿瘤研讨会(ASCO GI)于美国旧金山召开。来自韩国首尔国立大学医院的Do-Youn Oh教授在大会现场发表了题为“Claudin 18.2 Therapies for Gastroesophageal Cancer: New Kid on the Block”的专题演讲,系统阐述了CLDN18.2作为胃食管癌新兴治疗靶点的生物学特征、已获批药物的临床证据、靶向治疗相关毒性的管理策略,以及单克隆抗体、抗体药物偶联物(ADC)、双特异性抗体和嵌合抗原受体T细胞(CAR-T)等多元化治疗平台的研发进展。这一演讲为临床医生和研究者全面呈现了CLDN18.2靶向治疗的当前格局与未来方向,具有重要的学术参考价值。【肿瘤资讯】特此整理讲题重要内容。

CLDN18.2的生物学特征:瘤内异质性与免疫微环境
CLDN18.2是一种紧密连接蛋白,近年来已被证实为胃食管癌领域的新型治疗靶点。Do-Youn Oh教授在演讲开篇即指出,目前已有获批的CLDN18.2靶向药物进入临床应用,同时多种作用机制的靶向制剂及新型联合治疗策略正在积极探索中,以期进一步改善患者的临床结局。
在CLDN18.2的生物学特征方面,Do-Youn Oh教授重点强调了瘤内异质性问题。研究显示,当采用全切片与组织芯片进行表达模式比较时,在至少一个芯片核心呈CLDN18.2阳性的病例中,61.3%存在异质性表达。此外,CLDN18.2阳性胃癌的免疫微环境呈现独特特征:与阴性肿瘤相比,CLDN18.2阳性肿瘤的外周区域CD3+和CD4+ T细胞密度更高,肿瘤中心区域CD8+ T细胞密度亦更高,这一发现为后续联合免疫治疗策略提供了理论依据。
靶点验证:两项全球III期研究奠定CLDN18.2治疗地位
CLDN18.2之所以被确立为胃食管癌的新靶点,源于两项全球III期临床研究SPOTLIGHT和GLOW的阳性结果。这两项研究纳入HER2阴性、CLDN18.2阳性(≥75%的肿瘤细胞膜中等-强着色)的晚期胃或胃食管结合部腺癌患者,在化疗基础上联合佐妥昔单抗一线治疗可使患者的死亡风险降低约25%(图1),且未对健康相关生活质量(HRQoL)产生负面影响(图2)。
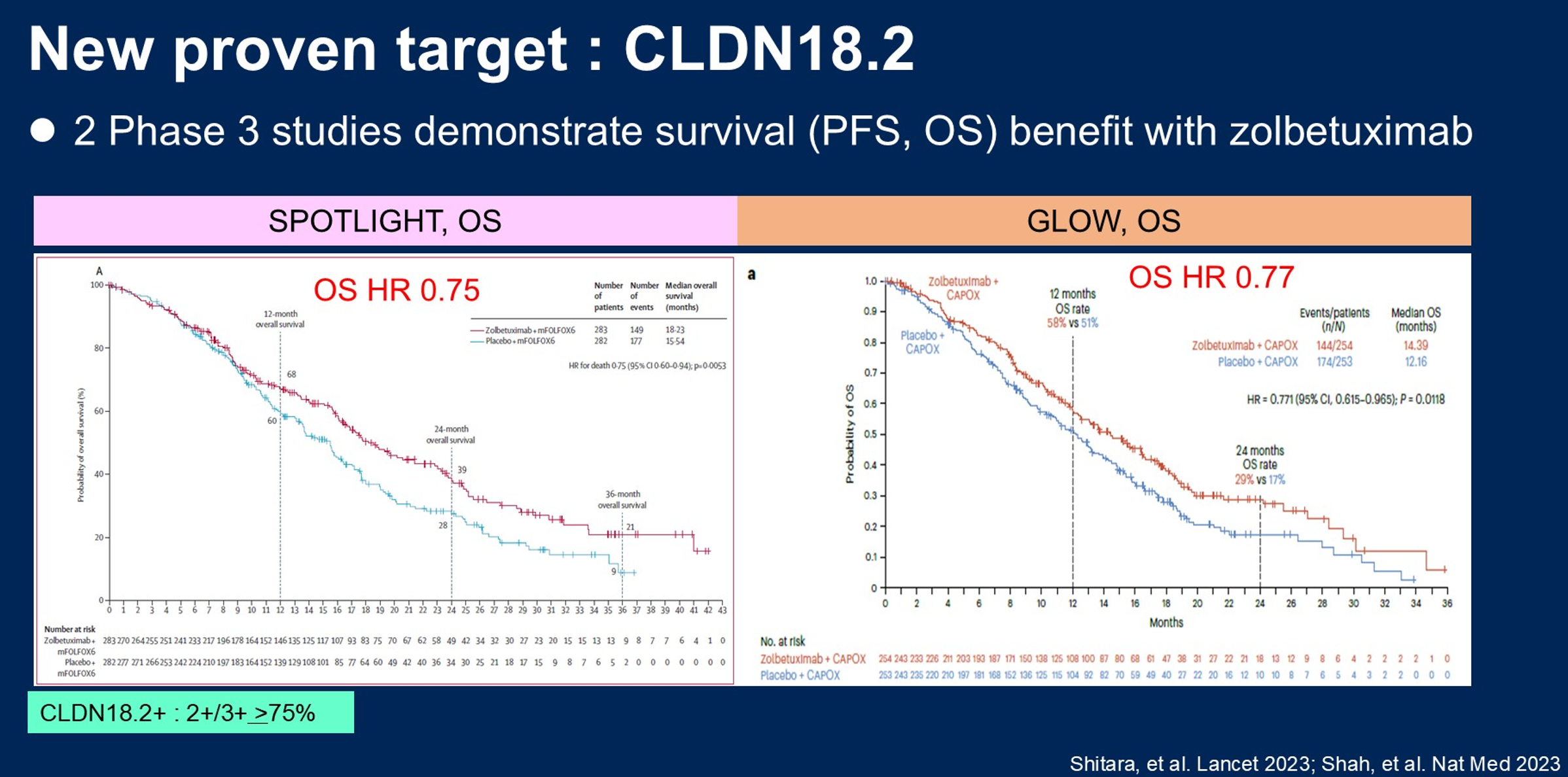
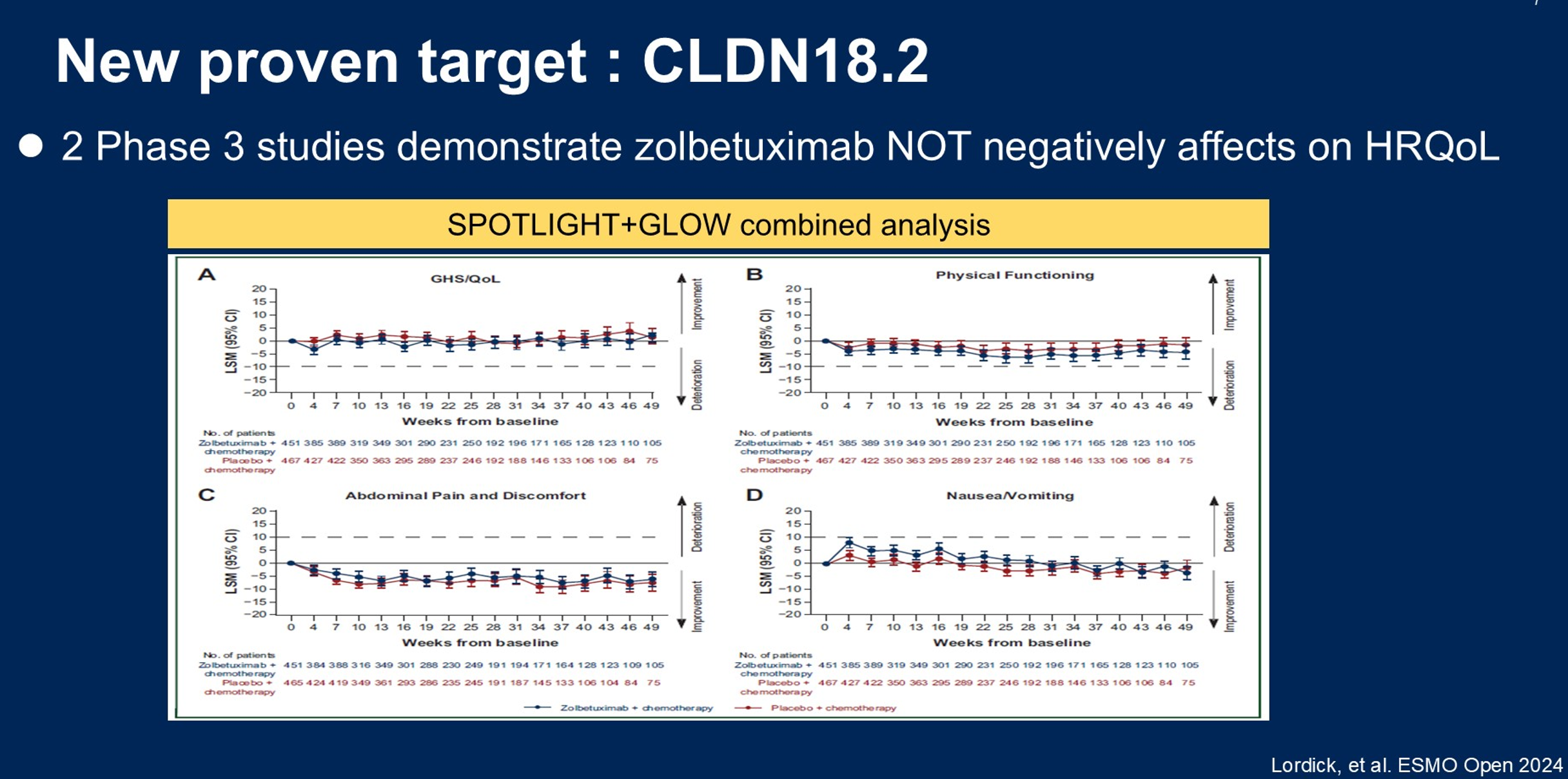
靶向治疗相关毒性:CLDN18.2相关性胃炎的识别与管理
然而,CLDN18.2靶向治疗的“on-target off-tumor”毒性需要临床高度关注,其中最具特征性的是CLDN18.2相关性胃炎。Do-Youn Oh教授指出,CLDN18.2相关性胃炎是该靶点靶向治疗的共性毒性。内镜评估显示,单抗最常见的表现为黏膜红斑,其次为糜烂、水肿和白色渗出物,约70%的患者同时呈现多种特征。在接受CLDN18.2 T细胞衔接器治疗8周后,内镜随访同样可见黏膜糜烂、水肿和红斑,活检显示伴有消化性碎屑的炎性肉芽组织。类似地,CLDN18.2 ADC治疗6周后的内镜随访亦显示黏膜糜烂,活检呈活动性胃炎伴炎性肉芽组织,停药约4周后胃黏膜可有所改善。这种胃炎与更高的胃肠道毒性相关,包括厌食、恶心、呕吐加重及白蛋白水平下降。因此,早期积极干预恶心、呕吐对于维持治疗至关重要,措施包括使用强效止吐药、调整输注速度以及必要时中断输注。
单克隆抗体:从佐妥昔单抗到联合免疫治疗的探索
在CLDN18.2靶向药物的开发方面,Do-Youn Oh教授介绍了单克隆抗体、ADC、双特异性抗体和CAR-T四大类别。
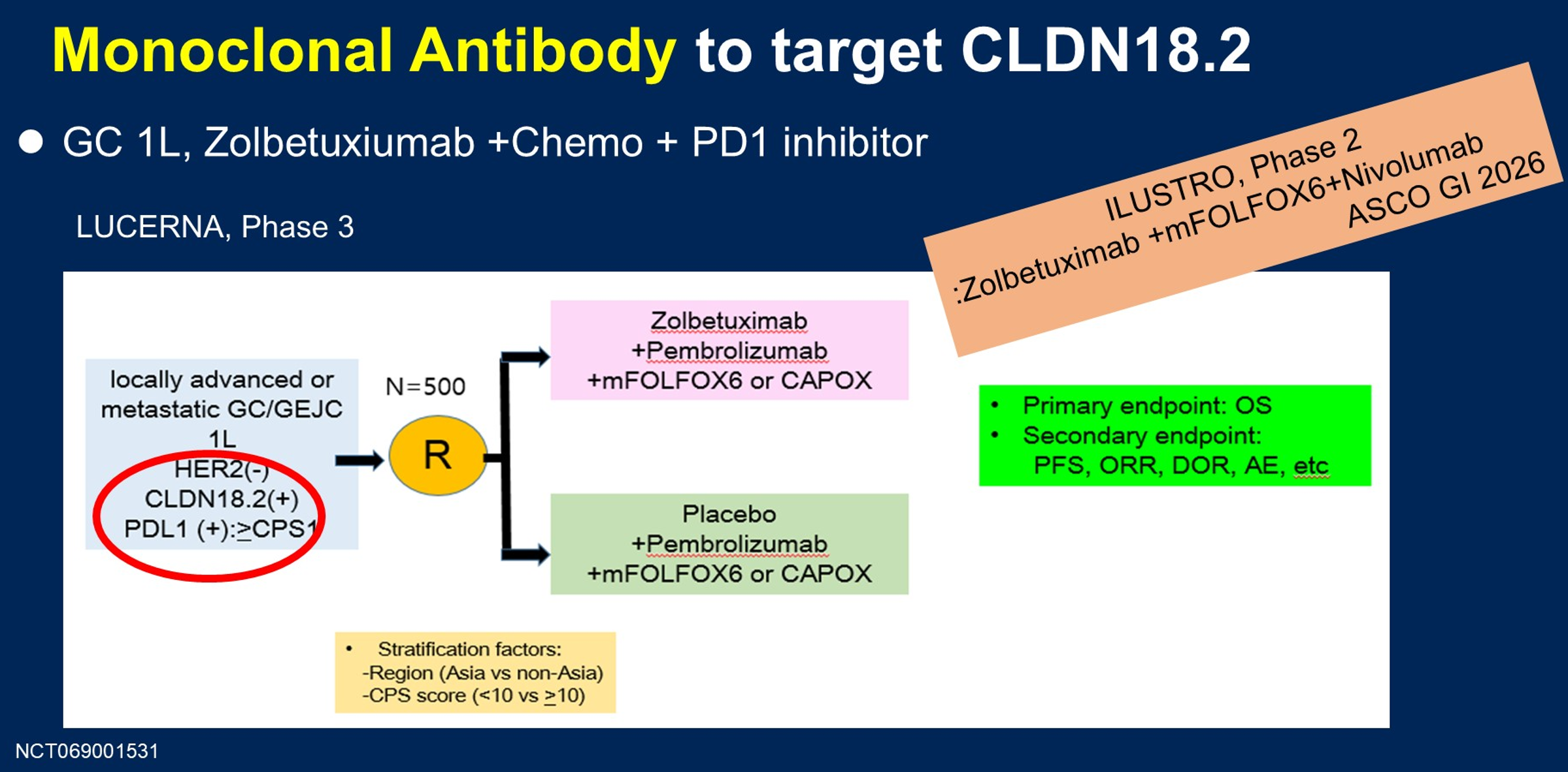
目前,佐妥昔单抗是唯一获批的CLDN18.2单克隆抗体。为进一步改善患者的预后,联合免疫检查点抑制剂(ICI)的策略正在积极探索。根据CLDN18.2和PD-L1表达状态的不同组合,肿瘤免疫微环境呈现多样化特征,这为联合治疗提供了理论支持。2026 ASCO GI大会上报告了ILUSTRO II期研究队列4的结果,该研究评估了佐妥昔单抗联合mFOLFOX6和纳武利尤单抗的疗效(图3),结果显示该联合方案具有令人鼓舞的抗肿瘤活性和可控的安全性。目前,全球III期研究LUCERNA正在进行,该研究纳入了HER2阴性、CLDN18.2阳性、PD-L1 CPS≥1的患者,随机接受化疗联合帕博利珠单抗±佐妥昔单抗一线治疗(图3)。
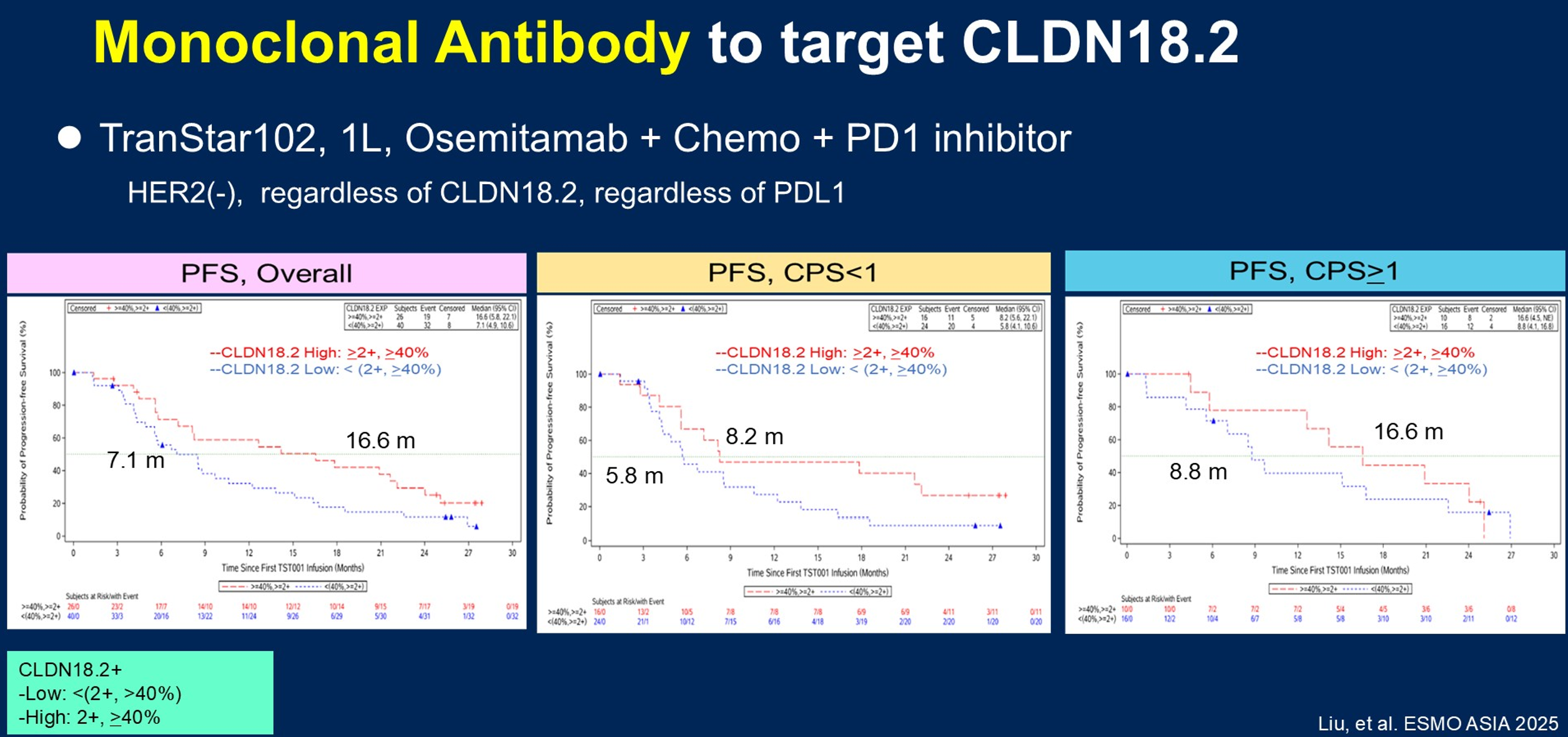
其他单克隆抗体亦在研发中。Osemitamab(TST001)是其中的代表,其对CLDN18.2和Fc受体的亲和力高,可产生很强的抗体依赖性细胞毒性(ADCC)和补体依赖性细胞毒性(CDC)效应。在肿瘤小鼠模型和患者来源异种移植(PDX)模型中,Osemitamab联合化疗和PD-1抑制剂显示出良好的抗肿瘤活性。TranStar102研究在HER2阴性患者(不限CLDN18.2和PD-L1表达状态)中评估了Osemitamab联合化疗和PD-1抑制剂一线治疗的疗效。在所有患者中,采用≥2+/≥40%标准定义的CLDN18.2高表达亚组客观缓解率(ORR)达68%,中位缓解持续时间(mDOR)为18个月,中位无进展生存期(PFS)为16.6个月。亚组分析显示,PD-L1 CPS≥1的患者和CLDN18.2高表达患者均呈现更优的PFS趋势(图4)。当前TranStar 301 III期研究(一线治疗)已在规划中。
抗体药物偶联物(ADC):靶点表达cut-off值的确定与应用探索
ADC作为靶向CLDN18.2的另一重要手段,其活性与CLDN18.2表达水平密切相关。Do-Youn Oh教授指出,在胃癌细胞系中,CLDN18.2的表达通常较低,仅SNU-601细胞系具有较高的内源性表达。研究显示,在同一细胞系中通过转染构建不同CLDN18.2表达水平的细胞后,ADC的活性与CLDN18.2表达水平呈良好相关性,提示在开发CLDN18.2 ADC时,靶点表达cut-off值的确定是关键问题。
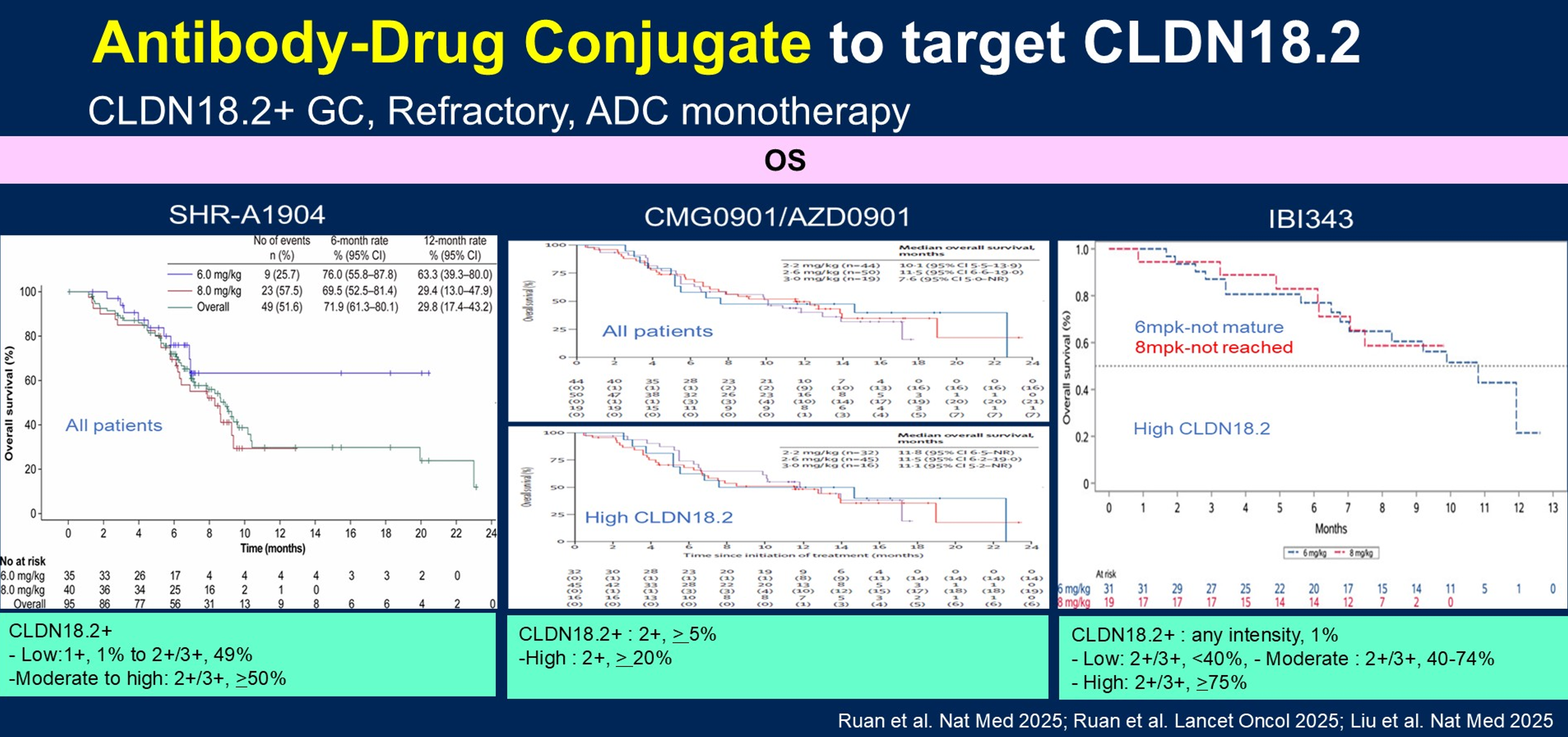
目前多种CLDN18.2 ADC正在研发中,以SHR-A1904、CMG0901/AZD0901和IBI343为代表,它们具有不同的载荷和Fc效应功能特征。需要指出的是,不同临床试验对CLDN18.2阳性的定义及高表达与低表达的分界标准差异较大,目前尚无统一共识。在CLDN18.2阳性复发性胃癌的治疗中,上述三种ADC单药治疗的ORR为19.3%~33%,部分情况下可达47%;mPFS为5~6个月,mOS为10~11个月(图5)。在安全性方面,ADC最常见的不良事件为血液学毒性;SHR-A1904、CMG0901/AZD0901和IBI343的3-4级恶心的发生率分别为4.2%、4%和1.7%,3-4级呕吐的发生率分别为5.3%、10%和2.6%。目前已有多项III期研究正在进行,评估CLDN18.2 ADC在二线及以上治疗中的疗效,对照组为研究者选择的化疗方案,试验组为上述三种ADC单药治疗。
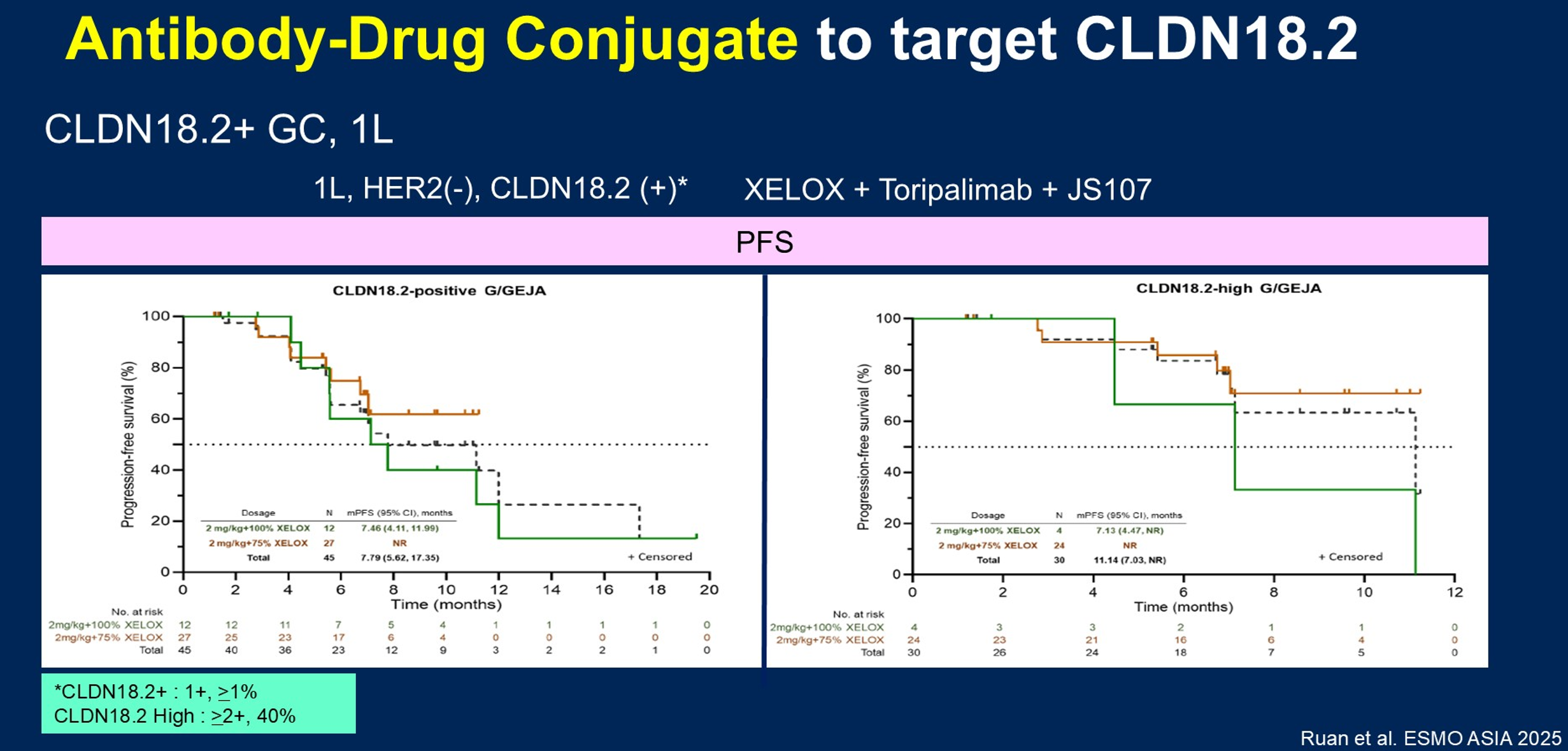
一线治疗领域,有研究在HER2阴性、CLDN18.2阳性患者中评估了CLDN18.2 ADC JS107联合XELOX和特瑞普利单抗的疗效和安全性。结果显示,总体ORR为80%;采用≥2+/40%标准定义的CLDN18.2高表达人群的ORR达86.7%,mPFS超过11个月(图6),治疗相关不良反应(TRAEs)可控。基于这些结果,一项III期临床试验已在规划中,拟在一线CLDN18.2高表达患者中验证该联合方案的疗效。
双特异性抗体:T细胞衔接器与4-1BB双抗的双轨并进
双特异性抗体是靶向CLDN18.2的又一重要手段,其中CLDN18.2×CD3 T细胞衔接器是当前药物研发的热点领域。Do-Youn Oh教授以IBI389、AZD5863、ASP2138、AMG910等为例介绍了不同T细胞衔接器的独特结构。在CLDN18.2阳性复发性胃癌的治疗中,T细胞衔接器单药治疗的初步数据显示,IBI389的ORR为30.8%,DCR为73.1%,mPFS为3.5个月(图7)。目前,T细胞衔接器正在与化疗联合或与免疫治疗联合进行探索。

除了T细胞衔接器外,4-1BB双特异性抗体是另一值得关注的药物。研究发现,CLDN18.2阳性肿瘤细胞与4-1BB+/CD4+ T细胞及4-1BB+/CD8+ T细胞在空间上紧密相邻。基于此,CLDN18.2×4-1BB双特异性抗体Givastomig在CLDN18.2阳性复发性胃癌治疗中进行了单药探索,确认的ORR为16%,即使未常规预防性使用止吐药,恶心、呕吐反应仍轻微(3-4级 1%)。在CLDN18.2阳性胃癌中,Givastomig联合纳武利尤单抗和mFOLFOX6方案一线治疗的ORR达71%~83%(剂量递增/扩展),不良反应良好(无3-4级恶心、呕吐)(图8)。鉴于此,随机对照研究已在规划中。

CAR-T治疗:Satri-cel的突破与未来优化方向
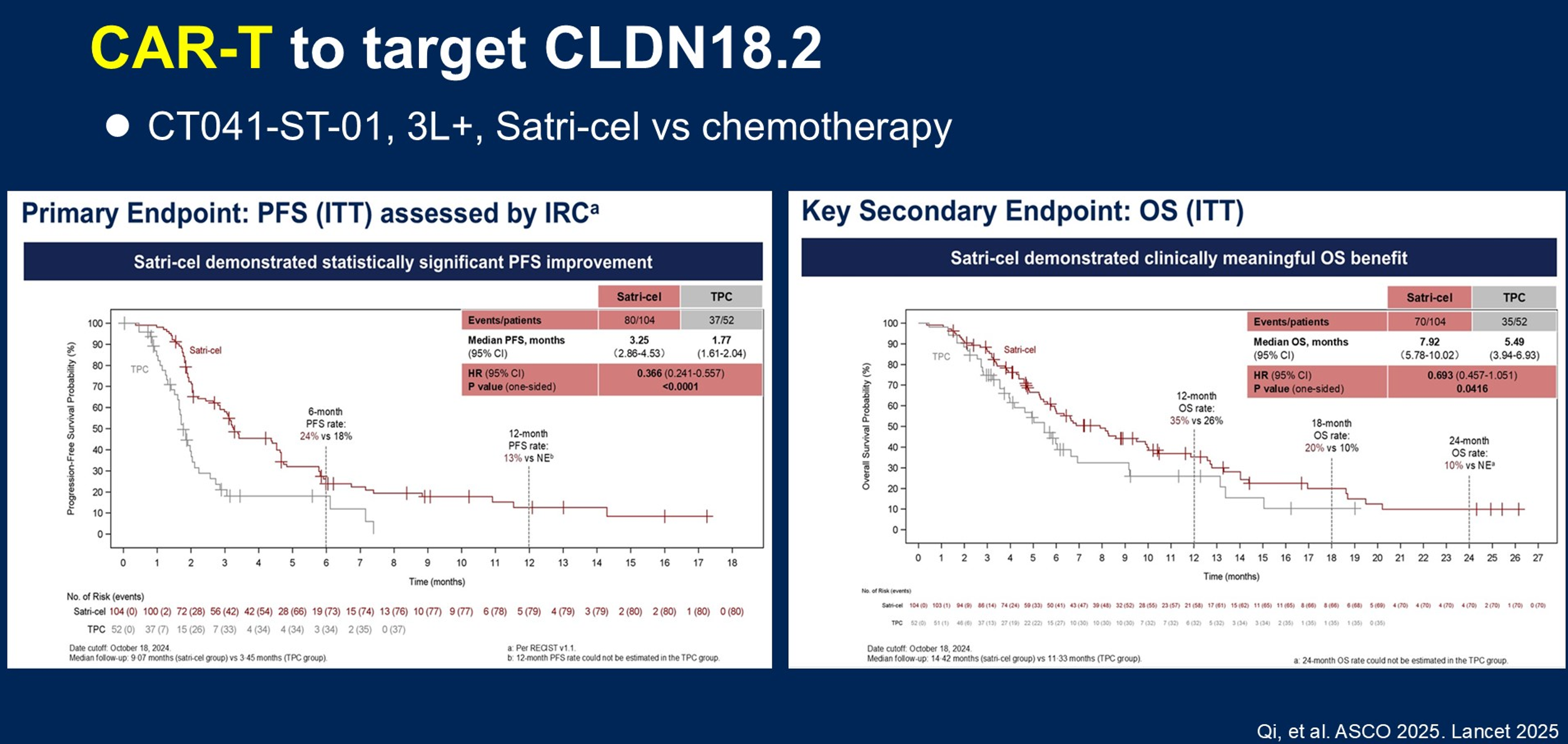
CAR-T治疗是靶向CLDN18.2的前沿领域,但在胃食管癌中的应用面临诸多挑战,包括肿瘤微环境特征、抗原异质性、CAR-T细胞的运输与浸润、持久性问题、相关毒性、高昂的生产成本,以及缺乏标准化方案和监管协调。尽管如此,Satri-cel(CLDN18.2 CAR-T)的阳性结果表明,CAR-T在胃食管癌中的应用是可行的。在一项开放标签、多中心、随机对照研究中,晚期胃癌患者(CLDN18.2表达采用2+、3+/≥40%标准)按2:1比例随机接受CLDN18.2 CAR-T Satri-cel或医生选择的化疗方案三线及以上治疗。结果显示,Satri-cel组PFS显著改善(mPFS 3.25个月 vs 1.77个月),同时带来具有临床意义的OS获益(mOS 7.92个月 vs 5.49个月)(图9),ORR为30%,而对照组仅为4%。在机制层面,研究发现外周血中存在特定的中性粒细胞亚群,在Satri-cel输注后第3天和第7天扩增,抑制初始T细胞功能,可能与CAR-T耐药相关。在安全性方面,Satri-cel组TRAEs发生率较高,但多为1-2级,主要的3-4级TRAEs为血液学毒性。大部分患者发生了细胞因子释放综合征(CRS),但3-4级CRS仅为4.5%。
Do-Youn Oh教授指出,CAR-T细胞治疗目前仍存在诸多局限,包括部分患者因疾病快速进展无法在采集后完成输注,提示在生产工艺和采集时机方面仍有较大改进空间。理论上,CAR-T的优化方向包括逆转肿瘤微环境、联合其他作用机制药物(如T细胞衔接器、免疫检查点抑制剂、ADC和疫苗),以及探索通用型CAR-T细胞。目前,多项CLDN18.2 CAR-T临床试验正在胃食管癌领域开展。
排版编辑:肿瘤资讯-Marie












 苏公网安备32059002004080号
苏公网安备32059002004080号


