近日,由四川大学华西医院肝脏外科文天夫教授及其团队牵头开展的一项前瞻性、多中心II期临床试验(LEN-TAP研究)结果,正式发表于国际顶级医学期刊Signal Transduction and Targeted Therapy(IF 52.7)。该研究聚焦于不可切除的肝细胞癌(uHCC)的转化治疗难题,不仅证实了“仑伐替尼+经动脉化疗栓塞(TACE)+PD-1抑制剂”三联方案在提高挽救性肝脏切除(SLR)率及病理缓解率方面的卓越表现,更通过探索性生物分子研究首次揭示了外周HLA-DR⁺CD38⁺CD8⁺ T细胞亚群作为疗效预测生物标志物的潜力。这一成果为uHCC患者从“不可切除”走向“根治性切除”提供了高级别循证医学证据,标志着我国在肝癌综合转化治疗领域迈出了坚实一步。

四川大学华西医院肝脏外科学科主任
四川省学术技术带头人
中国医疗保健国际交流促进会常务理事
中国医疗保健国际交流促进会肝胆疾病学分会主任委员
中国医师协会肝癌专业委员会副主任委员
中国医师协会外科医师分会常委
四川省肿瘤学会肝癌专业委员会主任委员
四川省医促会肝胆外科分会主任委员
中国抗癌协会肝癌专业委员会前副主任委员
四川省医师协会器官移植分会前会长
四川省抗癌协会肝癌专委会前主委
主持国家135重大专项和重点研发计划子课题、国家自然基金等项目
发表论文300余篇, 其中第1或通信的SCI论文110篇
主编《肝细胞癌切除患者全程多学科规范化管理》(人卫社,2021)
研究背景
转化治疗(Conversion Therapy)旨在通过高强度的系统治疗联合局部治疗,使初始不可切除的肝癌降期并实现挽救性肝脏切除(SLR),是改善中晚期肝癌预后的关键。仑伐替尼作为一线标准靶向药物,具有缩瘤作用;TACE通过局部栓塞诱导肿瘤坏死并释放抗原;而PD-1抑制剂则可增强系统抗肿瘤免疫。临床前研究提示,TACE诱导的缺氧可能导致VEGF上调,而仑伐替尼可拮抗此效应并优化免疫微环境,三者具有显著的生物学协同潜力。基于此,文天夫教授团队开展了LEN-TAP研究,旨在通过前瞻性试验评估该LEN-TAP方案对比单用TACE在uHCC转化治疗中的临床获益及安全性,并探索能够预测疗效的生物标志物。
研究方法
研究设计与人群
LEN-TAP研究是一项前瞻性、随机、开放标签、多中心II期临床试验(NCT04997850)。入组标准包括:年龄18~70岁、经确诊的uHCC(BCLC B/C期)、Child-Pugh A/B级、ECOG评分≤ 1分。2020年10月至2021年11月期间,共纳入142例符合条件的患者。
随机化与干预措施
纳入患者按1∶1比例随机分配至LEN-TAP组(n=71)或TACE组(n=71)接受:
LEN-TAP组:口服仑伐替尼(体重≥60 kg者12 mg/d,<60 kg者8 mg/d)、TACE(仑伐替尼开始2周后进行)、PD-1抑制剂(信迪利单抗或卡瑞利珠单抗,TACE后2周开始,每3周一次)。
TACE组:仅接受TACE治疗。
终点指标与评估
主要终点为SLR率。次要终点包括mRECIST标准评估的客观缓解率(ORR)、总生存期(OS)、无事件生存期(EFS)、无复发生存期(RFS)以及安全性。此外,研究通过单细胞测序(scRNA-seq)对外周血单个核细胞(PBMC)进行了生物标志物探索性分析。
研究结果
基线特征
纳入患者中,91.5%为男性,81.7%具有HBV感染背景。两组基线特征基本均衡,但LEN-TAP组的平均最大肿瘤直径显著大于TACE组(11.1±3.7 vs 8.7±4.1 cm,P<0.001),提示该组面临更严峻的肿瘤负荷挑战。
疗效
SLR率:中位随访时间为24.2个月。结果显示,LEN-TAP组的SLR率显著优于TACE组(59.2% vs 18.3%,P<0.001)。
ORR :根据mRECIST标准,LEN-TAP组ORR高达78.9%,远高于TACE组的16.9%(P<0.001)。
OS:生存获益方面,LEN-TAP组中位OS尚未达到,显著优于TACE组的23.0个月(HR 0.48,95%CI 0.31~0.75,P<0.001)(图 1A)。
EFS和RFS: LEN-TAP组的中位EFS为20.03个月,远超TACE组的6.52个月(HR 0.36,95%CI 0.24~0.54,P<0.001)(图 1B)。对于成功手术的患者,LEN-TAP组的中位RFS为36.6个月,显著长于TACE组的19.0个月(HR 0.45,95%CI 0.17~1.20,P=0.048)(图1C)。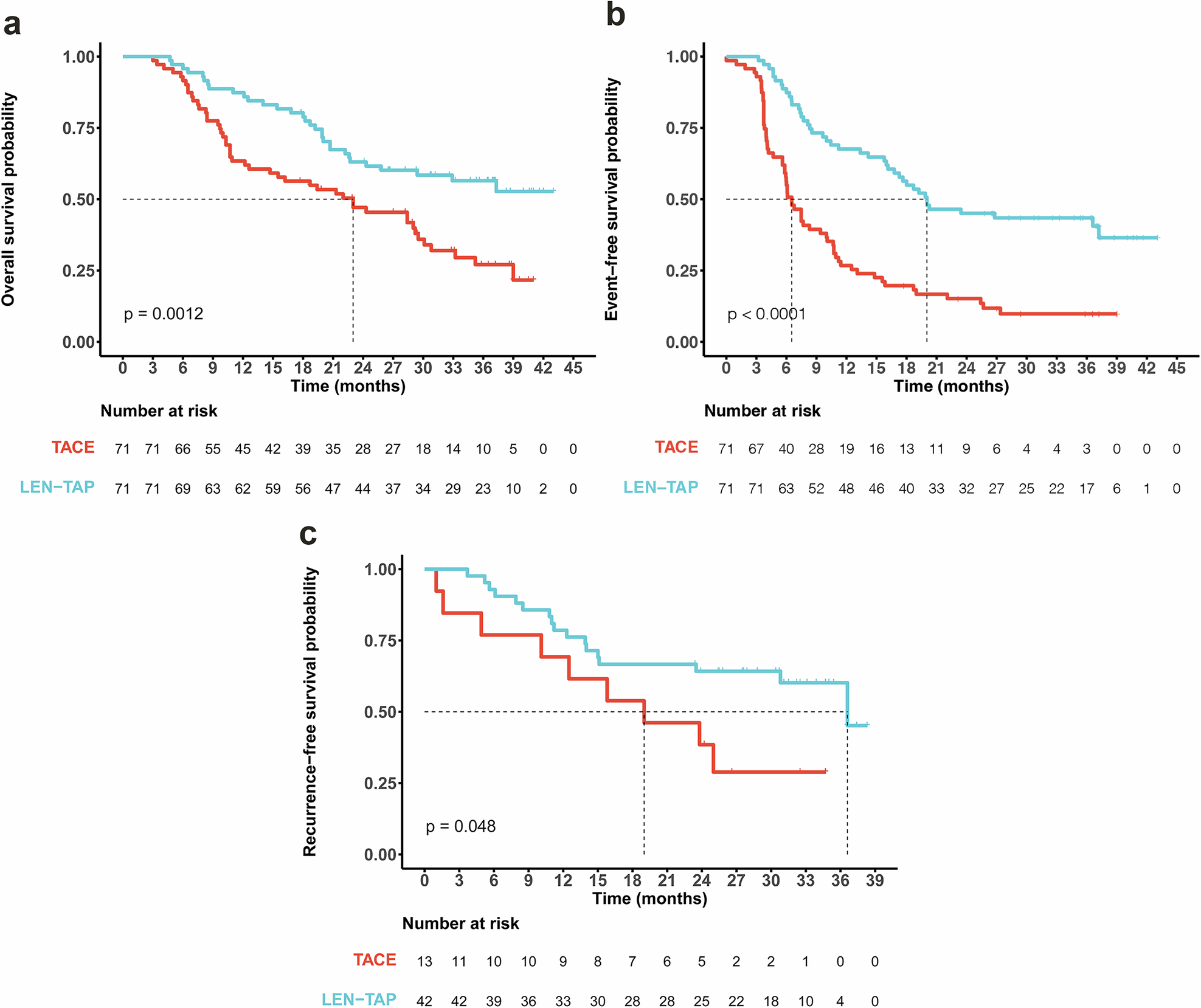
图1 (A)OS结果、(B)EFS和(C)RFS结果
病理缓解情况
LEN-TAP组手术患者中,病理完全缓解(pCR)率高达40.5%(17/42),主要病理缓解(MPR)率达71.4%(30/42),显著优于TACE组(pCR率0%;MPR率23.1%)。此外,LEN-TAP组手术标本的微血管侵犯(MVI)发生率仅为16.7%,提示治疗有效改善了肿瘤生物学特征。
探索性生物分子研究
单细胞测序及流式细胞术分析发现,在治疗过程中,疾病缓解(PR/CR)患者的外周血中HLA - DR+CD38+CD8+ T细胞的比例在首剂PD-1抑制剂治疗后显著高于疾病无缓解(PD/SD)患者(16.68±7.02% vs 4.66±1.24%),且与良好的治疗响应(PR/CR)呈正相关,提示其可能作为预测治疗响应的生物标志物。机制研究证实,三联方案通过激活CXCR6-PI3K-AKT信号轴驱动了这群高效抗肿瘤T细胞的扩增与功能发挥。
安全性
LEN-TAP组3级治疗相关不良事件(TRAE)发生率为60.6%,显著高于TACE组的21.1%(P<0.001),主要表现为手足皮肤反应、血小板减少、高血压等,但未发生4级及以上严重毒性。不良事件通过剂量调整可控,未增加围手术期并发症风险,证实了该方案作为转化治疗的安全性。
结论
本研究首次通过前瞻性II期临床试验证实,LEN-TAP方案(仑伐替尼、TACE联合PD-1抑制剂)可显著提高uHCC患者的SLR率,并带来显著的生存获益,安全性特征虽较单用TACE复杂,但整体可控。此外,研究还发现外周血中HLA-DR⁺CD38⁺CD8⁺ T细胞可作为潜在响应预测标志物,并揭示了CXCR6–PI3K–AKT信号通路在该联合治疗免疫调控中的关键作用。这些发现不仅为uHCC转化治疗提供了新的一线选择,也为个体化治疗与疗效预测提供了重要生物学依据。
讨论:亮点解读
突破性的转化率
LEN-TAP研究的突破性转化率首先归功于靶向、免疫与局部治疗在空间和时间上的深度协同。TACE不仅能造成肿瘤细胞的机械性坏死,更重要的是其诱导的炎症环境能够促进新抗原释放,这与仑伐替尼改善免疫微环境及PD-1抑制剂激活T细胞的能力完美结合。
改善患者预后
该研究带来的病理学启示同样值得关注。对于伴有血管侵犯(BCLC C期)的患者,LEN-TAP组不仅手术转化率高,且术后微血管侵犯(MVI)发生率较低(16.7%),提示该方案可能有利于调节uHCC的肿瘤生物学,从而降低复发风险。
发现新型生物标志物
在转化预测方面,外周血HLA-DR+CD38+CD8+ T细胞亚群的发现具有里程碑意义,可作为预测LEN-TAP疗效的非侵入性生物标志物,其通过CXCR6-PI3K-AKT通路发挥作用。这一发现为未来筛选优势人群、实现个体化精准转化治疗提供了重要的理论依据和检测手段。
Zhang X, Cai H, Peng W, et al. Lenvatinib plus transarterial chemoembolization and PD-1 inhibitors as conversion therapies for unresectable intermediate-advanced hepatocellular carcinoma: a phase 2 trial and exploratory biomolecular study. Signal Transduct Target Ther. 2026;11(1):37. doi: 10.1038/s41392-025-02498-z.
排版编辑:肿瘤资讯-ZJN











 苏公网安备32059002004080号
苏公网安备32059002004080号


