肺癌是世界范围内最常见的恶性肿瘤,传统化疗的全身性毒性、靶向治疗与免疫治疗的耐药困境,仍是临床面临的核心挑战。近年来,抗体药物偶联物(ADC)作为融合单克隆抗体靶向性与细胞毒性药物杀伤性的“生物导弹”,凭借其独特优势在肺癌治疗中崭露头角,已成为临床关注的焦点。本系列文章将从基础到临床逐步深入,系统解析ADC药物的核心知识——后续将陆续聚焦连接子优化、载荷种类迭代、不良反应管理、耐药机制破解等关键内容。本篇文章作为开篇,我们先从ADC的核心结构与作用机制切入,带大家夯实基础认知,为后续临床应用与方案选择筑牢理论根基。
一、 ADC药物:不只是“抗体+药物”的简单叠加
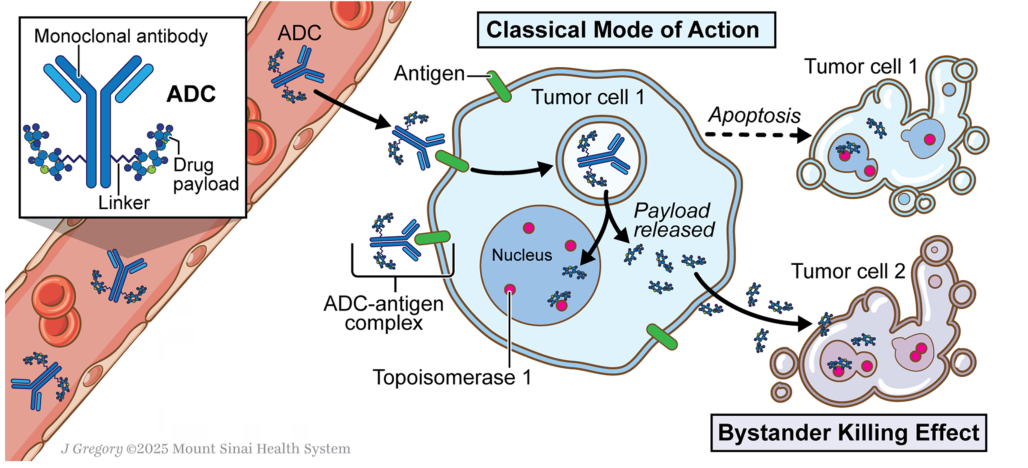
抗体偶联药物(Antibody–drug conjugates,ADC)诞生源于“魔法子弹”的治疗理念——既想让细胞毒性药物精准命中肿瘤细胞,又要避免其对正常组织造成损伤。这种精准性的实现,依赖于三大核心组件的协同作用:单克隆抗体(Antibody)、连接子(Linker)和细胞毒性载荷(Payload)。三者的优化组合决定了ADC的靶向精度、稳定性和杀伤效率,如同精密武器的“制导系统”、“引爆装置”和“弹头”,缺一不可。
1. 单克隆抗体:精准导航的“制导系统”
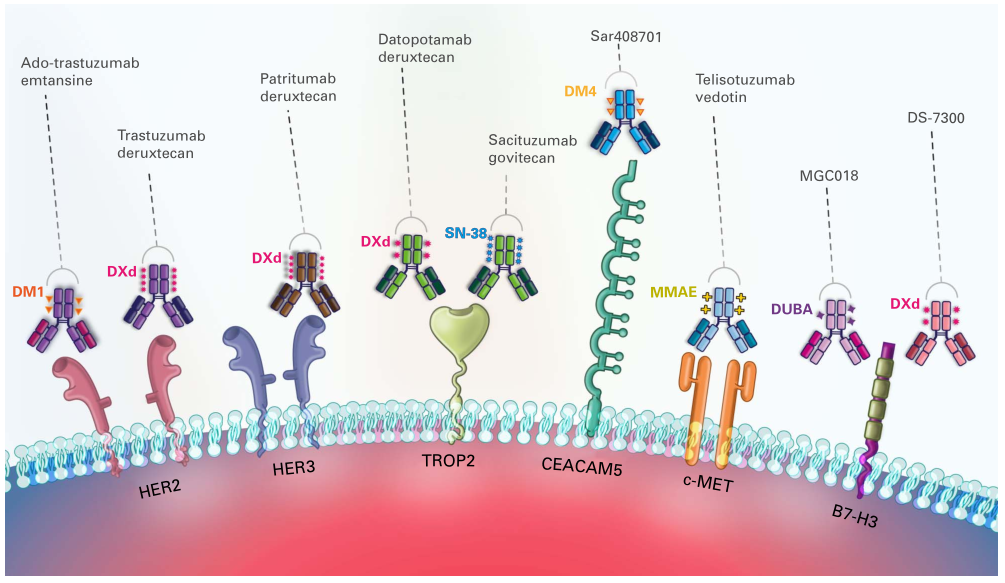
单克隆抗体是ADC的“眼睛”,其核心功能是特异性识别并结合肿瘤细胞表面过表达的抗原,为后续药物递送提供精准定位。在非小细胞肺癌(NSCLC)治疗中,ADC药物的抗体部分主要靶向HER2、TROP2、HER3、c-MET、CEACAM5等肿瘤相关抗原——这些抗原在肺癌细胞表面异常高表达,而在正常组织中表达量极低,这是ADC实现“靶向杀伤”的基础[2]。
理想的ADC抗体需满足三大特性:一是高亲和力,能牢固结合肿瘤抗原,避免在血液循环中脱落;二是长半衰期,IgG1型抗体是临床首选,其在体内的半衰期可达10-21天,能持续发挥靶向作用[4, 5];三是高效内化能力,结合抗原后能快速介导ADC-抗原复合物进入肿瘤细胞内,为载荷释放创造条件。值得注意的是,部分ADC抗体还能通过Fc段激活免疫细胞的抗体依赖的细胞毒性(ADCC)和补体依赖的细胞毒性(CDC)效应,进一步增强抗肿瘤免疫反应。
2. 连接子:稳定可控的“引爆装置”
连接子是连接抗体与载荷的关键桥梁,其核心要求是“循环中稳定,肿瘤内释放”——既要在血液循环中牢牢锁住载荷,避免提前释放导致全身性毒性,又要在ADC进入肿瘤细胞后高效断裂,让载荷发挥杀伤作用。根据断裂机制,连接子主要分为可切割型和不可切割型两类,各有其适用场景。
可切割型连接子是目前NSCLC ADC药物的主流选择,如德曲妥珠单抗(Trastuzumab deruxtecan,T-DXd)采用的四肽连接子、戈沙妥珠单抗(Sacituzumab govitecan)采用的CL2A连接子。这类连接子能利用肿瘤细胞内与正常组织的环境差异实现精准断裂:酸性敏感型连接子在溶酶体酸性环境(pH 4.5-5.0)中水解;蛋白酶敏感型连接子被肿瘤细胞内高表达的组织蛋白酶B等裂解;二硫键连接子则在细胞内高浓度谷胱甘肽作用下断裂。
不可切割型连接子如T-DM1采用的硫醚连接子,需依赖肿瘤细胞内溶酶体对抗体的降解作用,才能释放载荷。这类连接子的优势是血液循环稳定性极高,能最大程度降低脱靶毒性,但杀伤效率依赖抗体的内化和降解效率,应用范围相对较窄。
此外,连接子的设计还需兼顾“空间位阻最小化”和“药物抗体比率(DAR)均一性”。DAR指每个抗体分子连接的载荷数量,理想范围为2-8——DAR过低会导致杀伤不足,过高则可能增加ADC聚集风险和肾脏清除速率,影响药物稳定性。新一代ADC通过定点偶联技术,已能实现DAR的精准控制,如德曲妥珠单抗的DAR约为8,戈沙妥珠单抗的DAR约为7.6,T-DM1的DAR约为3.1,既保证了杀伤强度,又维持了良好的药代动力学特性[3, 6]。
3. 细胞毒性载荷:高效杀伤的“核弹头”
载荷是ADC的“杀伤核心”,通常是毒性极强的化疗药物或新型细胞毒性分子,其效力需达到“亚纳摩尔级”——即极低浓度下就能诱导肿瘤细胞凋亡。在NSCLC相关ADC中,载荷主要分为两大类:
一类是拓扑异构酶I抑制剂,如DXd(Deruxtecan衍生物)和SN-38(伊立替康活性代谢产物)。这类药物通过抑制拓扑异构酶I活性,阻止DNA复制和修复,最终导致肿瘤细胞死亡。DXd作为T-DXd、Datopotamab deruxtecan(Dato-DXd)等ADC的载荷,具有膜通透性强的特点,能产生“旁观者效应”——即从肿瘤细胞释放后,扩散至周围未表达靶抗原的肿瘤细胞,扩大杀伤范围,对异质性强的肿瘤尤为有效。
另一类是微管抑制剂,如DM1、DM4和MMAE(单甲基奥瑞他汀E)。这类药物通过抑制微管聚合或稳定微管结构,阻断细胞分裂进程,诱导肿瘤细胞凋亡。例如,Telisotuzumab vedotin(Teliso-V)采用的MMAE,能高效抑制微管形成,在c-MET阳性NSCLC治疗中展现出显著活性[3]。
除了传统细胞毒性药物,新型载荷如放射性同位素、免疫刺激分子等也在研发中,未来有望进一步拓展ADC的治疗边界。
二、ADC药物的作用机制:五步实现精准抗癌
ADC药物的抗癌过程如同一场精密的“军事行动”,从识别目标到最终杀伤,需经历五个关键步骤,每个环节都依赖三大组件的协同配合:
1. 靶向结合:导弹锁定目标
ADC药物进入血液循环后,其单克隆抗体部分会特异性识别并结合肿瘤细胞表面的靶抗原(如HER2、TROP2)。这一过程如同导弹锁定目标,确保ADC药物能在众多正常细胞中精准定位肿瘤细胞,为后续递送奠定基础。由于抗体与抗原的结合具有高度特异性,ADC能最大程度减少对正常组织的识别和结合。
2. 内化进入:导弹侵入细胞
ADC与肿瘤抗原结合后,会通过受体介导的内吞作用,被肿瘤细胞摄入形成内体(Endosome)。这一步是ADC发挥作用的关键前提——只有成功进入肿瘤细胞,载荷才能在细胞内环境中被释放,避免在血液循环中提前起效造成脱靶毒性。抗体的内化效率直接影响ADC的杀伤效果,因此高内化能力是ADC抗体筛选的重要标准[3]。
3. 载荷释放:引爆杀伤弹头
内体与肿瘤细胞内的溶酶体融合后,溶酶体中的酸性环境、蛋白酶等会触发连接子断裂——可切割型连接子直接水解或被酶解,不可切割型连接子则随抗体降解而释放载荷。这一过程如同导弹在目标内部引爆弹头,确保细胞毒性载荷在肿瘤细胞内精准释放,避免对周围正常细胞造成损伤。
4. 肿瘤杀伤:弹头发挥威力
释放后的细胞毒性载荷会通过自身作用机制攻击肿瘤细胞:拓扑异构酶I抑制剂破坏DNA复制,微管抑制剂阻断细胞分裂,最终诱导肿瘤细胞凋亡。由于载荷的毒性极强,即使每个肿瘤细胞内进入少量ADC,也能实现高效杀伤。
5. 旁观者效应:扩大抗癌范围
对于采用膜通透性载荷的ADC(如DXd类ADC),释放后的载荷会穿过肿瘤细胞膜,扩散至周围未表达靶抗原的肿瘤细胞,发挥“旁观者杀伤”作用。这一效应能有效应对肿瘤异质性问题——即使部分肿瘤细胞未表达靶抗原,也能被载荷杀伤,从而提升整体治疗效果。在NSCLC这类异质性较强的肿瘤中,旁观者效应是ADC药物优于传统靶向治疗的重要优势之一[3]。
三、总结:ADC药物的核心优势与发展基础
作为精准抗肿瘤代表性药物,ADC的核心优势在于“精准性”与“强效性”的统一——通过抗体的靶向制导,解决了传统化疗的“敌我不分”问题;通过强效载荷的杀伤作用,突破了部分靶向药物的疗效瓶颈;通过连接子的稳定控制,平衡了疗效与安全性。这些优势使其在NSCLC治疗中展现出广阔前景,尤其是在HER2突变、TROP2高表达等亚型中,已取得突破性进展。
截至目前,仅有德曲妥珠单抗(T-DXd)、瑞康曲妥珠单抗(Trastuzumab Rezetecan)获批用于HER2突变NSCLC治疗,但已有多款ADC药物进入临床试验阶段,针对TROP2、HER3、c-MET等靶点的研究正在如火如荼地进行。这些药物的研发与应用,都离不开对ADC核心结构与作用机制的深刻理解——只有优化抗体的靶向性、连接子的稳定性和载荷的杀伤性,才能开发出更高效、更安全的ADC药物。
ADC药物的出现,为肺癌治疗打开了新的大门。从结构设计到作用机制,每一个环节的创新都在推动精准治疗的进步。随着研究的不断深入,相信未来会有更多ADC药物问世,为肺癌患者带来新的治疗希望。
1. Syal A, Meyer ML, Angelino K, Osei N, Gomez JE, Sen T, Hirsch FR: Antibody drugs conjugates in non-small cell lung cancer: current status and challenges. The oncologist 2025, 30(11).
2. Chen X, Zeng C: Pioneering the Way: The Revolutionary Potential of Antibody–Drug Conjugates in NSCLC. Current Treatment Options in Oncology 2024, 25(4):556-584.
3. Passaro A, Jänne PA, Peters S: Antibody-Drug Conjugates in Lung Cancer: Recent Advances and Implementing Strategies. Journal of Clinical Oncology 2023, 41(21):3747-3761.
4. Talbot PJ, Buchmeier MJ: Catabolism of homologous murine monoclonal hybridoma IgG antibodies in mice. Immunology 1987, 60(4):485-489.
5. Morell A, Terry WD, Waldmann TA: Metabolic properties of IgG subclasses in man. J Clin Invest 1970, 49(4):673-680.
6. Zanchetta C, De Marchi L, Macerelli M, Pelizzari G, Costa J, Aprile G, Cortiula F: Antibody–Drug Conjugates in Non-Small Cell Lung Cancer: State of the Art and Future Perspectives. International Journal of Molecular Sciences 2024, 26(1).
排版编辑:肿瘤资讯-HYF











 苏公网安备32059002004080号
苏公网安备32059002004080号


