

2026年1月9日·上海

樊嘉 院士
樊嘉,复旦大学附属中山医院肝胆肿瘤与 肝移植外科 复旦大学肝癌研究所,上海
肝细胞癌(以下简称肝癌)术后5年复发率可高达70%,这与术前已经存在微小播散灶或多中心发生有关 [1] 。肿瘤复发转移是影响肝癌患者术后长期生存的主要原因,但是目前尚无公认的有效预防肝癌复发转移的术后辅助治疗方案。1项针对全国多家医学中心肝胆外科医师开展的《肝癌术后辅助治疗现状调研》项目提示:87.7%和85.5%的医师分别将肝癌指南和专家共识作为权威的临床治疗标准,以获取术后辅助治疗相关知识,且81.8%的医师建议在肝癌指南和专家共识中补充最新循证研究结果,35.0%的医师建议完善和统一临床诊疗路径 [2] 。因此,国内相关领域研究者成立了肝癌术后辅助治疗中国专家共识协作组,并联合中国医师协会外科医师分会、中国抗癌协会肝癌专业委员会、中华医学会肿瘤学分会肝癌学组在国家卫生健康委员会医政医管局发布的《原发性肝癌诊疗指南(2024年版)》 [3] 基础上,结合国内外专家经验及《肝癌术后辅助治疗现状调研》的项目成果,经过多次讨论、反复修订,最终更新形成《肝细胞癌术后辅助治疗专家共识(2026版)》(以下简称本共识),旨在为临床医师开展术后辅助治疗提供重要参考。
本共识中,循证医学证据等级参照证据评价与推荐意见分级、制定和评价(grading of recommendations,assessment,development and evaluation, GRADE)的指导原则 [4] 和《牛津循证医学中心(2011版)》,专家推荐强度参照GRADE对推荐意见分级的指导原则。本共识采用电子投票方式计算共识度。表决意见分为5级:A级为完全同意;B级为同意,但有小修改意见;C级为同意,但有较大修改意见;D级为中立;E级为不同意。共识度%=(A+B)专家数/所有专家数×100%。若共识度≥80%,则视为达成共识并通过;若共识度<80%,则在讨论会现场征询意见,会后执笔专家根据讨论结果形成新陈述,并以函询的方式再次进行投票并计算共识度。本共识最终经96名专家组成员共同参与讨论并逐条对相关陈述进行讨论和投票,形成16条推荐意见。
一、术后辅助治疗的概述
术后辅助治疗是指肿瘤患者行根治性治疗后预防肿瘤复发的措施,其主要目的是降低肿瘤复发和(或)转移,以及延长患者的总生存时间(overall survival,OS) [5] 。肝癌根治性治疗手段包括肝切除、肝移植、消融治疗等,其中肝切除最常用。因此,本共识主要针对肝癌根治性切除术后患者的辅助治疗 [3,6-7] 。根治性切除判断标准参考《原发性肝癌诊疗指南(2024年版)》 [3] 。术后复发包括早期复发和晚期复发,通常认为术后≤2年复发属于早期复发,>2年复发为晚期复发 [8‑9] 。早期复发一般认为是原发病灶在肝内或远处器官形成转移灶所致,微(小)转移灶或为术前就已存在,或因手术操作所致的医源性播散,术后残存病灶逐渐生长,与已经切除的原发灶常具有同源性。晚期复发可能是因基础肝脏疾病,形成“异时性”的新发肿瘤。早期复发的危险因素包括肿瘤多发、肿瘤最大径>5cm、肿瘤分化差(Edmondson Ⅲ~Ⅳ级)、微血管或大血管侵犯、淋巴结转移、切缘≤1cm、肿瘤标志物[AFP和(或)异常凝血酶原[脱‑γ‑羧基凝血酶原(des‑γ‑carboxy prothrombin,DCP),也称为维生素K缺乏或拮抗剂‑Ⅱ诱导产生的蛋白质]持续异常等;晚期复发的危险因素包括年龄>60岁、慢性病毒性肝炎活动期、HBV DNA>10 6 拷贝/mL、HBsAg阳性、肝硬化程度、Ishak评分>6分或Scheuer>4分、低白蛋白血症、多发肿瘤等 [9‑17] 。对于术后存在肿瘤早期复发危险因素的患者,术后应根据情况酌情接受辅助治疗。
推荐意见1:肝癌术后辅助治疗是指肝癌根治性治疗后为预防肿瘤复发而采取的治疗措施,以延长患者无瘤生存时间。(证据等级1,推荐意见A级)
推荐意见2:肝癌根治性切除术后复发包括早期复发和晚期复发,术后≤2年复发属于早期复发,>2年复发为晚期复发。肿瘤破裂、肿瘤多发、肿瘤最大径>5cm、Edmondson Ⅲ~Ⅳ级、微血管或大血管侵犯、淋巴结转移、术后AFP和(或)DCP持续异常等与早期复发有关;慢性病毒性肝炎活动期、HBsAg阳性、肝硬化程度等与晚期复发相关。(证据等级1,推荐意见A级)
二、术后辅助治疗的适用人群、启用时机、持续时间和随访评估
对于存在早期复发危险因素的肝癌患者,肿瘤复发常在术后≤2年发生 [11,15] 。因此,肝癌术后1~2个月即开始随访,复查肝肾功能、肿瘤标志物[如AFP和(或)DCP]、影像学(超声与增强CT或MRI检查),有条件的医学中心也可选择微小核糖核酸7(microRNA7)、循环肿瘤细胞(circulating tumor cell,CTC)、循环肿瘤DNA(circulating tumor DNA,ctDNA)监测。如存在复发危险因素的中高危患者,评估后应考虑接受术后辅助治疗或参加相关临床研究。对于复发风险为低危(通常指不合并复发危险因素,如单个肿瘤长径≤5cm且无微血管侵犯 [18] )的肝癌患者,可采取常规随访评估策略,每3个月定期随访肝功能和肾功能、肿瘤标志物[如AFP和(或)DCP]和影像学检查(超声与增强CT或MRI),有条件的医学中心也可选择行microRNA7、CTC、ctDNA监测。
此外,为了做好肝癌的三级预防,尽可能改善患者预后,本共识建议综合考虑早期和晚期术后复发的危险因素而选择适合辅助治疗的患者,具体包括:肿瘤破裂、肿瘤多发、肿瘤最大径>5cm、Edmondson Ⅲ~Ⅳ级、微血管或大血管侵犯、淋巴结转移、切缘≤1cm、肿瘤标志物[AFP和(或)DCP等]持续异常、HBsAg阳性、HBV DNA>10 6 拷贝/mL、肝硬化等。以上危险因素均显著提高肝癌早期或晚期复发率,缩短患者的OS [10‑17] 。
术后辅助治疗包括针对肝病背景的治疗,如乙型病毒性肝炎(以下简称乙肝)和丙型病毒性肝炎(以下简称丙肝)的治疗和针对中高危复发因素的治疗,如介入、靶向、免疫治疗等。针对有乙肝背景的肝癌患者,术后需要继续进行抗HBV治疗,针对丙肝活动期患者需要进行规范治疗 [19-20] 。针对具有中高危复发因素患者的治疗,疗程因治疗手段不同而异,系统性抗肿瘤治疗通常治疗时间为6~12个月。辅助治疗期间,≤3个月复查1次肝肾功能、肿瘤标志物[如AFP和(或)DCP]等实验室检查和影像学检查(超声与增强CT或MRI) [19‑21] 。若超声检查发现疑似病灶或血清AFP和(或)DCP升高,则进一步行肝脏增强CT或增强MRI检查(建议≤3个月复查1次增强CT或MRI)。同时,酌情行肺部CT平扫、骨骼放射性核素CT、头颅MRI或CT、全身PET/CT扫描检查,以明确是否存在肝外转移。见图1。
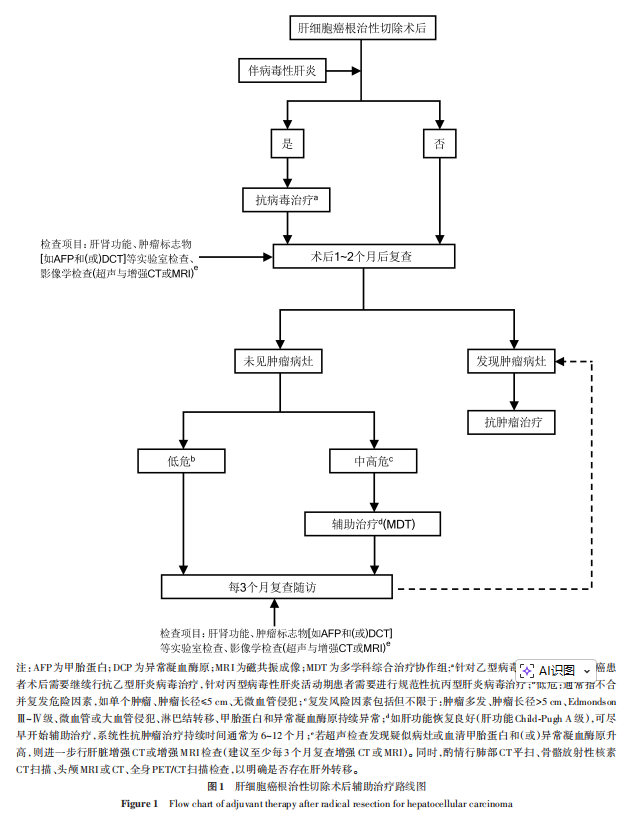
推荐意见3:针对肝癌术后复发中高危人群,建议进行术后辅助治疗,如患者合并肿瘤破裂、肿瘤多发、肿瘤最大径>5cm、Edmondson Ⅲ~Ⅳ级、微血管或大血管侵犯、淋巴结转移、AFP和(或)DCP持续异常等≥1项复发危险因素,且肝功能恢复良好,建议根据患者实际情况尽早启用合适的术后辅助治疗。(证据等级1,推荐意见A级)
推荐意见4:针对有乙肝背景的肝癌患者,术后需要继续行抗病毒治疗,针对丙肝活动期患者需要进行规范性治疗(证据等级1,推荐意见A级)。针对存在中高危复发因素患者,系统性抗肿瘤治疗疗程通常为6~12个月。治疗期间建议至少每3个月随访肝肾功能、肿瘤标志物等实验室指标,以及超声与增强CT或MRI等影像学检查。酌情行肺部CT平扫、骨骼放射性核素CT扫描、头颅MRI或CT、全身PET/CT扫描检查,以明确是否存在肝外转移。(证据等级2,推荐意见A级)
三、根治性切除术后辅助治疗方式
肝癌术后辅助治疗旨在预防肿瘤复发和转移,以实现长期无瘤生存和治愈。所有肝癌患者术后都必须进行针对肝病背景的长期治疗,这是预防复发和转移的基础。在此基础上,可根据全面评估,选择系统治疗和(或)局部治疗,或参加临床研究,以进一步降低肝癌术后肿瘤复发转移概率,改善患者预后。对于术后辅助治疗方式的选择,目前尚无统一推荐意见。在临床实践中对伴有中高危复发因素的肝癌术后患者,可根据具体情况选择预防肿瘤复发转移的治疗策略。《肝癌术后辅助治疗现状调研报告》显示:医师最常选择靶向单药作为术后主要辅助治疗方式,其次是TACE和联合治疗,靶向药物联合免疫治疗是临床最常用的联合治疗方式 [2] 。随着信迪利单克隆抗体(以下简称单抗)术后辅助治疗RCT Ⅱ期研究结果的发布,免疫检查点抑制剂单药也逐渐成为医师常选择的术后辅助治疗方式之一。对于接受过新辅助或术前转化治疗的患者,接受R 0 切除术后辅助治疗的循证医学证据较少,可参考《原发性肝癌转化及围手术期治疗中国专家共识(2024版)》 [22] 开展术后辅助治疗。本共识基于已发表的临床研究数据,主要针对未接受过新辅助或术前转化的肝癌患者提出术后辅助治疗建议。
(一)系统抗肿瘤治疗
在肝癌术后辅助系统抗肿瘤治疗方面,靶向药物、免疫治疗、免疫调节剂单独或联合应用的策略正在积极探索中。
1.靶向药物和免疫检查点抑制剂
部分回顾性研究结果显示:对于合并高危复发因素的肝癌患者,根治性切除术后辅助索拉非尼治疗,有助于降低术后肿瘤复发转移率 [23‑25] 。但1项前瞻性Ⅲ期RCT(STORM研究)结果显示:索拉非尼辅助治疗未能延长接受根治性切除或消融治疗肝癌患者的无复发生存时间(recurrence‑free survival,RFS)和OS [26] 。根据目前常用的肝癌高危复发因素标准,STORM研究入组患者以不合并高危复发因素的早期肝癌患者为主。这可能是该研究未取得阳性结果的原因之一。同时上述相关研究结果显示:与早期肝癌患者比较,合并高危复发因素的肝癌患者,获益于术后系统抗肿瘤治疗的概率可能更高。
近年来,继索拉非尼之后越来越多的靶向药物,如仑伐替尼、多纳非尼、阿帕替尼正在被探索用于肝癌术后辅助治疗。1项Ⅱ期临床研究结果显示:阿帕替尼用于伴门静脉癌栓的肝癌根治性切除术后辅助治疗,中位RFS为7.6个月,1年无复发生存率为36.1% [27] 。中国肝癌分期(China liver cancer staging,CNLC)Ⅱb期和(或)Ⅲa期肝癌患者在根治性切除术后行仑伐替尼辅助治疗,1年无复发生存率为60.4%,中位RFS为16.1个月,1年总生存率为93.6%,中位OS尚未达到 [28] 。多中心真实世界研究结果显示:合并高危复发因素肝癌患者术后行多纳非尼辅助治疗,1年和2年无复发生存率均显著高于术后仅主动监测的对照组( P =0.004),1年和2年总生存率也均显著高于对照组( P =0.043),2年总生存率的差值达17.7% [29-30] 。此外,靶向药物联合局部治疗的多项研究正在进行中。1项前瞻性队列研究结果显示:术后辅助治疗行仑伐替尼联合TACE治疗合并高危复发因素肝癌患者,中位无病生存时间(disease‑free survival,DFS)为17个月,而对照组TACE治疗的患者中位DFS为9个月( HR =0.6,95% CI 为0.4~1.0, P =0.022 8) [31] 。近期1项前瞻性、单臂、Ⅱ期临床研究结果显示:单个肿瘤长径>5cm且伴微血管侵犯、伴或不伴卫星灶的肝癌患者,根治性切除术后辅助治疗行多纳非尼联合替雷利珠单抗和TACE,术后1年无复发生存率为89.6%,1年总生存率为96.7%,中位RFS和中位OS尚未达到 [32] 。
目前,免疫检查点抑制剂单药或联合靶向药物用于肝癌术后辅助治疗的多项相关研究也正在开展中。1项前瞻性、多中心、Ⅱ期临床研究结果显示:伴中高危复发因素的肝癌患者在根治性切除或消融治疗后接受纳武利尤单抗治疗,1年无复发生存率为78.6%,中位RFS为26.3个月 [33] 。另1项RCT Ⅱ期临床研究结果显示:信迪利单抗用于合并微血管侵犯的肝癌根治性切除术后辅助治疗,与主动监测比较,RFS显著延长,中位RFS为27.7个月比15.5个月( HR =0.534,95% CI 为0.360~0.792, P =0.002) [34] 。伴高危复发因素的BCLC A~B期(相当于CNLC Ⅰ~Ⅱ期)肝癌患者根治性切除术后接受多纳非尼联合特瑞普利单抗辅助治疗,1年无复发生存率为81.6%,中位RFS未达到,在辅助治疗期间,生命质量较基线有轻度提高 [35] 。1项回顾性队列研究结果显示:多纳非尼联合免疫检查点抑制剂作为术后辅助治疗与主动监测比较,前者可显著改善患者的RFS [36] 。卡瑞利珠单抗联合阿帕替尼术后辅助治疗CNLC Ⅱ期和(或)Ⅲ期肝癌患者,中位RFS为11.7个月,1年无复发生存率为48.9% [37] 。1项国际多中心Ⅲ期临床研究(IMbrave 050)评估阿替利珠单抗联合贝伐珠单抗用于合并高危复发因素的早期肝癌术后辅助治疗。虽然该研究达到了预设中期分析中的主要研究终点 [38] 。但最新结果显示:早期RFS获益未能持续;亚组分析中对于超出“up‑to‑7”标准的肝癌患者,阿替利珠单抗联合贝伐珠单抗治疗组的中位RFS优于主动监测组(16.9个月比13.7个月, HR =0.84) [39] 。这提示该特定亚群可能从靶向联合免疫辅助治疗中获益。此外,还有几项正在进行的Ⅲ期研究:特瑞普利单抗(JUPITER‑04)、度伐利尤单抗联合贝伐珠单抗(EMERALD‑2)用于合并高危复发因素的肝癌根治性切除术后辅助治疗。
综上,与早期肝癌患者比较,合并高危复发因素的肝癌患者获益于术后系统抗肿瘤治疗的概率可能更高。靶向药物、免疫检查点抑制剂单药或联合应用,有望改善伴有高危复发因素肝癌患者的预后,但仍需持续开展更高级别循证医学证据的临床研究进一步探索和证实。此外,多项关于预测肝癌术后复发风险、辅助治疗效果的指标筛选及敏感人群选择的相关研究也正在逐步开展。
《肝癌术后辅助治疗现状调研报告》显示:系统治疗药物的不良反应是影响患者辅助治疗依从性的重要因素 [2] 。为最大限度保障治疗安全性,需要完善患者用药前的基线评估,加强用药后药物不良反应的监测、预防、治疗及随访。肝癌术后辅助治疗药物主要包括免疫检查点抑制剂、酪氨酸激酶抑制剂和VEGF单抗(贝伐珠单抗或其生物类似物)等。
(1)免疫检查点抑制剂的常见不良反应包括皮肤毒性、内分泌毒性、肝脏毒性、肺毒性、胃肠毒性、骨关节与肌毒性等,少见不良反应包括神经毒性、血液毒性、肾脏毒性、心脏毒性、眼毒性等 [40] 。免疫性肝炎最常出现在首次用药后8~12周,肝癌患者发生率高于其他瘤种 [41] 。PD‑1、PD‑L1抑制剂所致免疫性肝炎死亡人数仅次于免疫性肺炎 [42] 。免疫性肝炎分为肝细胞型、胆管炎型和混合型3种类型,其中肝细胞型约占50%,对类固醇治疗较敏感,预后较好;而胆管炎型和混合型对类固醇治疗不敏感,预后相对较差 [40] 。免疫性心肌炎属于少见免疫相关不良反应,发生率为1.05%~1.14% [43‑44] ,81.2%于用药1~2次后发生 [44] ,病死率较高为39.7%~50% [42,45‑46] ,居所有免疫相关不良反应之首。确诊后应立即停用免疫检查点抑制剂,及时启用大剂量甲泼尼龙治疗 [47] 。采用主动监测策略,及时诊断和治疗无症状性免疫性心肌炎 [40] ,患者病死率可明显降低。
(2)酪氨酸激酶抑制剂单药治疗肝癌的常见不良反应 [48‑50] 包括手足皮肤反应、高血压、腹泻、蛋白尿、肝功能异常、PLT减少、食欲不振、乏力、皮疹、甲状腺功能减退等。酪氨酸激酶抑制剂与免疫检查点抑制剂联合使用时部分不良反应发生率可能上升,如皮肤毒性、腹泻、肝毒性、乏力、甲状腺功能减退 [51‑52] 等。
(3)PD‑1和(或)PD‑L1抑制剂联合VEGF单抗(贝伐珠单抗或其生物类似物)常见不良反应 [53‑54] 包括高血压、AST升高、蛋白尿、乏力等,使用VEGF单抗时需警惕出血、穿孔及血栓栓塞等事件发生。肝功能保护对于肝癌患者至关重要,制订术后辅助治疗方案时优先选用对肝功能影响小的药物。出现肝毒性时需鉴别免疫药物抑或靶向药物所致,并及时采取相应措施。合并肝硬化门静脉高压症患者,用药前后应定期评估消化道出血风险,密切监测血常规、凝血功能等。
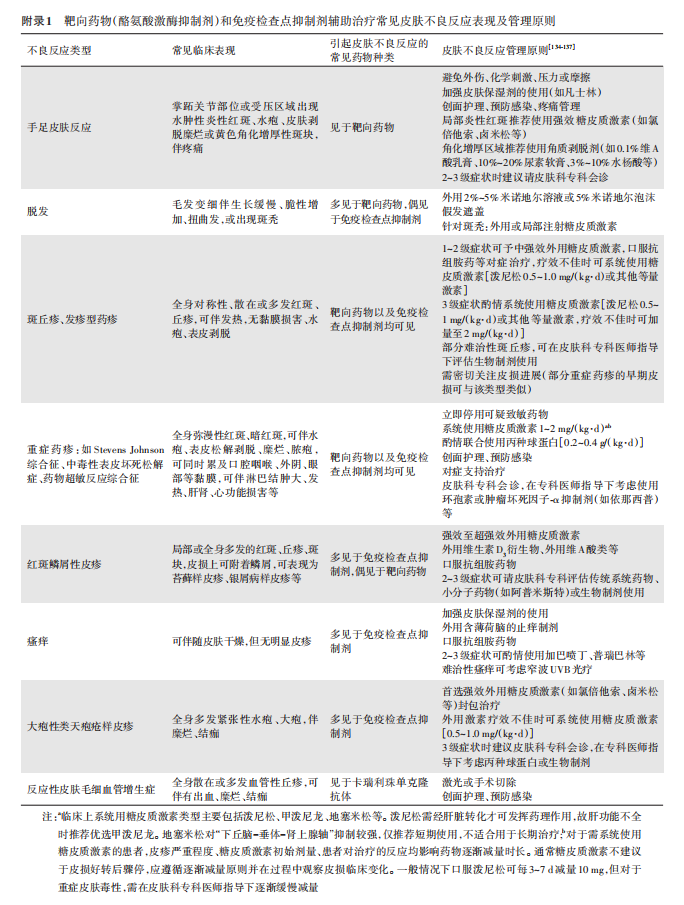
在启动系统抗肿瘤治疗前,建议对患者开展临床检查并评估基线情况(表1)。治疗期间,建议定期监测不良反应(表2)。建议根据《美国国家癌症研究所不良事件常用术语标准5.0版》 [55] 及《中国临床肿瘤学会(CSCO)免疫检查点抑制剂相关的毒性管理指南2023》的诊断与治疗原则 [40] ,对不良反应进行及时诊断并分级治疗,酌情调整抗肿瘤药物剂量用法、暂停或终止治疗。当明确诊断为免疫相关不良反应时,及时启用足量、足疗程的糖皮质激素治疗。并根据不良反应的严重程度及对激素治疗的敏感性酌情联合其他药物如吗替麦考酚酯、丙种免疫球蛋白、英夫利昔单抗、抗胸腺细胞免疫球蛋白等治疗,危重患者可采取血浆置换、循环支持、呼吸支持等措施。皮肤不良反应常见且容易反复发作,具体类型、临床表现、致毒药物及处理原则见附录。建议有条件的医学中心组建系统治疗相关不良反应多学科诊断与治疗团队,以规范预防和管理相关不良反应,加强患者和家属对抗肿瘤药物不良反应的健康宣教工作,以便早期识别和及时处理。


推荐意见5:在肝癌术后靶向药物和免疫检查点抑制剂辅助治疗方面,现有的研究证据显示:靶向药物、免疫检查点抑制剂单药或联合应用,有望改善合并高危复发因素肝癌患者的预后,但仍需持续开展更多高级别循证医学证据的临床研究进一步探索和证实。(证据等级3,推荐意见B级)
推荐意见6:系统治疗药物的不良反应是影响患者辅助治疗依从性的重要因素。需要全面了解靶向药物、免疫检查点抑制剂的常见不良反应,警惕部分可能引起致死性的不良反应,靶向药物与免疫药物联合使用时部分不良反应发生率可能上升。(证据等级2,推荐意见A级)
2.现代中药制剂
Chen等 [56] 在国内39家医学中心开展的1项RCT结果显示:对于BCLC分期为A~B期肝癌患者,在根治性切除术后服用槐耳颗粒,可显著延长RFS,并显著降低肝外转移发生率。Zhai等 [57] 在国内开展的1项多中心RCT结果显示:华蟾素联合解毒颗粒能预防小肝癌患者术后复发、延长OS。目前关于中药制剂的分子作用机制仍有待进一步探索。
推荐意见7:肝癌根治性手术后使用槐耳颗粒等现代中药制剂有助于抑制肝癌复发,延长患者生存时间。(证据等级1,推荐意见A级)
3.免疫调节剂
α‑干扰素是一种较强的免疫调节剂,兼具抗病毒和抗肿瘤的作用。Lo等 [58] 的单中心RCT结果显示:HBV相关肝癌患者术后使用α‑干扰素有助于改善OS,尤其是在TNM分期为Ⅲ期和Ⅳa期的肝癌患者中。Sun等 [59] 进行的1项包括236例HBV相关肝癌患者的RCT结果显示:术后使用α‑干扰素组的中位OS显著长于未使用α‑干扰素组(63.8个月比38.8个月, P =0.000 3),但两组患者中位DFS比较,差异无统计学意义。针对HCV相关肝癌患者,Nishiguchi等 [60] 的RCT结果显示:术后使用α‑干扰素组的总生存率显著高于对照组。1项包括1356例患者的Meta分析结果显示:对于病毒性肝炎相关肝癌患者,根治术后辅助使用聚乙二醇化干扰素,可以显著提高总生存率及无复发生存率,且无严重不良反应 [61] 。但Mazzaferro等 [62] 的RCT结果显示:α‑干扰素并不影响肝癌术后总复发率,仅可能降低HCV相关肝癌患者术后远期(>2年)复发率。因此,α‑干扰素在肝癌术后辅助治疗的效果仍需进一步多中心、大样本、RCT证实。虽然干扰素术后辅助治疗可能有效,但其与多种不良反应有关,常见不良反应包括:疲劳、寒战、发热、头痛、肌肉痛、WBC和PLT减少 [63] 。
胸腺法新是一种由28个氨基酸组成的多肽,有回顾性研究结果显示 [64‑65] :胸腺法新作为肝切除术后的辅助治疗可改善小肝癌患者及孤立性HBV相关肝癌患者的预后,但其疗效仍有待进一步验证。
推荐意见8:病毒性肝炎相关肝癌患者行根治性手术后使用α‑干扰素有助于抑制肝癌复发、延长患者生存时间。(证据等级1,推荐意见B级)
(二)局部治疗
1.TACE
对于肝癌术后辅助性TACE治疗的有效性,目前尚缺乏国际多中心RCT证据 [66] 。1995年,我国学者随机研究结果显示:肝癌切除术后3~4周辅助性TACE治疗,可明显降低肝内复发率( P <0.01),并提高单纯手术切除患者的生存率( P <0.01) [67] 。随后2项单中心RCT结果显示:对于单发肿瘤合并微血管侵犯、多发或单个大肝癌患者,术后辅助性TACE治疗具有降低复发率、延长术后生存时间的效果 [18,68] 。2项多中心回顾性队列研究结果显示:术后辅助性TACE能够提高合并微血管侵犯肝癌患者的生存率 [69-70] 。1项纳入10项RCT的Meta分析结果显示:肝切除术后辅助性TACE可显著降低术后复发率,延长患者生存时间 [71] 。国内多中心RCT结果显示:与术后辅助索拉非尼单药治疗比较,术后辅助性TACE联合索拉非尼治疗可显著延长肝癌伴门静脉癌栓患者术后RFS和OS [72] 。但近期1项在2家医学中心进行的RCT结果显示:对AJCC TNM分期Ⅰ期或Ⅱ期肝癌患者,术后辅助TACE治疗相较于观察组未能延长RFS,且未显示出生存获益 [73] 。因此,目前TACE治疗被我国肝癌相关指南推荐为肝癌切除术后具有高危复发因素患者术后辅助治疗常用的局部治疗手段 [3,74] 。
参考现有RCT证据,对于合并高危复发因素的肝癌患者,通常建议术后行1~2个疗程辅助性TACE治疗 [3,18,68,74] 。辅助性TACE治疗的主要目的是发现并及时治疗残留或新发病灶。第1次辅助性TACE治疗常在肝癌切除术后约1个月施行。治疗前可行腹腔动脉、肝左动脉和肝右动脉造影检查,采集动脉期、实质期及静脉期图像,必要时对外科切除区域可能涉及的肝外侧支(如右膈下动脉、胃左动脉等)也行造影检查,以便尽早发现病灶。锥形束CT和血管造影CT检查能显示CT、MRI和常规DSA检查难以发现的小肝癌,提高其检出率 [75‑76] 。因此,对怀疑有残留或新发病灶患者可行双期锥形束CT和血管造影CT检查。术中若发现明确病灶,即给予治疗性TACE;如未见明确小病灶,则行预防性TACE——先灌注化疗,再酌情注入2~5mL碘化油完成栓塞。TACE治疗后4~6周复查血液学指标和增强CT或MRI。若无复发灶,由医师根据患者情况评估是否进行第2次TACE治疗 [3,74] 。
近年来,TACE联合系统抗肿瘤治疗作为术后辅助方案的探索不断深入。对于伴有高危复发因素的肝癌患者,TACE联合仑伐替尼作为术后辅助治疗,其中位DFS可达17个月,而行TACE治疗的对照组中位DFS为9个月( HR =0.6,95% CI 为0.4~1.0, P =0.0228) [31] 。此外,TACE联合多纳非尼用于伴高危复发因素肝癌患者术后辅助治疗,1年无复发生存率为81.8%,1年总生存率为97.7%,2年总生存率为88.6% [77] 。单个大肿瘤且伴微血管侵犯的肝癌患者根治性切除术后辅助TACE联合多纳非尼和替雷利珠单抗治疗,1年无复发生存率为89.6%,1年总生存率为96.7%,中位RFS和中位OS均未达到 [32] 。因此,对部分合并肝癌切除术后高危复发因素患者,TACE联合系统抗肿瘤治疗可能会进一步提升患者的生存获益,但仍需更多循证医学证据支持。
推荐意见9:术后辅助性TACE治疗可以改善合并高危复发因素患者的RFS、OS。(证据等级1,推荐意见A级)
2.肝动脉灌注化疗(hepatic arterial infusion chemotherapy,HAIC)
近年来,我国研究者在采用以FOLFOX方案(奥沙利铂+亚叶酸钙+5-氟尿嘧啶)为基础的HAIC治疗中晚期肝癌领域取得诸多进展,但其在术后辅助治疗方面的价值仍有待进一步验证。1项包含12项临床研究(合计1333例患者)的荟萃分析结果显示:术后辅助性HAIC相较于单纯手术,有助于改善肝癌患者的长期预后,尤其是对于合并微血管或大血管侵犯患者 [78] 。但该结论尚需进一步验证。1项多中心、前瞻性、RCT结果显示:在合并微血管侵犯的肝癌患者术后行2个疗程辅助性HAIC治疗(间隔为1个月),可显著改善其RFS,且患者耐受性和依从性良好 [79] 。1项多中心回顾性研究结果显示:与辅助TACE比较,辅助HAIC在预防合并微血管侵犯肝癌患者肿瘤复发和提高生存率方面更具优势 [80] 。近年来,有小样本研究报道术后采用FOLFOX方案的HAIC联合免疫治疗、靶向治疗及靶免联合治疗可以进一步改善患者RFS [81‑83] 。对于肝切除术后发现有微血管侵犯的肝癌患者,可建议在手术后1~2个月内进行术后辅助性HAIC治疗。
推荐意见10:对于合并微血管侵犯患者,术后采用FOLFOX方案的HAIC治疗能够改善患者的RFS。(证据等级1,推荐意见B级 )
3.放射治疗
随着调强放射治疗技术在肝癌中的应用,放疗可以更好保护剩余肝体积同时,给予局部肿瘤更高剂量,已成为肝癌术后辅助治疗的重要治疗手段之一。尽管采用了解剖性肝切除,但由于肝内存在包括肝静脉、门静脉、肝动脉以及胆道系统,局部切缘复发患者数量仍占总复发患者数的12%~37% [84‑87] 。放射治疗是局部切缘复发的有效治疗手段之一。系统性综述结果显示:与单纯手术比较,手术联合术后放射治疗可显著延长伴有术后复发风险如术后窄切缘(术后病理学检查显示手术切缘距肿瘤<1cm)、合并微血管侵犯、合并门静脉瘤栓患者的DFS和OS( P <0.05);亚组分析结果示术后放射治疗在各亚组中均可显著延长患者的DFS和OS [88] 。同时,系统性综述结果还显示:与术后辅助TACE治疗比较,术后放疗可显著延长患者DFS和OS [88] 。但该结论尚需通过大样本量的Ⅲ期RCT进一步证实。
1项前瞻性单臂Ⅱ期研究和多项回顾性研究结果显示:肝癌术后窄切缘患者,术后行调强放射治疗可显著降低局部复发率,延长DFS和OS [89‑91] 。1项RCT结果显示:对于肝癌术后微血管侵犯阳性患者,术后行立体定向放射治疗可显著延长患者DFS( P =0.005),但未延长患者OS( P =0.053) [92] 。1项单臂Ⅱ期临床研究和1项回顾性研究结果显示:肝癌术后微血管侵犯阳性患者,术后行常规分割调强放射治疗可显著延长患者DFS和OS [93-94] ;尤其术后微血管侵犯阳性同时合并窄切缘患者,术后放射治疗的受益更加显著 [93] 。1项RCT结果显示:肝癌伴门静脉癌栓患者行手术联合术后调强放射治疗可显著延长患者DFS( P =0.001)和OS( P =0.005) [95] 。
窄切缘是局部切缘复发最直接的危险因素。对于窄切缘患者,术后放疗是目前证据最充分且结果最一致的术后辅助治疗手段。1项基于前瞻性Ⅱ期研究和真实世界数据的倾向评分匹配分析结果显示:与单纯手术比较,窄切缘患者行手术联合术后放射治疗不仅能降低切缘复发率,还可降低肝内转移与远处转移发生率 [96] 。在术后TACE治疗方面,1项针对T1~2N0M0期肝癌患者的Ⅲ期RCT结果显示:术后TACE并未显著提高早期患者的生存率 [73] 。1项针对微血管侵犯阳性患者的Ⅲ期RCT [68] 和1项针对多灶性或肿瘤长径>5cm或微血管侵犯阳性患者RCT [18] 结果显示:术后TACE可以显著延长患者的DFS和OS。但对于单纯窄切缘患者,1项单中心RCT研究结果显示:与术后TACE治疗比较,术后放射治疗可显著降低肝内复发率( P =0.011) [97] 。因此,对于早期肝癌术后单纯窄切缘且无其他高危因素的患者,可考虑行术后放射治疗,以降低术后复发风险。
术后放疗技术推荐采用常规调强放射治疗或容积旋转调强放射治疗,可显著提高局部瘤床区的剂量,同时降低周围正常器官的受照剂量 [89,93] 。分割模式上,目前多数研究采用常规分割 [89-90,93,95] ,仅少数研究采用大分割 [92] 。由于我国肝癌的主要病因为乙肝或丙肝,其对放射治疗敏感性高,同时受限于周围邻近空腔器官如胃、十二指肠和结肠等的剂量限值,尤其是术后上述空腔器官与手术切缘更贴近,大分割较常规分割缺乏剂量优势。因此,目前推荐采用常规分割放射治疗。肝癌术后放射治疗的靶区范围,对于无淋巴结转移患者无需行淋巴结引流区的预防照射。局部靶区建议包括切缘瘤床范围的1.0~1.5cm肝实质,对于取栓术后患者,靶区应包括全部原瘤栓侵及的血管并外扩1.0cm。处方剂量建议根据周围正常器官的耐受限量给予50~60Gy/25~30f [89,93,95] 。
推荐意见11:对于术后窄切缘(切缘≤1cm)患者,术后调强放射治疗可以延长患者DFS和OS(证据等级1,推荐意见B级);对于术后组织病理学检查结果示微血管侵犯阳性患者,术后调强放射治疗可以延长患者DFS(证据等级1,推荐意见B级);对于合并门静脉癌栓患者,术后调强放射治疗可以延长患者DFS和OS(证据等级1,推荐意见B级)。对于术后仅单纯窄切缘,无其他高危复发因素的早期肝癌患者,可考虑行术后放射治疗,以降低术后复发风险。(证据等级2,推荐意见B级)
(三)抗病毒治疗
血清HBV DNA载量高是HBV相关肝癌根治性切除术后复发的高危因素 [98] 。因此,规范的抗HBV治疗对预防肝癌复发至关重要。目前常用的抗HBV药物为高效且高耐药屏障的核苷类似物,包括恩替卡韦、富马酸替诺福韦酯、丙酚替诺福韦、艾米替诺福韦等。国内多项单中心及多中心RCT结果显示:合并HBV感染的肝癌患者行根治性切除术后,使用核苷类似物抗HBV治疗,既可以控制基础肝脏疾病、稳定肝功能,还能降低肝癌复发率并改善远期生存 [99‑101] 。1项单中心RCT结果显示 [102] :替诺福韦在降低肿瘤复发风险方面显著优于恩替卡韦,术后行替诺福韦治疗是预防晚期肿瘤复发的独立保护因素,但不影响早期肿瘤复发。1项包括15项研究(共8060例患者)的Meta分析结果显示:肝癌根治性切除术后使用核苷类似物抗病毒治疗的HBV相关肝癌患者,其术后1、3、5年的总生存率及无复发生存率均优于对照组 [103] 。另1项包括26项研究(共计9009例患者)的Meta分析也得出类似结论 [104] 。
对于HCV相关肝癌患者,直接作用的抗病毒药物(directacting antiviral agents,DAAs)可获得持续病毒学应答,但DAAs是否可以降低HCV相关肝癌患者根治性切除术后的复发率并延长OS尚存争议。1项前瞻性、多中心队列研究结果显示:在合并HCV相关肝硬化且接受根治性治疗的早期肝癌患者中,与术后未接受DAAs治疗比较,DAAs治疗可显著改善患者OS( P =0.03) [105] 。Singal等 [106] 提出:当前关于HCV相关肝癌根治术后DAAs治疗的研究存在局限,仍需高级别循证医学证据证实DAAs治疗与术后复发风险及复发后肿瘤侵袭性的相关性。
推荐意见12:HBV相关肝癌患者根治性手术后使用核苷类似物抗病毒治疗,可以抑制肝癌复发,延长患者OS(证据等级1,推荐意见A级)。HCV相关肝癌患者术后使用DAAs治疗是否可以有效预防肝癌复发仍需要高级别循证医学证据证实。(证据等级3,推荐意见C级)
四、肝癌肝移植术后辅助治疗手段
肝癌肝移植术后预防肿瘤复发的辅助治疗手段主要包括:合理选择免疫抑制方案、抗病毒治疗和系统抗肿瘤药物治疗。Rodríguez‑Peralvarez等 [107] 的多中心回顾性研究结果显示:肝癌肝移植术后免疫抑制方案中,尽早降低钙调磷酸酶抑制剂用量可降低肝癌复发率,而是否包含激素则不影响复发率。Segev等 [108] 的研究结果显示:肝移植术后早期撤除激素或使用无激素免疫抑制方案有助于降低肿瘤复发率。此外,使用以西罗莫司、依维莫司为代表的哺乳动物雷帕霉素靶蛋白(mammalian target of rapamycin,mTOR)抑制剂为主的免疫抑制治疗方案,可以降低肝癌肝移植术后复发率,延长患者OS [109‑113] 。
肝癌肝移植术后抗病毒治疗也是预防肝癌复发的关键。对于合并HBV的肝癌肝移植术后患者,主要抗病毒方案为以恩替卡韦、替诺福韦为代表的高效、高耐药屏障核苷类似物联合乙肝免疫球蛋白,有助于预防乙肝复发 [114‑117] 。对于合并HCV的肝癌肝移植患者,Watt等 [118] 提出移植术后仅在病理学检查结果确认HCV复发后才可行抗HCV治疗。对HCV复发受者,术后早期抗病毒的最佳时机尚无统一标准,需综合评估肝肾功能、药物相互作用等因素。若患者符合抗病毒适应证、可耐受药物且无禁忌证,应尽早启动抗病毒治疗。
系统抗肿瘤药物在肝癌肝移植术后辅助治疗的循证医学证据较少,缺乏大样本量临床研究。有限的小样本量前瞻性临床研究结果提示:分子靶向药物和系统化疗药物等辅助治疗可能为部分受者尤其是超标准肝移植受者提供生存获益 [119‑121] 。鼓励开展相关研究,为肝癌肝移植术后的辅助治疗提供更多证据,为后续前瞻性研究及更高级别研究的开展奠定基础,并提供方向参考。
组建由肝移植外科、肿瘤科、感染科、影像科等专家组成的团队,为患者提供从术前评估、术后监测到复发防治的全周期管理,是延长患者术后生存时间的重要策略 [122‑124] 。术后监测及患者管理包括:
(1)血清学与影像学监测:术后前2年每3个月检测AFP、异常凝血酶原及腹部超声或增强CT或MRI检查,术后3~5年每6个月监测1次。
(2)复发风险评估:结合肿瘤大小、微血管侵犯及术后病理学分期(如Edmondson分级)动态调整监测频率。
(3)分层随访计划:高危患者(如肿瘤长径>5cm、微血管侵犯阳性)需缩短随访间隔至1~2个月,低危患者可延长至3~6个月。
(4)生活方式干预:严格戒酒、控制体质量(BMI<25kg/m 2 )、避免肝毒性药物,推荐低脂高蛋白饮食。
(5)心理支持:通过术后康复门诊、患者社群等提供心理疏导,降低焦虑抑郁发生率。
推荐意见13:肝癌肝移植术后建议减少、早期撤除或不用激素,降低钙调磷酸酶抑制剂的用量,使用mTOR抑制剂为主的免疫抑制方案,有助于减少肝癌肝移植术后肿瘤复发率,延长患者OS。(证据等级3,推荐意见A级)
推荐意见14:合并HBV感染的肝癌肝移植受者,术后需终身使用强效高耐药屏障核苷(酸)类似物以维持HBV DNA持续阴性;对于HCV复发的肝癌肝移植受者,若无禁忌证可尽早行DAAs治疗,以降低病毒再激活导致的肝癌复发风险。(证据等级2,推荐意见A级)
推荐意见15:术后早期强化监测可改善肝癌肝移植受者预后,包括建立多学科协作的全程管理团队,规范术后监测与早期复发诊断,制订个体化随访与健康教育计划。(证据等级2,推荐意见A级)
五、肝癌消融术后辅助治疗手段
消融治疗已成为继手术切除和肝移植后,针对小肝癌的重要根治性治疗手段。大量临床研究结果显示:对于部分早期肝癌患者,消融治疗可达到与手术切除相当的疗效 [125‑128] 。目前临床常用的消融技术主要包括 [3] RFA、微波消融、经皮无水乙醇注射以及冷冻消融。上述技术各具特点,其适应证和临床应用范围亦不同。然而,肿瘤的高复发率仍是制约肝癌患者消融术后长期生存的主要瓶颈。目前,学术界对消融术后复发高危因素的定义仍在不断探索中。IMbrave050研究提出:消融术后高危复发风险的界定标准为单发肿瘤最大径>2cm且<5cm,或多发肿瘤(<4个)且肿瘤最大径<5cm [38] 。多项回顾性研究提供了重要循证依据:对于孤立性肝癌(肿瘤长径>2.0cm)患者,肝移植和手术切除较RFA显示出更优疗效 [128] 。而在小血管周围肝癌患者中,手术切除在长期肿瘤控制和OS方面均优于RFA,该优势在门静脉周围肿瘤患者中尤为显著 [129] 。回顾性研究结果显示:初次肝切除术中微血管侵犯的分级对早期复发性肝癌RFA术后索拉非尼辅助治疗的应用具有重要指导价值 [130] 。研究结果显示:微血管侵犯分级为M1的患者中,仅当肿瘤最大径为3~5cm、肿瘤数目为2~3个或AFP>400μg/L时,患者可从索拉非尼辅助治疗中获益;而对于微血管侵犯分级为M2的患者,即使肿瘤长径为2~3cm或AFP≤400μg/L,也建议在RFA术后进行索拉非尼辅助治疗。近年来,热消融诱导的原位肿瘤坏死作为抗肿瘤免疫的抗原来源备受关注。基于此,众多研究致力于探索RFA联合免疫治疗的多模式治疗策略,以期解决消融术后高复发率的难题,并将免疫疗法作为弥补消融治疗肝癌局限性的潜在选择 [131] 。然而,目前仍缺乏可靠的临床数据支持,该治疗模式的规范化临床应用仍需进一步探索。此外,寻找肿瘤复发的独立预测因子以指导消融术后个体化辅助治疗,仍是当前研究的重要方向 [132-133] 。
推荐意见16:在肝癌消融术后行靶向药物和免疫检查点抑制剂辅助治疗方面,目前尚无高级别循证医学证据支持的推荐方案;现有的证据显示:靶向药物或免疫检查点抑制剂单药或联合应用,可能改善合并高危复发因素患者的预后,但需开展高级别循证医学证据临床研究进一步证实。(证据等级3,推荐意见B级)
六、结语
近年来,肝癌的系统治疗取得了突破性进展,临床医师有了更多的治疗选择。单独或多种治疗手段联合用于术后辅助治疗的多项临床研究正在开展中。随着未来研究结果的公布,肝癌术后辅助治疗中国专家共识协作组将基于新的循证医学证据对本共识及时更新和补充,不断完善。

排版编辑:肿瘤资讯-as











 苏公网安备32059002004080号
苏公网安备32059002004080号


