近日,2026年美国临床肿瘤学会胃肠道肿瘤研讨会(ASCO GI)在旧金山举行。针对局晚期胃癌围手术期治疗预后不佳这一临床难点,南京大学医学院附属鼓楼医院魏嘉教授团队牵头的TERRIFIC研究(摘要号:286)入选大会Rapid Oral环节。该研究创新探索了“免疫+同步放化疗”新模式,为突破治疗瓶颈提供了新思路。【肿瘤资讯】特邀魏嘉教授深度解读研究细节与领域趋势。
南京大学医学院附属鼓楼医院主任医师,教授、博士生导师
南京大学医学院附属鼓楼医院副院长、肿瘤中心副主任
南京大学临床肿瘤研究所副所长
教育部“长江学者奖励计划”青年学者
科技部科技重大专项首席科学家
中国肿瘤青年科学家、中国青年五四奖章获得者
中国抗癌协会整合肿瘤学分会副主任委员
中国临床肿瘤学会(CSCO)青年专家委员会副主任委员
研究方向为恶性肿瘤精准靶向/免疫治疗。在Cancer Cell、Cell Research、The Lancet、J Clin Oncol等国际著名杂志上发表多篇论著。
Q1. 请您介绍一下TERRIFIC研究的入组标准、分组设计,以及对照组设置的考量,这种设计对于明确局部晚期胃癌的最佳治疗模式具有怎样的指导价值?
魏嘉教授:我们在今年的ASCO GI大会上报道的ⅡB期TERRIFIC研究,是针对局部晚期胃癌及胃食管交界部腺癌患者设计。从具体入组标准来看,患者的临床分期为Ⅲ~Ⅳa期,即cT3~4aN+M0或cT4bNanyM0。从围手术期临床研究的角度看,这部分患者的分期相对偏晚。
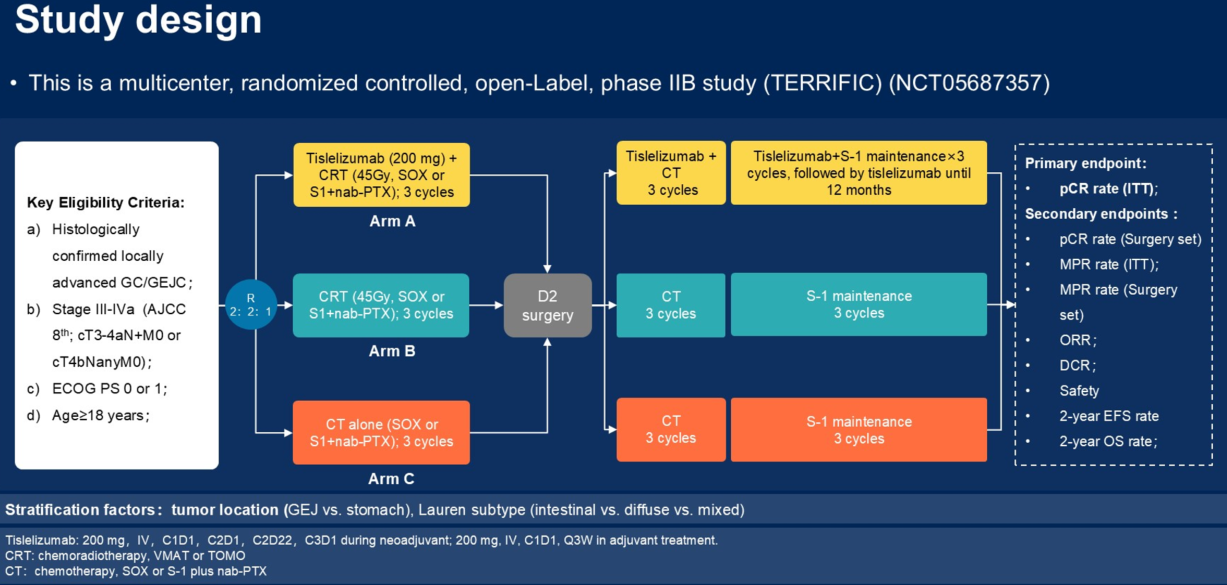
研究根据肿瘤部位(胃食管交界部 vs 胃)、Lauren分型(肠型 vs 弥漫型 vs 混合型)等因素进行分层,将患者按2∶2∶1的比例随机分配至3个治疗组:
A组:替雷利珠单抗(PD-1抑制剂)联合同步放化疗(CRT)组;
B组:CRT组;
C组:单纯化疗(CT)组。
研究的主要终点是意向性治疗(ITT)人群的病理完全缓解(pCR)率,次要终点包括手术人群的pCR率、主要病理缓解(MPR)率、生存指标、安全性、疾病控制率及后续的生物标志物分析等。
这一设计主要基于我们两年前发表在Cancer Communications杂志的SHARED研究。SHARED研究是一项关于免疫联合同步放化疗治疗局部晚期胃癌的单臂探索性研究。当时正值国产PD-1抑制剂刚上市,我们发现对于分期偏晚的胃癌患者,放疗、化疗与免疫治疗的联合应用能显著增效。尽管SHARED研究仅入组了30多例患者,但取得了38.2%的pCR率,且长期随访显示出良好的生存获益。
基于此,为了进一步验证此前观察到的高pCR率,并厘清各治疗手段的具体贡献,我们设计了TERRIFIC这项多中心随机对照研究。该研究主要旨在回答以下两个核心问题:
第一,明确强化治疗的优势。通过对比A组(免疫联合CRT)与传统的单纯化疗(C组),我们希望明确这种“三联”强化方案相比目前的标准治疗,究竟能带来多大的疗效提升。
第二,厘清免疫与放化疗的协同增效。尽管CRT在胃癌围手术期治疗目前尚缺乏高级别的循证医学证据,但我们及国内同行的前期研究均证实,其在局部控制上具有显著优势。因此,通过设置CRT组(B组),我们希望进一步解答:在同步放化疗的基础上叠加免疫治疗,能否产生“1+1>2”的增效作用?即明确最终的获益是单纯源于免疫治疗的加入,还是免疫与CRT产生了协同效应从而带来了更大的优势。
关于为何未设置“PD-1单抗联合化疗”组,是因为在研究设计之初,类似的MATTERHORN研究尚在进行中,缺乏阳性数据支持,因此我们当时主要聚焦于回答目前临床常用的围手术期治疗策略之间的差异。
Q2. 请您分享各组在pCR(病理完全缓解)和MPR(主要病理缓解)这两个关键指标上的具体表现?
魏嘉教授:在介绍疗效数据之前,有必要先说明一下入组患者的基线特征。正如大会报告所示,本研究入组患者的分期普遍偏晚:58%以上的患者临床T分期为T4a或T4b,85%以上的患者存在N2至N3淋巴结转移。此外,基于SHARED研究的经验,我们引入了局部放疗,且未将范围局限于近端胃,入组患者中60%以上为全胃肿瘤。这表明放疗作为局部治疗手段,其应用范围可以更广。
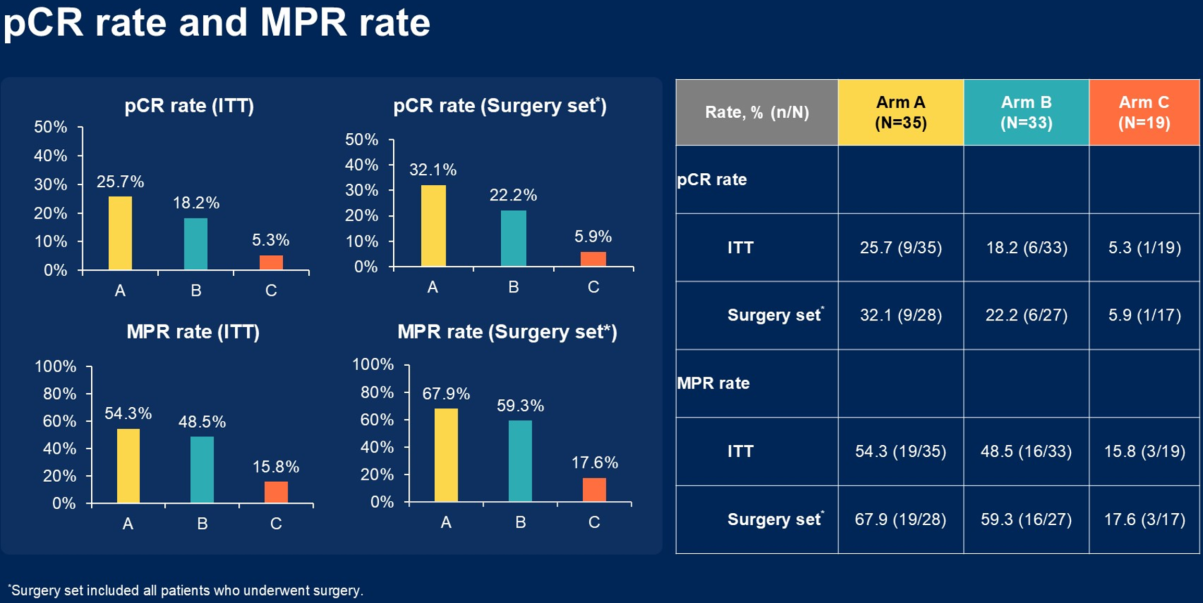
虽然我们的研究的主要终点是ITT 人群的 pCR 率,但鉴于本次中期分析时仍有十余例患者尚未接受手术,所以我们现阶段更侧重于评估手术人群的 pCR 率。根据今年ASCO GI报道的中期分析数据,在已接受手术的人群中:
pCR率:A组为32.1%,B组为22.2%,C组为5.9%。这一结果符合既往认知:SHARED研究的pCR率为38.2%,国内其他单臂CRT研究的pCR率也多在30%以上,与A组数据基本一致;C组的数据(约6%)与RESOLVE研究保持一致;B组的数据(约20%)也符合既往报道。
MPR率:含放疗组表现出显著优势。A组的MPR率高达67.9%,B组为59.3%,均显著高于单纯化疗组(C组)的17.6%。 这一数据超出了我们的预期,尤其是B组的表现非常优异,证实了局部放射治疗能带来明显的近期肿瘤退缩。
当然,所有围手术期研究的核心问题在于:近期的病理缓解和影像降期能否转化为长期的生存获益?虽然目前的生存数据尚未成熟,但基于A组优异的pCR率表现,以及同类研究如CROSS和NEOCRTEC5010长期随访显示的生存获益,我们对A组的生存转化充满信心。后续我们将持续更新生存数据并进行生物标志物分析,以更全面地回答这一问题。
Q3.在追求高pCR率的同时,三联方案(免疫联合放化疗)的安全性表现如何?这种强化治疗模式是否增加了后续手术的难度或风险?
魏嘉教授:确实,在研究初期,大家也很担心免疫治疗或放疗的引入是否会增加手术难度及相关并发症风险。但结合SHARED研究和TERRIFIC研究的数据来看,安全性是高度可控的。
在专业的胃外科团队管理下,我们并未观察到特殊或非预期的手术相关不良事件。研究中出现的不良反应主要与药物相关,最常见的是化疗导致的骨髓抑制,且多为可逆性。
对于手术难度的把控,关键在于治疗流程的精细化管理。我们的研究设计将术前治疗分为三个阶段:药物诱导、放射治疗、再次药物治疗。我们严格控制放疗结束至手术开始的时间窗。只要在这个特定的时间范围内进行手术,并依托亚专科化的精细管理和MDT团队协作,无论是免疫联合化疗,还是免疫联合同步放化疗,都不会对手术风险和不良事件产生显著负面影响。
Q4. TERRIFIC研究展示了“免疫+放化疗”的卓越数据,而MATTERHORN研究也确立了“免疫+化疗”的成功地位。在您看来,局晚期胃癌的围手术期治疗策略应如何选择?
魏嘉教授:围手术期胃癌治疗的最优化模式目前仍处于探索阶段。MATTERHORN研究与我们的研究存在差异:其入组患者分期相对较早(T4期约占25%),且采用的是三药联合(FLOT方案),这是西方国家的标准方案。
关于选择“免疫+强化疗”还是“免疫+同步放化疗”,甚至“免疫+两药化疗”,不同研究显示出了一定的倾向性:
生物标志物的影响:尽管我们的研究未通过生物标志物筛选患者,但亚组分析及既往单臂研究显示,PD-L1高表达人群在含免疫治疗组中倾向于获得更好的近期疗效。沈琳教授牵头的PD-1单抗联合SOX方案研究取得阳性结果,入组的正是PD-L1 CPS≥5的人群。
基线特征与耐受性:MATTERHORN采用的三药FLOT方案在亚洲人群中的耐受性相对较差,这会影响治疗完成度。即便是两药方案,部分患者术后耐受性也存在挑战。相比之下,我们的研究针对分期更晚的人群,通过引入放疗实现了很高的病理缓解率。
未来的方向在于精准化选择。既然多种模式都可能有效,关键在于确定哪些患者能从哪种治疗中获益最大。虽然目前我们主要关注近期疗效向生存率的转化,但随着晚期胃癌进入精准治疗时代,围手术期治疗也必将走向基于生物标志物的细分人群治疗,最终实现“高效低毒”的目标。
Q5. 未来您的团队是否有开展III期确证性研究或长期随访的计划?
魏嘉教授:目前,TERRIFIC研究将继续进行两年的PFS(无进展生存期)随访。除了观察pCR,我们更关注生存获益及伴随的生物标志物研究。
至于是否开展III期研究,我们需要等待生存数据进一步成熟,并参考同类研究的进展。届时,临床标准治疗的定义可能已发生演变,我们需要依据彼时的标准治疗来科学设定对照组和试验组的治疗方案以及入组人群标准。
最后,我还是想特别呼吁大家关注放射治疗在免疫时代的独特价值。从机制上看,放疗与免疫治疗存在显著的协同效应,且化疗药物也能通过不同途径发挥免疫增敏作用。因此,我个人非常看好放射治疗在围手术期中的应用前景。这种联合治疗的价值不仅仅在于提升了近期的肿瘤退缩率和pCR率;更重要的是,对于分期较晚的局晚期胃癌患者而言,这种深度的病理缓解和肿瘤残留的最小化,是有极大可能转化为长期的生存获益的。
排版编辑:Linda











 苏公网安备32059002004080号
苏公网安备32059002004080号


