神经内分泌肿瘤是一类具有高度异质性的肿瘤。本文分享了一例肺原发神经内分泌肿瘤患者的诊疗全过程。该病例具有典型的时空异质性,在多次疾病进展过程中,肿瘤的病理分级、增殖指数及分子特征均发生了显著变化。通过多学科团队(MDT)的协作,特别是再活检和基因检测在关键节点的介入,为患者在常规治疗手段匮乏的情况下,寻找到了免疫治疗和靶向治疗的精准契机,延长了患者的生存时间。
病例介绍
患者基本信息:男性,41岁。
主诉:体检发现右肺结节。
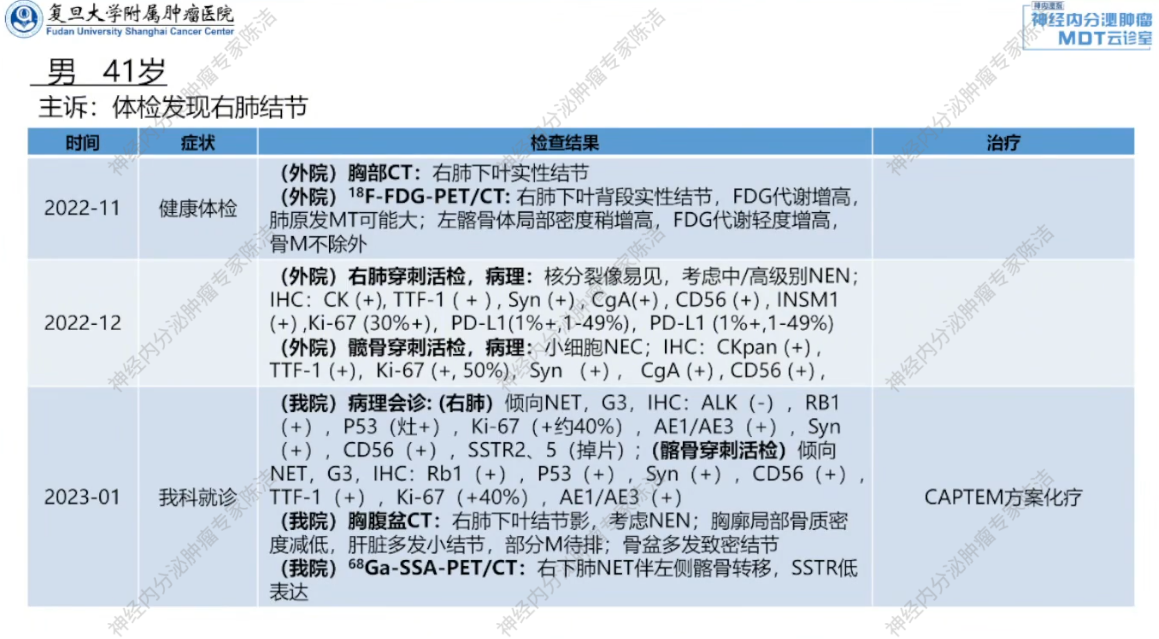
外院诊疗经过:2022年11月,患者于外院进行健康体检,胸部CT发现右肺下叶实性结节。进一步行FDG-PET-CT检查,显示右肺背段实性结节糖代谢增高,考虑恶性肿瘤;同时发现左侧髂骨骨质密度改变,考虑骨转移可能。外院随即对右肺和左侧髂骨病灶进行了穿刺活检。右肺病理提示中高级别神经内分泌肿瘤,Ki-67阳性率为30%;髋骨穿刺病理提示小细胞神经内分泌癌(NEC),考虑为转移性。
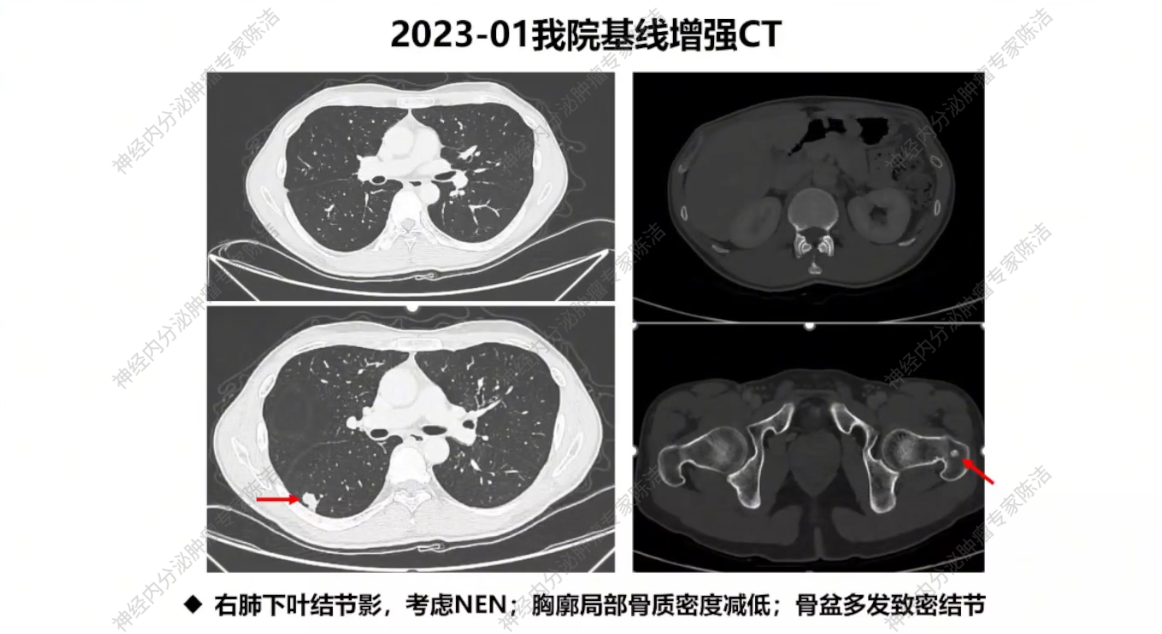
我院基线评估:患者随后转入我院,经我院病理科会诊,两部位病理均提示为高级别神经内分泌瘤,肺和骨病灶的生长抑素受体呈低表达状态。完善基线检查:胸腹盆CT及68Ga-SSA-PET/CT显示,除右肺和骨病灶外,肝脏存在多发小结节,不能排除转移可能。
诊疗经过:
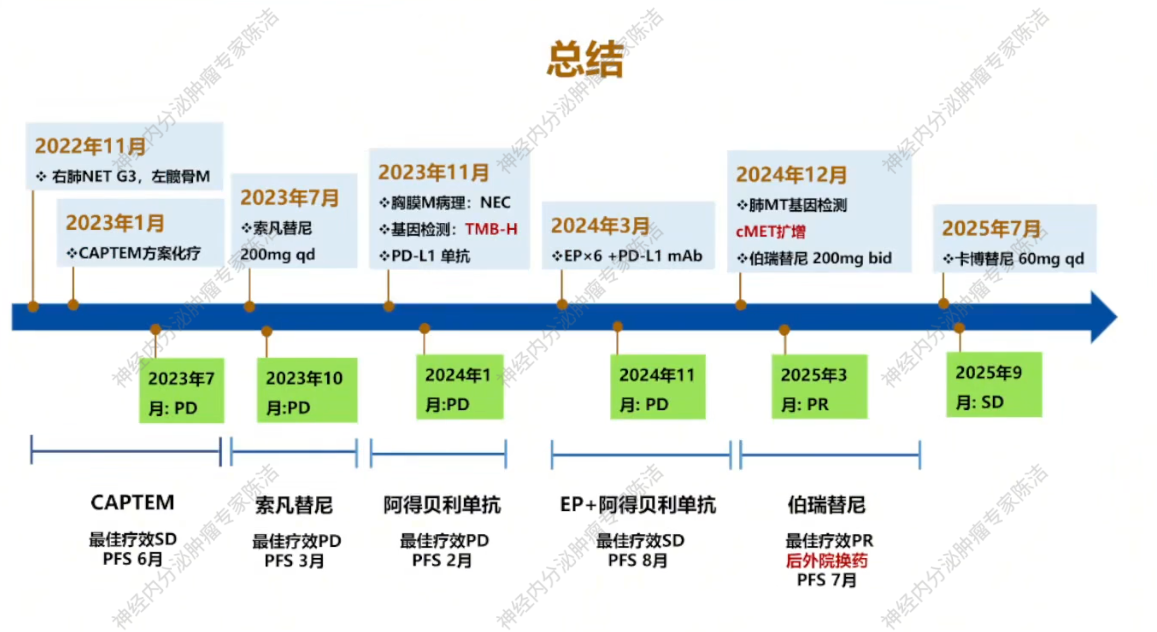
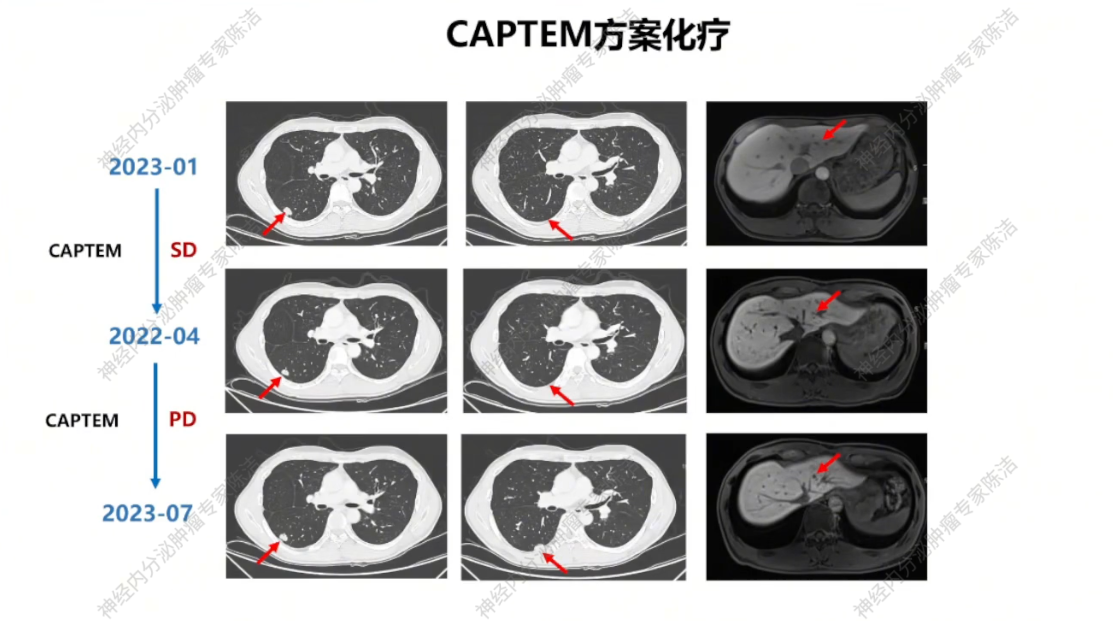
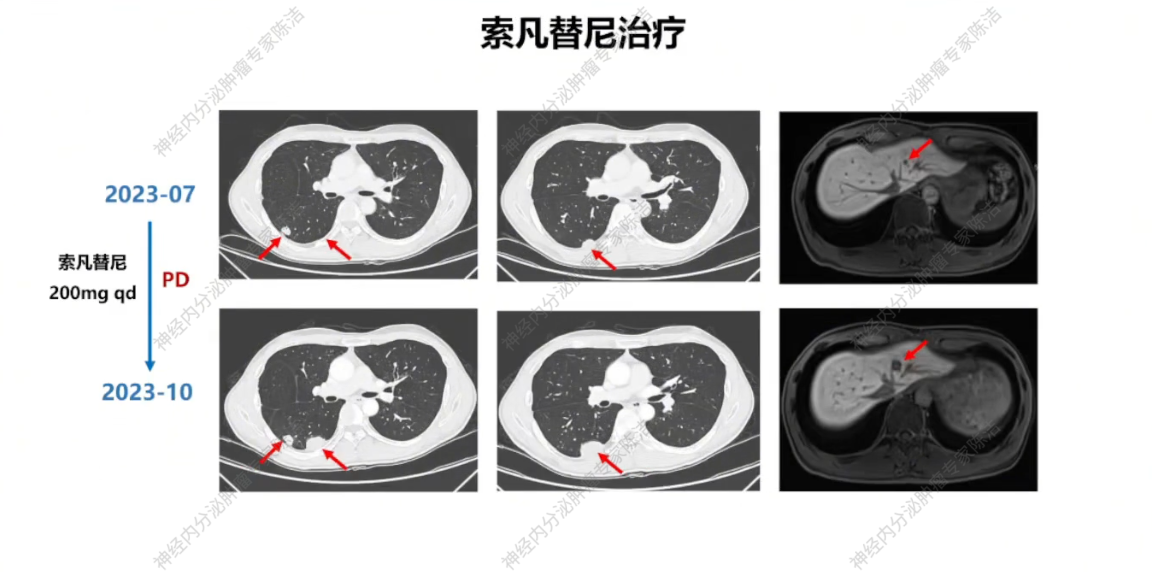
2023年1月,鉴于患者SSTR低表达,建议行CAPTEM(卡培他滨+替莫唑胺)方案口服化疗。患者接受三个周期化疗后复查,疗效评估为疾病稳定(SD)。但2023年7月,复查胸腹盆增强CT+肝普美显MR提示疾病进展(PD),方案调整为索凡替尼200mg单药治疗。该方案维持治疗三个月后,疾病再次进展。
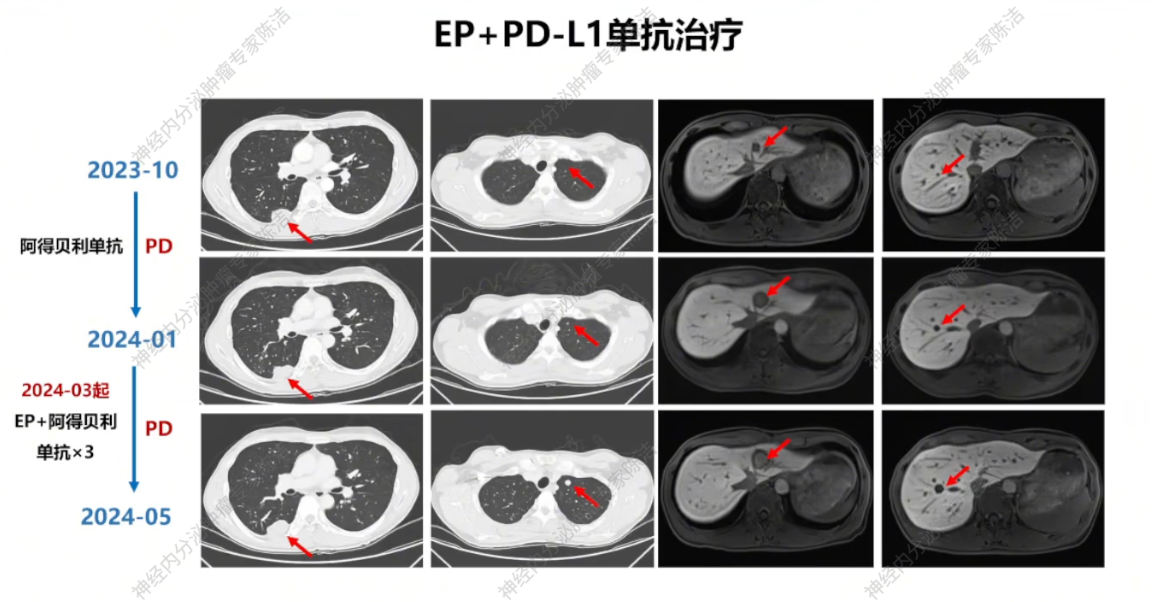
2023年11月,针对进展较快的右侧胸膜病灶进行重新活检,病理提示NEC,Ki-67热点区高达70%,提示有瘤癌转化倾向。基因检测结果显示:PD-L1 CPS评分达5,且肿瘤突变负荷(TMB, 144.9Mut/Mb)及肿瘤新生抗原负荷(TNB, 69.4Neo/Mb)高。MDT讨论认为患者可能从免疫治疗中获益,予使用PD-L1单抗阿得贝利单抗单药治疗。
治疗2个月后,患者于2024年1月返我院复查,疗效评估PD,考虑患者Ki-67指数高且有瘤癌转化倾向,予调整方案为EP方案(依托泊苷+顺铂)联合阿得贝利单抗。但患者未立刻开始用药,于2024年3月才于外院开始使用EP方案联合阿得贝利单抗,并且,2024年3月未重新行治疗前基线检查。
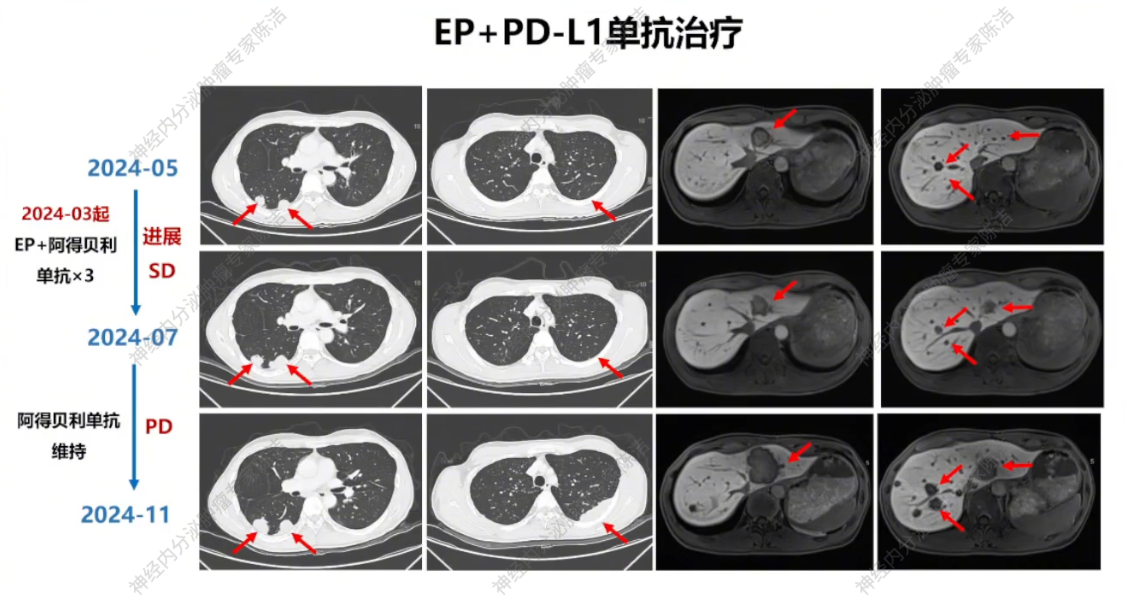
2024年5月返我院复查,与我院1月影像对比提示PD,但考虑到患者2024年3月才开始用药,而2024年3月时无治疗前基线,此次复查评估不能说明该治疗方案无效,遂建议继续尝试EP方案联合阿得贝利单抗3个周期。
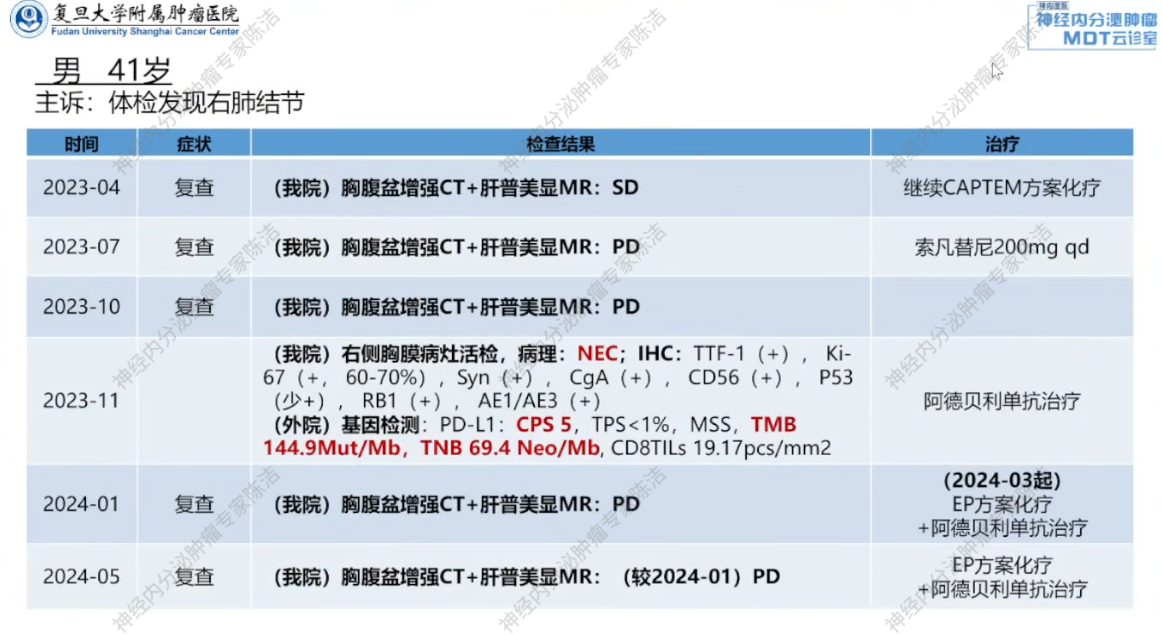
2024年7月复查,疗效评估仍为SD。在患者累计完成6个疗程EP方案化疗,后续采用阿得贝利单抗维持治疗。
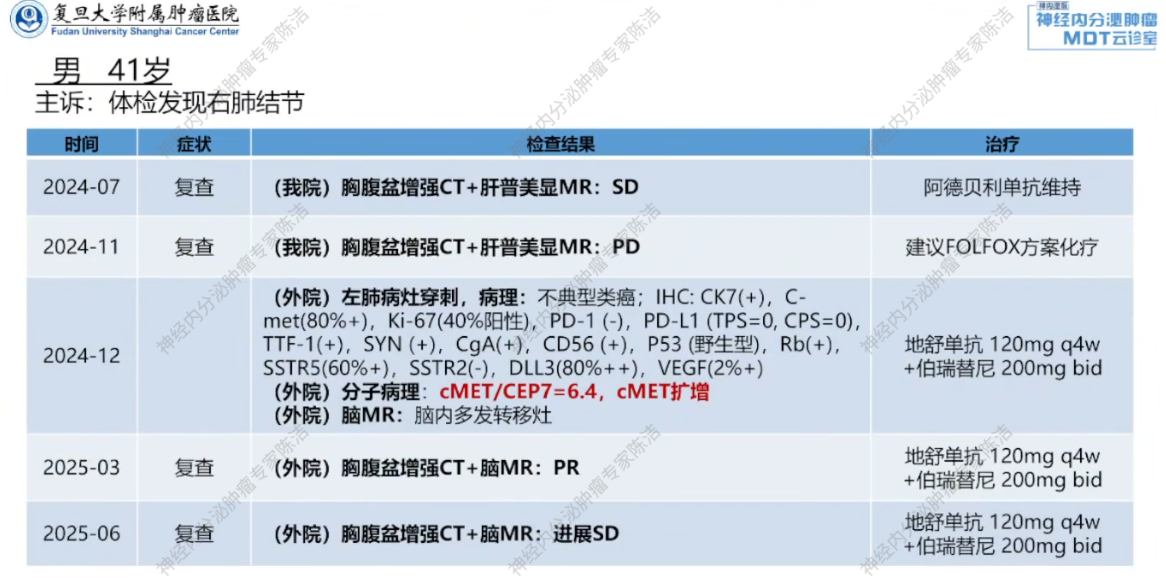
2024年11月复查,疾病再次明确进展。
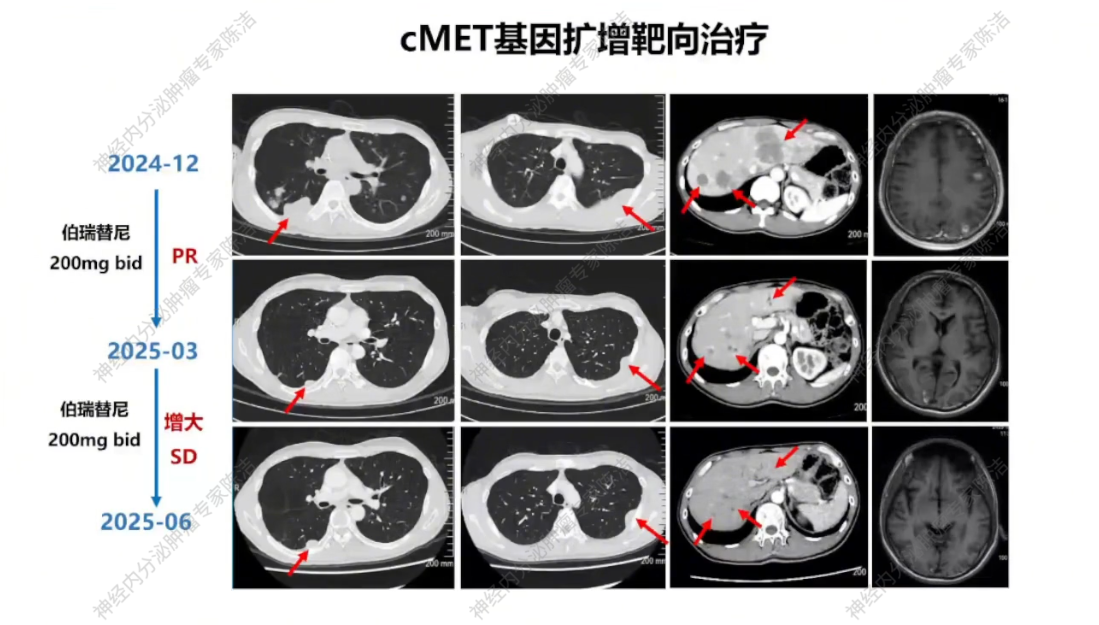
2024年12月,患者至外院就诊,对左肺病灶进行穿刺活检。病理提示不典型类癌,Ki-67指数为40%,但PD-L1的TPS和CPS均为0。分子病理检测示:c-MET基因显著扩增,且影像学提示出现颅内多发转移灶。基于c-MET高扩增及脑转移情况,外院选择伯瑞替尼(c-MET抑制剂)靶向治疗,同时联合地舒单抗保骨治疗。
治疗三个月后复查,肺部和头部病灶明显退缩(PR)。继续维持至2025年6月,复查评估为“增大的SD”(病情趋于进展,但未达PD标准)。
2025年7月,患者出现明显骨痛。FDG-PET/CT显示双肺、双侧胸膜、肝脏、左侧髂血管旁淋巴结、颅内及多处骨骼广泛转移,糖代谢活跃。外院对左侧胸膜病灶穿刺,病理仍提示不典型类癌,但Ki-67指数下降至20%。基因检测显示低突变负荷,但MET扩增仍高。
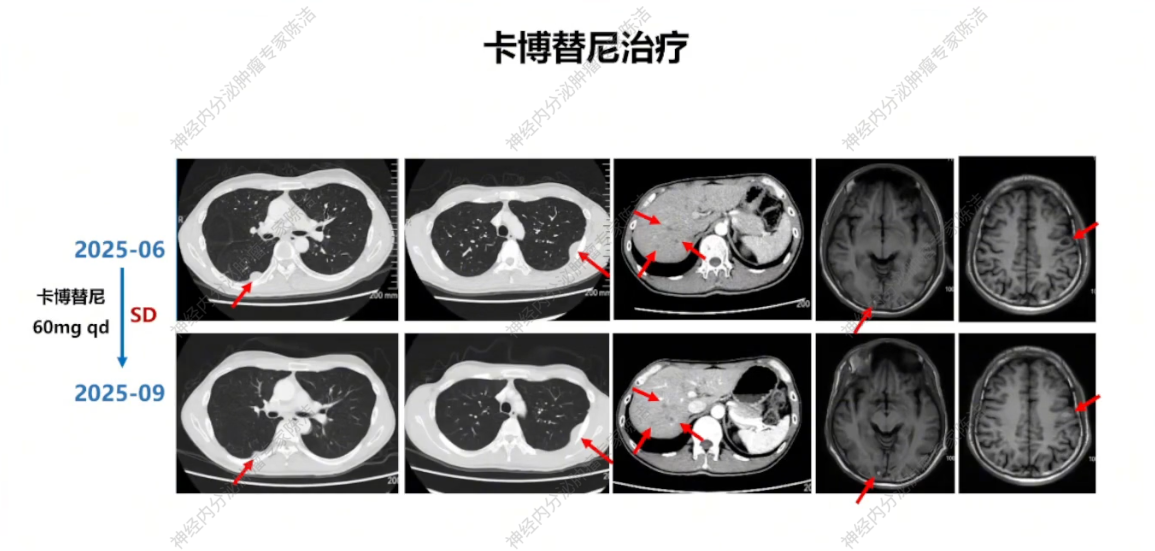
2025年7月23日,行左侧髂骨、坐骨、耻骨转移灶TOMO-IMRT 10次。考虑患者对伯瑞替尼耐药但MET扩增持续存在,2025年7月26日起改用多靶点药物卡博替尼,同时联合地舒单抗保骨治疗。2025年9月复查,影像学评估为SD,继续卡博替尼联合地舒单抗治疗。

多学科团队(MDT)讨论
病理科黄丹教授:本病例病理诊断具有极大挑战性,且体现了肿瘤的高度时空异质性。神经内分泌肿瘤分类的关键在于形态学分化。初诊肺穿刺样本肿瘤细胞少,且穿刺挤压伤严重影响形态学观察。初诊时肺穿刺Ki-67为40%(处于灰区),而髂骨穿刺RB1阳性,综合倾向于高级别神经内分泌瘤(NET G3)。疾病进展后,Ki-67指数从40%跃升至60%—70%,按肺/纵隔标准诊断为NEC,但其分子特征无RB1缺失和P53突变,与传统小细胞癌有本质区别。2024年11月左肺穿刺PD-L1 CPS从之前的5变为0,体现免疫表型的异质性。同时发现c-MET基因扩增,这是驱动肿瘤后期变化的关键因素。2025年7月胸膜穿刺Ki-67指数回落至20%,c-MET免疫组化阳性与基因扩增匹配,且肿瘤重新出现生长抑素受体(SSTR5)的局灶阳性表达。
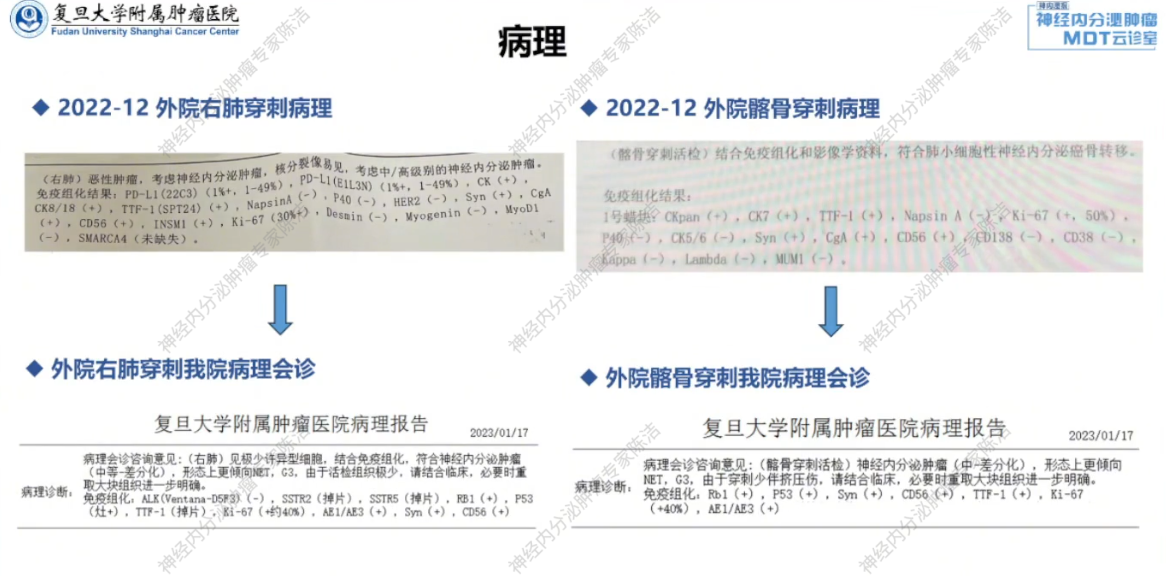



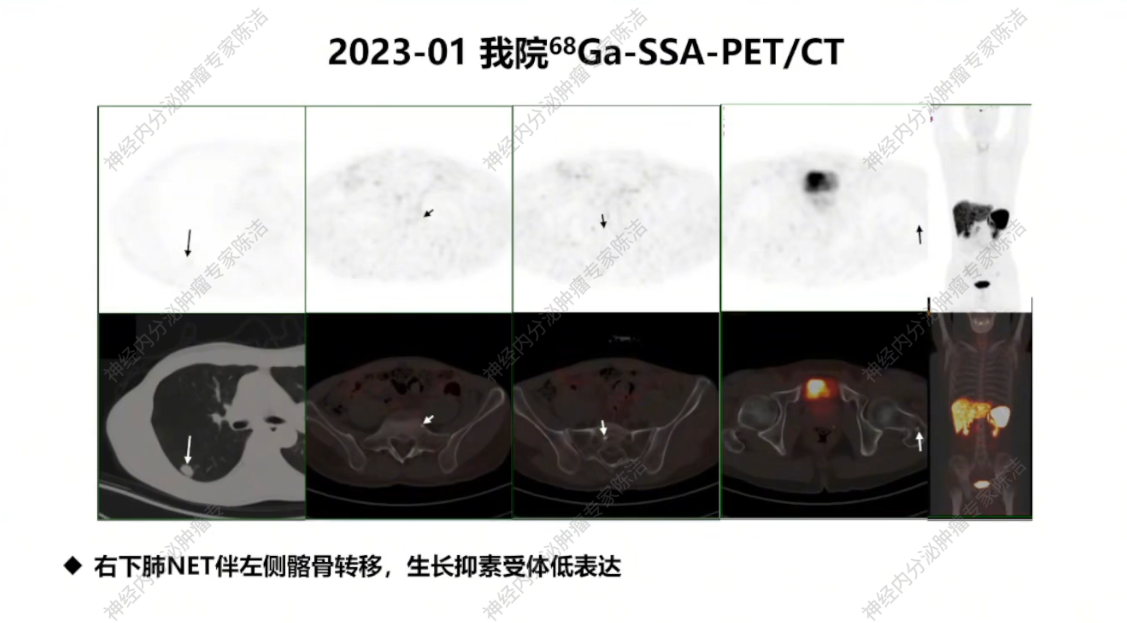
核医学科徐俊彦教授:初诊时18F-FDG-PET/CT显示的高代谢特征与病理提示的高级别神经内分泌瘤诊断相符。2023年我院68Ga-SSA-PET/CT显示肺和骨病灶低表达。通常肺和纵隔NET的SSTR2表达率低于胃肠胰NET;若高表达则可获益于SSA或PRRT治疗,但该患者不具备此条件。多线治疗后,2025年的18F-FDG-PET/CT显示新发病灶(胸膜、肝、骨)的糖代谢明显升高,这与肿瘤Ki-67指数增高呈正比。颅内转移表现为沿脑膜下结节样强化,水肿不明显。值得注意的是,由于脑组织本身高代谢,FDG-PET检查不能很好显示脑转移病灶,此时MRI更能准确反映颅内肿瘤负荷。

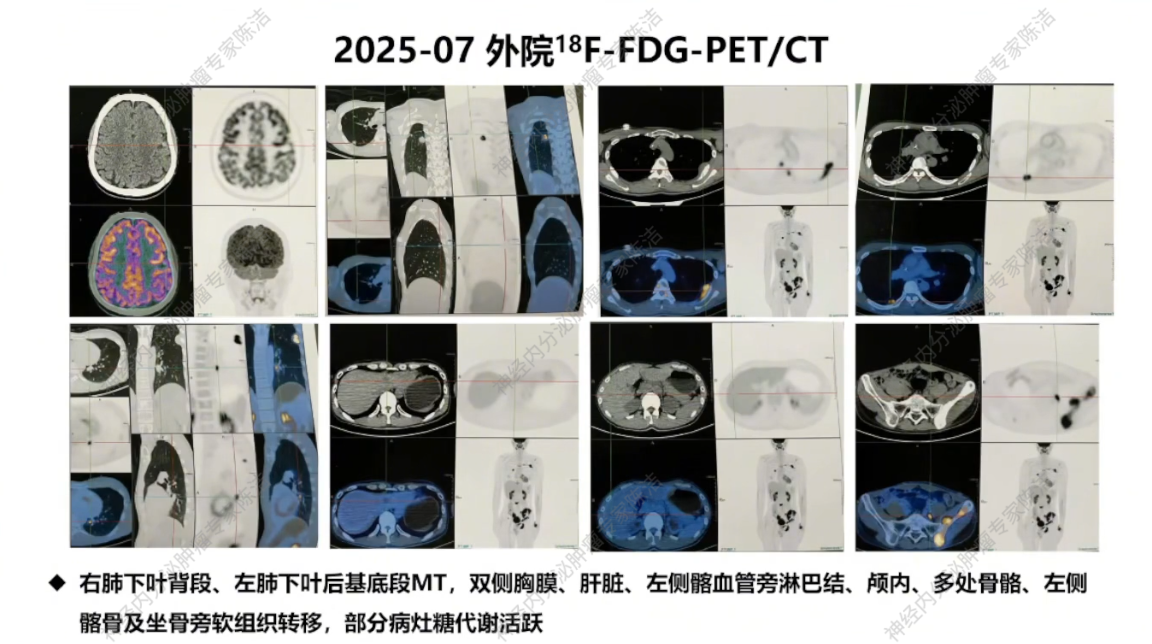
放射诊断科汤伟教授:初诊胸部CT显示右下肺不规则结节,边缘有毛刺、高密度,影像学虽考虑恶性,但确诊需依赖病理。基线普美显MRI提示肝脏微小结节,当时判断转移可能性小,建议观察。CAPTEM方案治疗后,2023年7月右下肺及肝脏微小结节变化,疗效评估为PD。索凡替尼治疗后,右下肺及肝脏病灶继续增大,疗效评估PD。免疫/化免治疗期间,左肺上叶出现新转移灶及肝转移瘤增大,判定为PD。阿得贝利单抗维持期间为“进展的SD”,至11月明确PD。c-MET靶向治疗期,2024年12月至2025年3月伯瑞替尼治疗后取得PR,随后转为“增大的SD”,后更换为卡博替尼治疗,3个月后目前判定为SD。
陈洁教授总结
本病例具有较高的教学和临床参考价值,主要体现在以下三个方面:
第一,肿瘤的高度时空异质性。该患者被确诊为肺原发神经内分泌肿瘤,在长达数年的病程中,多次、多部位的病理活检结果呈现出显著差异。病理级别经历了从高级别神经内分泌瘤(Ki-67 20%—40%)到神经内分泌癌(Ki-67 60%—70%)的动态变化,后续增殖活性Ki-67指数又回落至20%,呈现出瘤癌转化及高度时空异质性的特征。此外,生长抑素受体及重要治疗标志物(如PD-L1)在不同时间、不同部位的表达均存在明显差异。这提示,对于神经内分泌肿瘤,单一时间点的病理结果不能代表全程,重复活检对于动态调整治疗方案至关重要。
第二,基因检测在精准治疗中的核心价值。在肿瘤快速进展、常规治疗手段失效的困境下,两次基因检测非常重要:第一次检测发现高肿瘤突变负荷(TMB-H),为患者争取到了PD-L1抑制剂联合化疗的治疗机会。第二次检测发现c-MET基因扩增,指导后续使用了伯瑞替尼靶向治疗,PFS约7个月,肿瘤最佳疗效评估为PR。这两次精准检测共为患者争取到了超过一年半的肿瘤控制时间,充分证明了体系基因检测在寻找常规治疗以外的“针对性机会”中的重要作用。
第三,突破治疗局限的探索。肺神经内分泌肿瘤,特别是SSTR不表达者,常规治疗局限于TKI类靶向药和化疗,可选方案极少。但本病例也提示,肺原发NET有较高找到特定驱动基因(如c-MET)或其他治疗靶点的机会。因此,临床上应鼓励对此类患者进行深入的分子病理分析,以期发现潜在的治疗靶点,实现个体化的精准治疗。
更多精彩病例,可点击或复制以下链接,粘贴到浏览器查看神经内分泌肿瘤MDT云诊室第三十八期 | 神经内分泌肿瘤基因检测专场回放:
https://doctor.liangyihui.net/#/doc/160363

本文仅供健康科普使用,不能作为诊断、治疗的依据,请谨慎参阅。












 苏公网安备32059002004080号
苏公网安备32059002004080号


