整理:肿瘤资讯
来源:肿瘤资讯
导 语
本期要点
AML是最常见且死亡率最高的白血病类型,多发于老年人群,生存率随年龄增长显著下降,传统化疗存在局限性。
新一代测序技术推动AML治疗从“一刀切”化疗迈入基于基因组学的精准治疗时代,靶向治疗显著降低患者死亡风险。
IDH1/2突变是AML关键驱动突变,其通过异常代谢产物调控基因甲基化促进疾病发生,突变率随年龄增加,且对预后的影响存在亚型差异。
KMT2A重排、NPM1突变通过调控HOXA9/MEIS1轴驱动AML发生,Menin抑制剂为相关亚型患者提供了新的治疗方向。
NPM1突变AML的风险分层需整合多基因共突变及染色体特征,随机生存森林(RSF)模型展现出更优的预后评估效能。
未来AML治疗需扩大基因检测覆盖面,探索多靶点联合、靶向与化疗联合等创新模式,进一步优化患者预后。
▲ 点击观看视频
AML疾病特征与治疗范式革新:从传统化疗到精准靶向
白血病是由具有自我更新和克隆能力的造血干细胞和祖细胞中的体细胞序贯突变而发展的恶性血液肿瘤[1]。其中,AML是最常见且死亡率最高的白血病类型,其发病机制涉及初始突变(如DNMT3A、TET2、IDH1/2等)与后续突变(如FLT3-ITD、JAK2、NPM1、NRAS等)的累积,进而介导白血病前造血干细胞和克隆造血细胞自我更新增强以及白血病干细胞增殖分化受损,最终导致AML的形成。AML具有显著的年龄相关性特征——中位诊断年龄为69岁,整体AML患者的5年相对生存率仅为32.9%(2015-2021年),且生存率随年龄增加显著下降,75岁以上患者的5年相对生存率低至5.4%(图1)[2]。
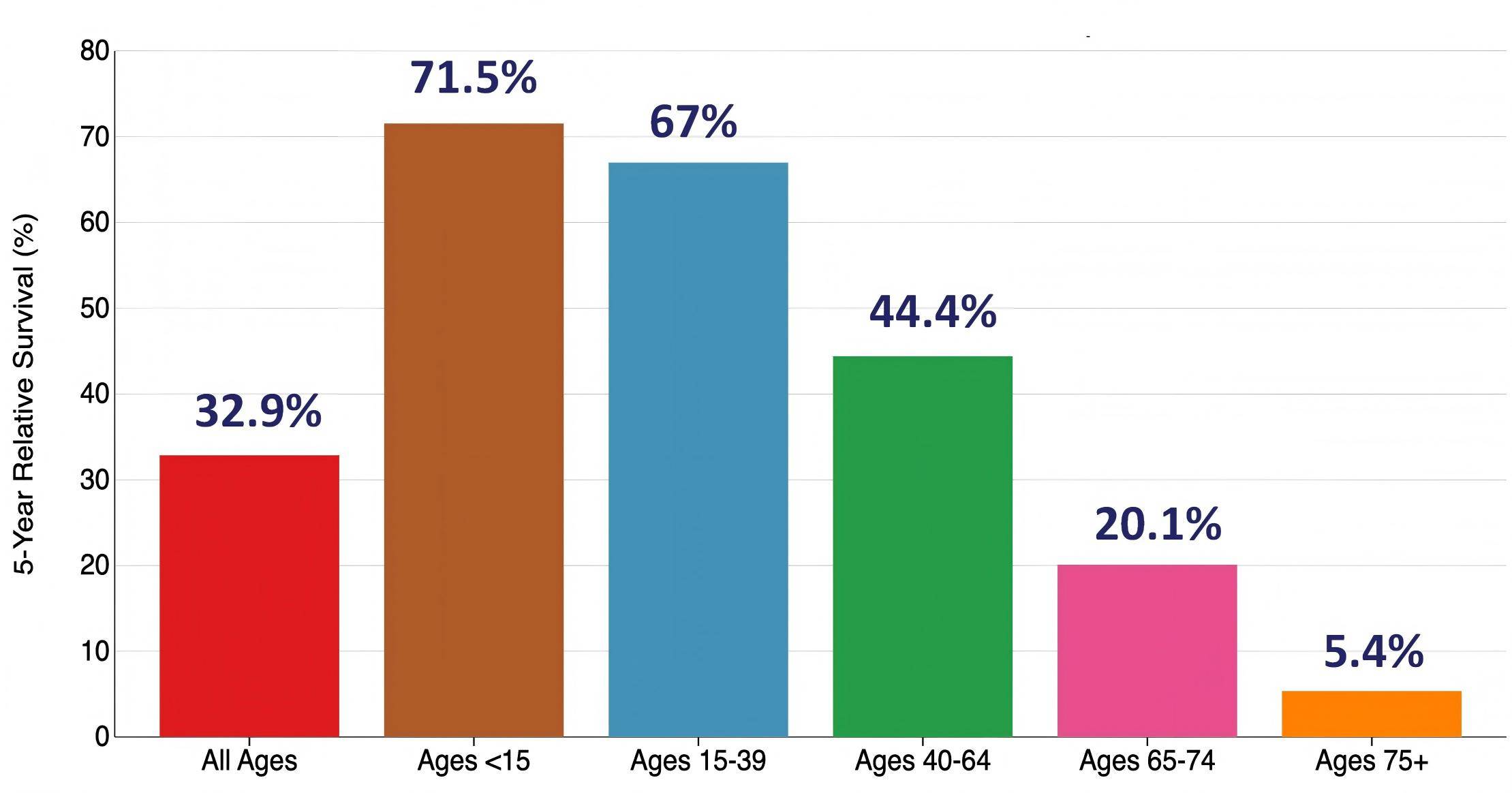
图1. 2015~2021年,AML根据年龄划分的5年相对生存率
在过去50年中,AML的标准治疗以化疗±造血干细胞移植为主,1970年代兴起的“7+3方案”(阿糖胞苷联合蒽环类药物)成为经典强化诱导方案[3]。但由于对AML的异质性和病因认识不足,传统治疗依赖广泛的细胞毒性疗法,相当比例的患者因不耐受强化化疗或异基因造血干细胞移植(allo-HSCT),导致生存预后较差。
近十年,随着新一代测序等研究工具的普及,AML治疗迎来关键转折,从“一刀切”的化疗模式迈向基于基因组学的精准治疗[4]。一项多中心、前瞻性、观察性队列研究,按照诊断年份将髓系肿瘤患者分为组1(2013-2016,诸多新疗法出现前)和组2(2017-2022, 诸多新疗法出现后)[5]。数据显示,组2患者的中位生存期达到16.0个月,显著优于组1的11.0个月(图2)。
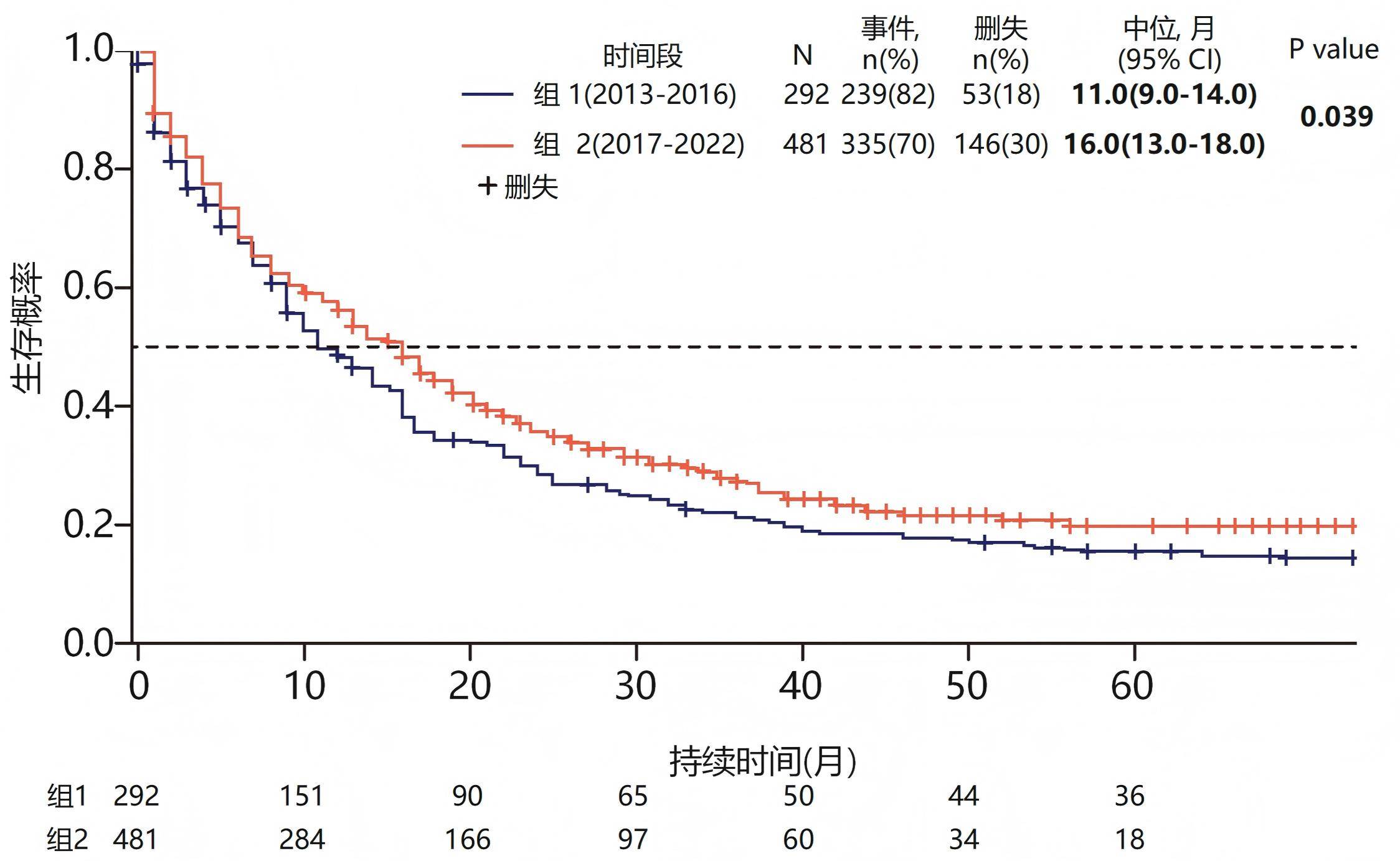
图2. 标准治疗时代 vs 新药时期的中位生存期
更重要的是,一项真实世界研究显示,靶向治疗的应用显著降低了AML患者死亡风险[6]:就所有突变分析,接受靶向治疗的患者第1个月死亡风险降低94%,第8个月降低27%;针对单个突变,接受靶向治疗的IDH1突变患者12个月内死亡风险降低85.1%,IDH2突变患者降低66.3%,FLT3突变患者第1个月降低96%,第7个月降低28%(图3)。
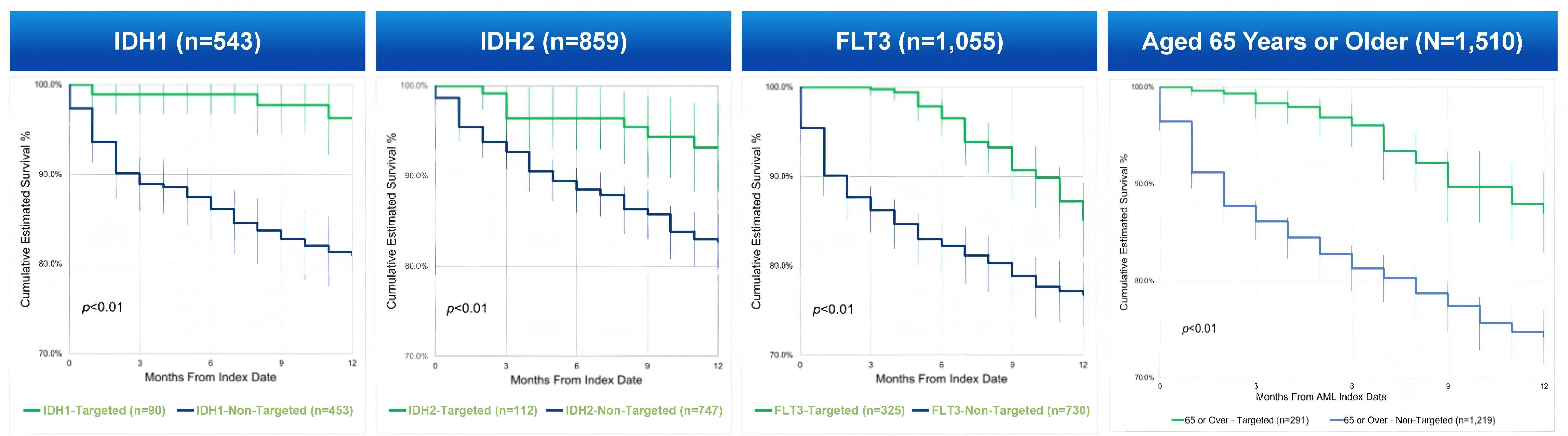
图3. 真实世界数据提示,靶向治疗的加入可降低AML患者的死亡风险
IDH突变:代谢重编程驱动的精准治疗靶点
异柠檬酸脱氢酶(IDH)是三羧酸循环中的关键代谢酶,哺乳动物组织中存在IDH1、IDH2和IDH3三种类型,其中IDH1和IDH2突变与AML的发生发展密切相关,而IDH3突变较为罕见[7-10]。IDH突变驱动AML的核心机制在于:编码IDH的基因突变后,IDH突变体将α-酮戊二酸(α-KG)异常催化生成D-2-羟基戊二酸(D-2HG)。由于2-HG与α-KG结构相似,可竞争性抑制α-KG依赖性酶(包括羟基化酶、组蛋白甲基化酶、DNA甲基化酶等),导致DNA和组蛋白高度甲基化,进而阻断原始细胞分化并促进其无节制增殖,最终导致AML发生(图4)[11-13]。
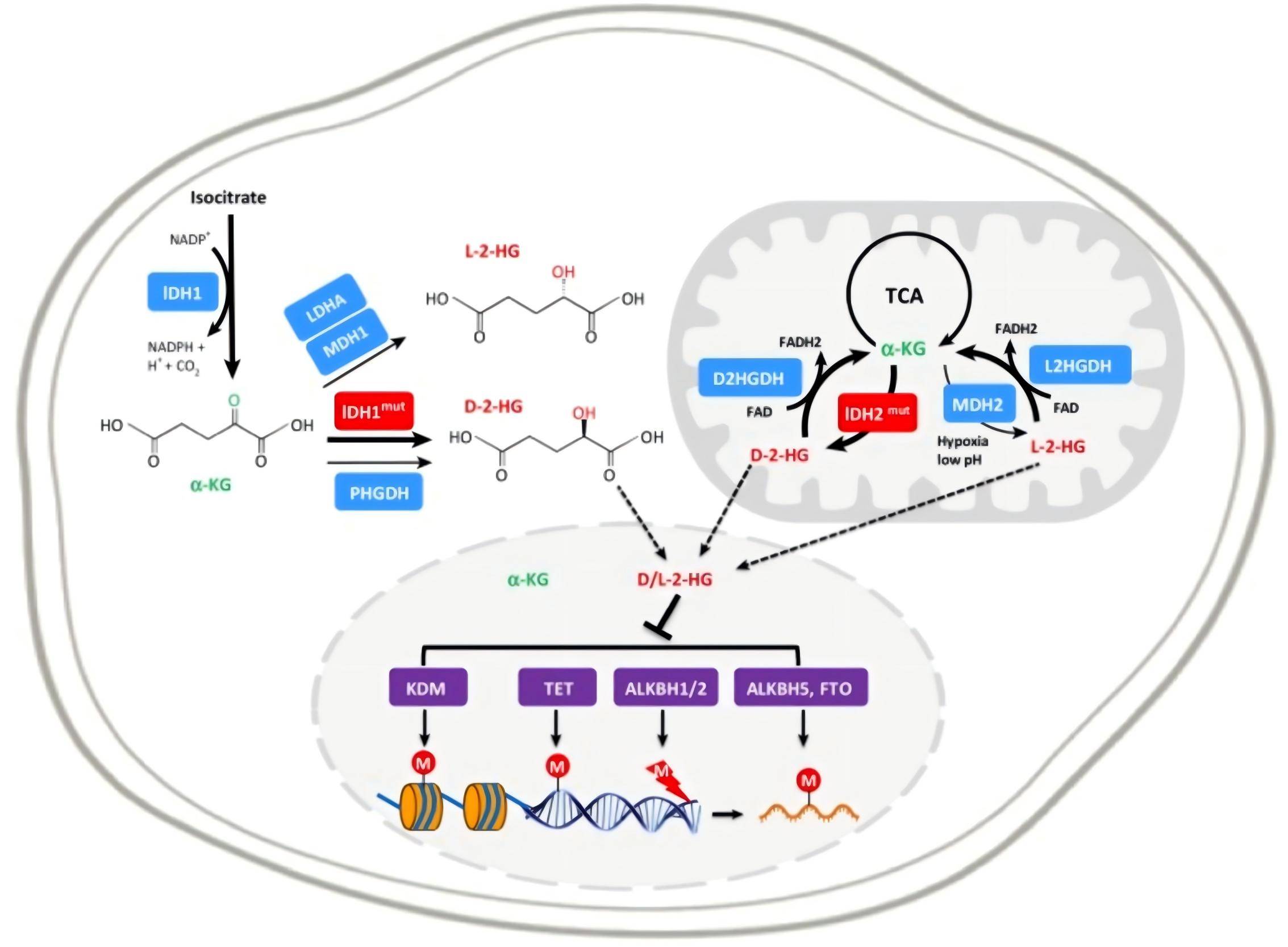
图4. IDH突变导致2-HG升高促进AML发生
流行病学数据显示,AML中IDH1突变(IDH1mut)发生率为3%-20%,低于IDH2突变(IDH2mut)发生率[14-15],中国IDH1mut发生率为2%-16%[16-19]。值得注意的是,既往研究表明IDH突变率随年龄增长呈上升趋势:儿童(0-17岁)中为3.4%,年轻人(18-39 岁)中为11.3%,中年人(40-59岁)中为17.7%,≥60岁老年人群中高达21%(图5)[14]。
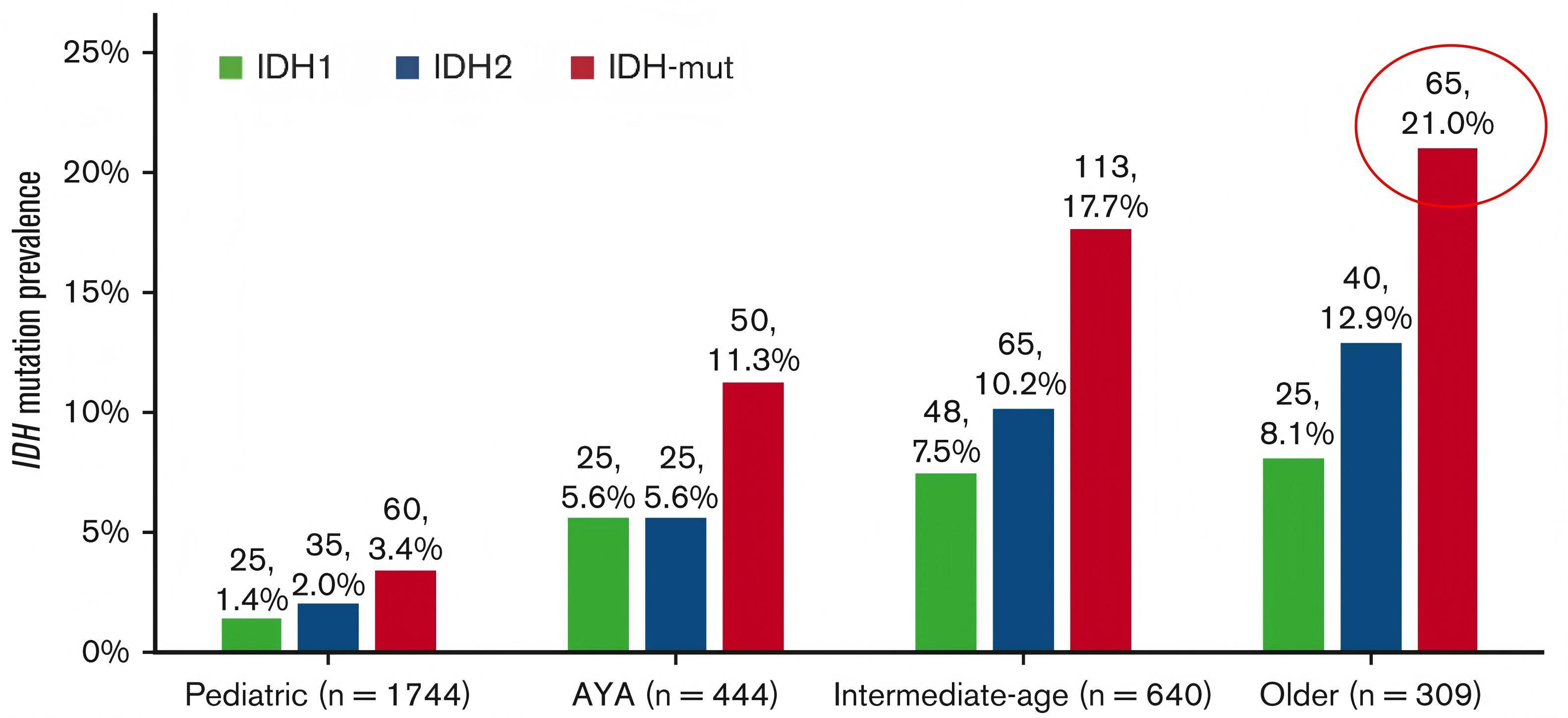
图5. AML患者中IDH突变率随年龄增加
关于IDH1mut对AML预后的影响尚存争议,其核心影响因素包括患者年龄、共突变状态(如NPM1、DNMT3A、FLT3-ITD)、特定突变亚型、IDH1/2共分析及研究设计差异[20-27]。其中,DNMT3A和FLT3-ITD共突变会产生负面预后影响,而NPM1突变则具有有利影响。研究表明,AML中IDH1mut与IDH2mut的预后意义存在显著差异:IDH1&2组合分析时,突变不影响总生存期(OS)和无事件生存期(EFS);而IDH1突变单独分析时,OS和EFS更差[28]。2024年一项涵盖20项研究、6561例患者的Meta分析显示[29],IDH1mut患者OS风险比(HR)为1.62,EFS HR为1.71,而IDH2mut患者的OS HR和EFS HR分别为1.07和0.93(图6),提示IDH1mut对预后有不良影响。
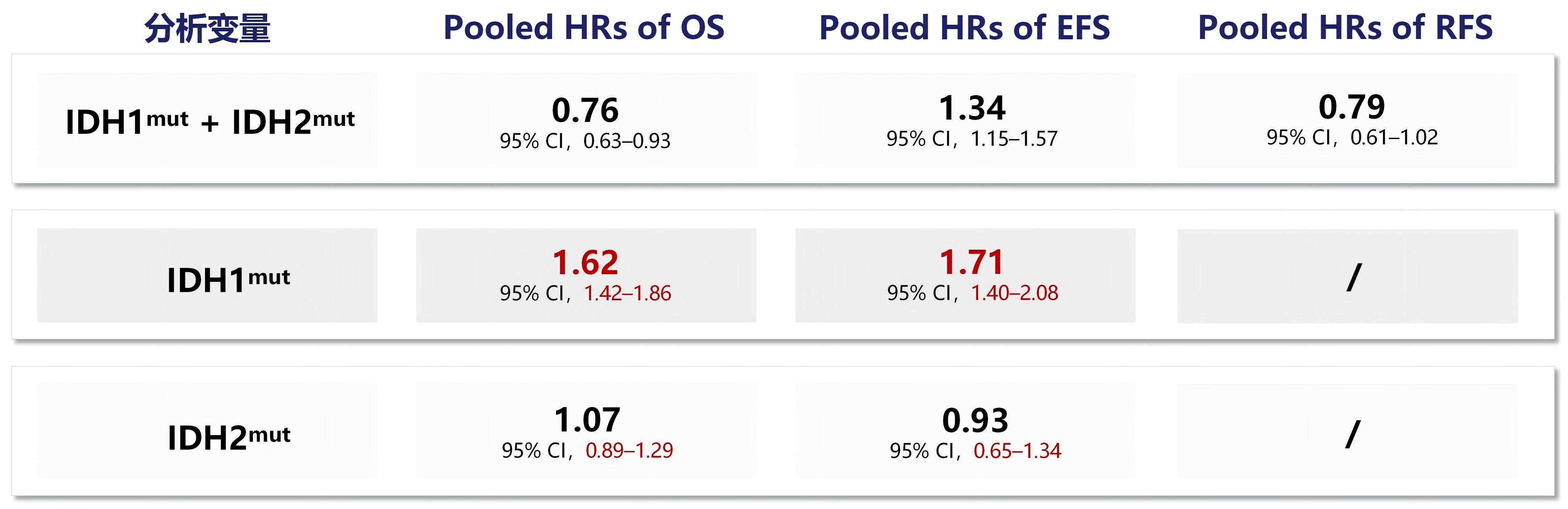
图6. IDH1&2组合分析与单独分析时的OS HR、EFS HR
KMT2A重排/NPM1突变:HOX/MEIS1轴调控与Menin抑制剂靶向突破
HOXA9/MEIS1高表达是KMT2A重排和NPM1突变AML的致病核心机制。HOXA9作为同源框蛋白家族成员,在超过50%的AML及部分淋巴细胞白血病中过度表达,且常与MEIS1、PBX3共同高水平表达[30],在造血调控和白血病发生中发挥关键作用。携带KMT2A重排、NPM1突变及NUP98重排的AML约占新诊断病例的30%~40%,这些基因异常在疾病复发时通常持续存在,成为重要的治疗靶点[31]。
Menin抑制剂的出现为这类AML患者提供了新的治疗策略。其作用机制在于:通过阻断Menin与KMT2A融合蛋白的结合,破坏该染色质复合体,抑制异常致白血病转录程序;在NPM1突变AML中,Menin抑制剂可逆转HOX基因及其共因子MEIS1介导的异常基因表达,诱导白血病细胞分化和凋亡,同时对其他异常基因表达被破坏的白血病基因型也可能具有敏感性(图7)[32]。
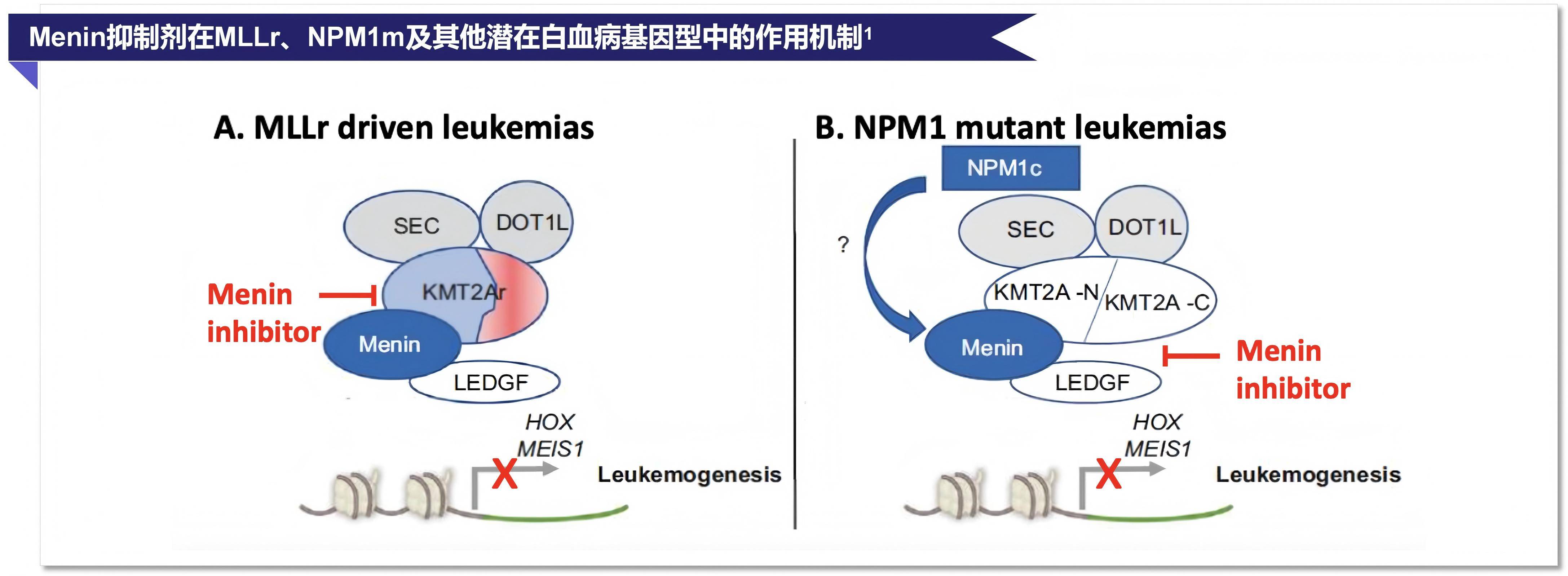
图7. Menin抑制剂在MLLr、NPM1m及其他潜在白血病基因型中的作用机制
一项真实世界研究纳入了1996年至2024年在多个国家流行病学登记库录入的417例成人KMT2A重排AML患者,并分析其临床特征、治疗模式及生存预后[33]。数据显示,最常见的重排类型为t(9;11)(占30%),其次为t(11;19)(13%)、t(10;11)(8%)、t(4;11)(4%),其余或未明确的v-11q23重排占41%。KMT2A重排AML成人患者的预后较差:中位OS仅12.1个月,4年OS率仅24%。值得关注的是,即使进入2012-2024年的治疗新时期,其中位OS仅为13.1个月,与1996-2011年传统治疗阶段的11.9个月相比无显著改善(图8),表明KMT2A重排AML患者至今仍缺乏突破性的有效治疗手段,临床亟需全新的治疗策略来改善预后。
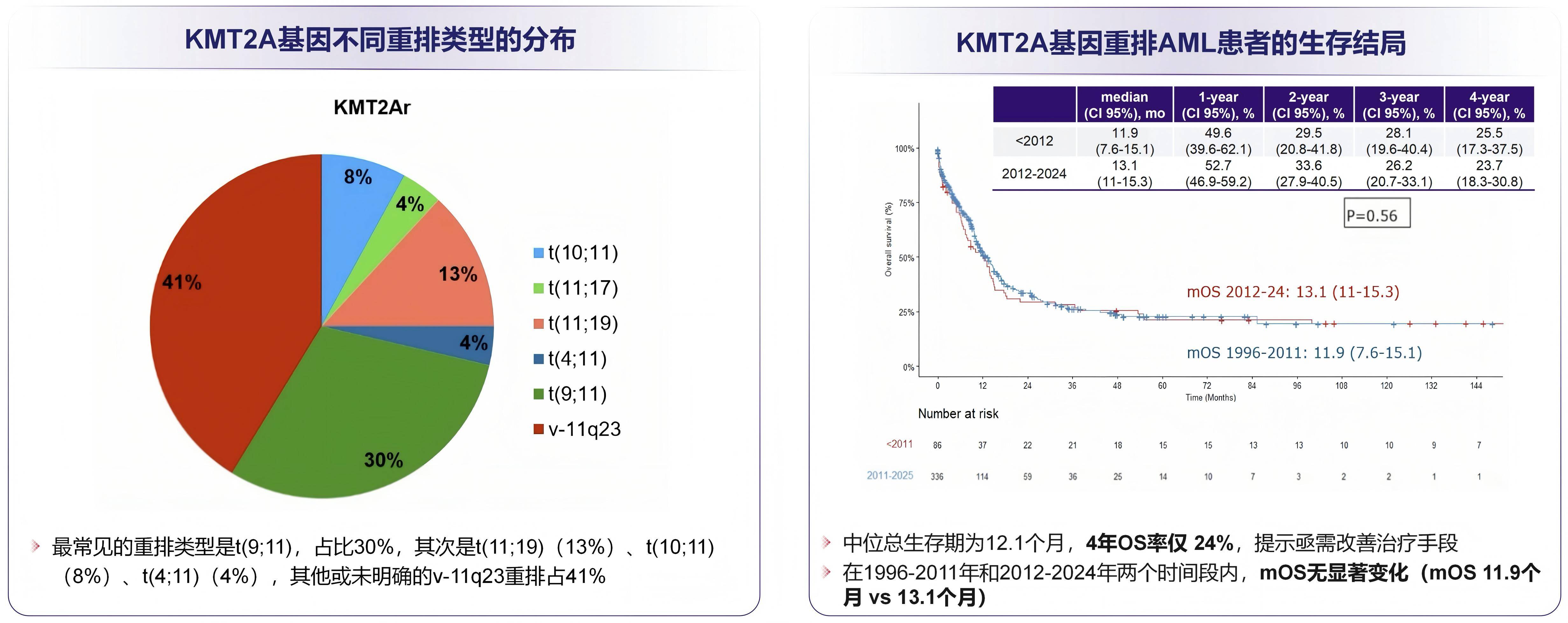
图8. KMT2A重排的AML成年患者的真实世界结局
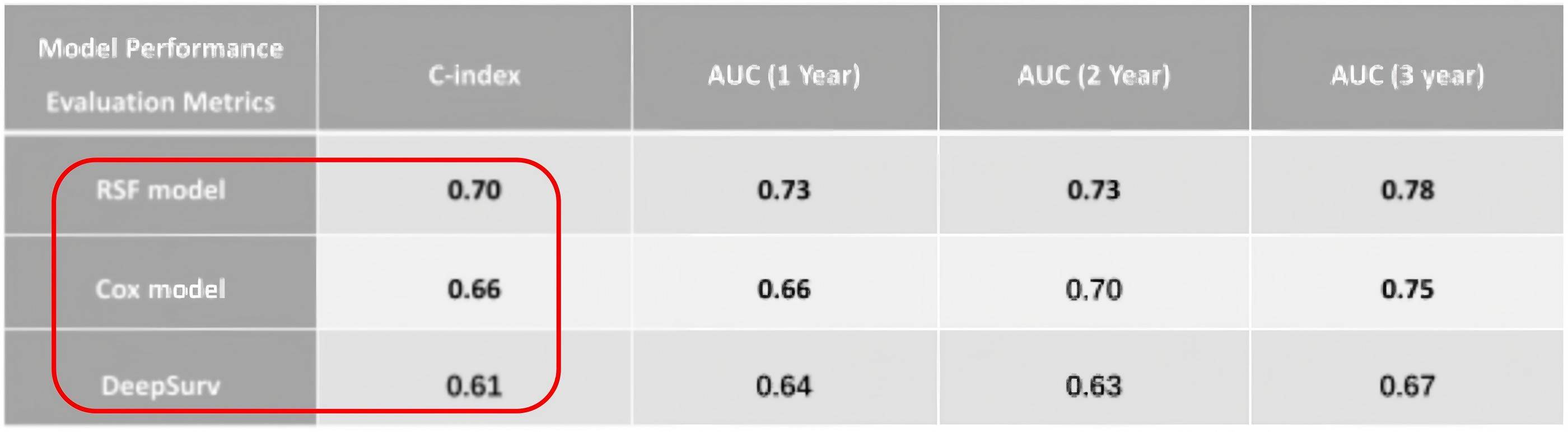
对于NPM1突变AML的风险分层,传统ELN 2022标准仅依据是否伴FLT3-ITD突变进行评估,未纳入不良细胞遗传学畸变及其他共突变的相互作用,存在一定局限性。为此,浙江大学医学院附属第一医院王华锋教授团队提出了一种随机生存森林(RSF)预后模型[34]。该模型整合了FLT3-ITD、TET2、DNMT3A、IDH1/2等9种突变基因,以及染色体特征、融合基因,显著提升了患者风险分层的准确性。性能评估显示,RSF模型的平均C-index为0.70,显著优于传统Cox回归(0.66)与DeepSurv神经网络(0.61),其1年、2年、3年AUC值分别达到0.73、0.73、0.78(表1),为NPM1突变AML患者的精准预后评估提供了更可靠的工具。
表1. RSF模型性能评估
王华锋 教授
浙江大学医学院附属第一医院血液科,副教授,副主任医师,博士生导师,特聘研究员
中国临床肿瘤学会(CSCO)白血病专家委员会常务委员
第十二届中华医学会血液学分会白血病学组委员
中国女医师协会靶向专业委员会委员
中国抗癌协会血液病转化委员会青年委员
浙江省医师协会血液学分会青委副主任委员兼秘书
浙江省领军型创新创业团队成员
浙江省卫生高层次人才
美国City of Hope国家医学中心博士后
美国布朗大学以及英国Royal Free Hospital访问学者
主持多项国家自然科学基金、省部级重点课题
以第一作者或通讯作者发表20余篇,分别发表在Lancet Haematol、Adv Sci、Leukemia、Am J Hematol、Blood Cancer J等期刊,国际会议口头报告多次,获得6次美国血液学年会ASH Abstract Achievement Award
参考文献
[1]Blood (2022) 140 (12): 1345–1377.
[2]SEER Cancer Stat
[3]Forsberg M, et al. Trends Pharmacol Sci. 2024
[4]Senapati J, et al. Cancer. 2025
[5]2023 ASH, Oral 593
[6]ASH annual meeting, poster 4238
[7]InTech; 2013. Available from: http://dx.doi.org/10.5772/52357
[8]Cancer Cell. 2010 Mar 16;17(3):215-6
[9]Trends Mol Med. 2010 Sep;16(9):387-97
[10]J Cancer. 2017 Aug 22;8(14):2704-2712
[11]Blood. 2011 May 26; 117(21): e198–e206
[12]Trends Cancer. 2018 Feb;4(2):151-165
[13]Biomedicines. 2022 Jun; 10(6): 1359
[14]Blood Adv (2023) 7 (19): 5941–5953
[15]Leukemia. 2024 May;38(5):927-935
[16]中华血液学杂志,2011,32(09) : 610-610
[17]中华医学杂志,2013,93(10) : 751-751
[18]中华血液学杂志,2021,42(01) : 39-39
[19]Ann Hematol. 2012 Apr;91(4):519-25
[20]Haematologica. 2010;95(10):1668—1674
[21]Leukemia. 2016;30(4):980-984
[22]Leukemia. 2017;31(2):272-281
[23]PLoS ONE. 2014;9(6):e100206
[24]Blood Adv. 2023 Oct 10;7(19):5941-5953
[25]Blood. 2021;137(20):2827-2837
[26]Blood Adv. 2022;6(5):1394-1405.
[27]Am J Hematol. 2015 Aug; 90(8): 732–736
[28]Clin Cancer Res (2017) 23 (15): 4511–4522
[29]Medicine (Baltimore). 2024 Dec 6;103(49):e40565
[30]Curr Opin Hematol. 2016 Jul;23(4):354–361
[31]Senapati J, et al. Cancer. 2025
[32]BioNova,Discovery of A Novel Menin-MLL Inhibitor for Potential Treatment of MLLr Leukemias and NPM1c AML. AACR, 2022
[33]2025 EHA s147
[34]2025 ASH. PS 6134
免责声明:本资料的内容仅作为科学信息参考,仅用于医疗卫生专业人士的学术交流,请勿用于任何其他用途。若您不是医疗卫生专业人士,请勿观看和/或传播此资料。
本资料可能会出现某些药品信息,但该药品/适应症可能尚未获得国家药品监督管理局的注册批准。医疗卫生专业人士做出的任何与治疗有关的决定应根据患者的具体情况并应参照国家药品监督管理局批准的药品说明书。对于本资料可能提到的相关诊断、治疗方法,请遵守国家卫生健康委员会以及相关部门批准使用的指南或规定。
审批编号:M-TIBSO-CN-202601-00006
排版编辑:Fu
责任编辑:Mathilda
版权归肿瘤资讯所有。欢迎个人转发分享,其他任何媒体、网站如需转载或引用本网版权所有内容,须获得授权,且在醒目位置处注明“转自:良医汇-肿瘤医生APP”。












 苏公网安备32059002004080号
苏公网安备32059002004080号


