在非小细胞肺癌(NSCLC)的诊疗版图中,IV期患者的长期生存一直是临床攻坚的难点。尽管免疫治疗(IO)时代的到来显著改善了患者预后,但对于伴有脑转移、特定驱动基因突变(如KRAS)以及涉及多学科综合治疗(如放疗联合免疫)的复杂病例,如何制定最优化的治疗策略仍考验着临床医生的智慧。尤其是在免疫联合放疗的场景下,如何在追求增效的同时规避间质性肺炎等不良反应,选择基石药物至关重要。
本期浙江省人民医院放疗科张海菠教授将分享一例真实病例,并特邀浙江省人民医院放疗科梁晓东教授进行点评。该病例确诊为IV期肺腺癌,伴有KRAS突变及脑转移,通过手术、放疗、化疗及舒格利单抗免疫维持治疗的综合排兵布阵,实现了显著的肿瘤退缩与长期生存。
副主任医师 医学博士 博士生导师 主任助理
浙江省省级青年人才
中国抗癌协会肿瘤营养专业委员会中西医结合营养专家协作委员
浙江省医师协会肿瘤医师分会青年委员
浙江省医学会放射肿瘤治疗学委员会青年委员
浙江省数理医学学会肿瘤粒子与营养智能诊疗专业委员会委员
浙江省数理医学会肿瘤支持治疗委员会青年委员
浙江省健康服务业促进会放射治疗专业委员会青年委员
国家自然科学基金评审专家
浙江医药卫生科技计划项目评审验收专家
主持国家自然科学基金2项,省自然科学基金和浙江省医药卫生科技计划等课题4项,以第一或者通讯作者在Journal of advanced research、Cell Death & Differentiation、Oncogene等期刊发表SCI论文20余篇,累计影响因子>100,发明专利3项,实用新型专利3项
病例介绍
基本信息及主诉
患者,男性,66岁。因“头痛伴右侧肢体无力2月余” 2023.2.5入院。
一般状况:PS评分 1分,NRS评分 1分。
现病史:
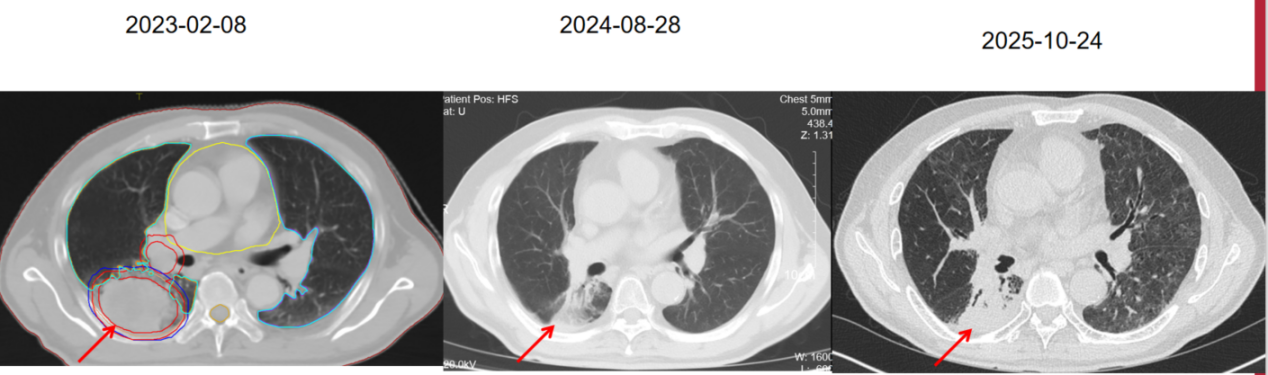
患者2月余前无明显诱因下出现双眼视物模糊,头痛伴右侧肢体无力,无眩晕,无恶心呕吐,遂至当地医院就诊,完善胸部CT(2023-01-15)提示:右肺下叶背段肿块,大小约60*40mm,内密度不均,边缘毛刺。
头颅MR(2023-01-15)检查提示:左枕叶混杂信号肿块,边界较清,大小约23.6mm*32.9mm*29.5mm,增强后环形强化,周围脑组织水肿,左侧脑室受压,中线结构右移。
排除手术禁忌后于2023-01-16在全麻下行“开颅左枕叶肿瘤切除术”,手术过程顺利,术后予以止痛、止吐、营养支持等治疗,2023-01-18术后病理提示:(左枕)转移性癌,结合肺占位病史及免疫组化,符合多型性癌(腺癌混合巨细胞癌),符合肺起源。
免疫组化结果:CK(AE1/AE3)+,TTF-1+,CK5/6-,NapsinA+,P40个别散在阳性,Syn-,CgA-,Ki-67 40%,BRG1+(存在),INI-1+(存在),PAX-8-,CDX2-,SALL4-,ERG-,CD31-。2023-02-02完善PET/CT检查提示:1.右肺下叶肿块代谢异常增高,考虑肺癌;右肺门淋巴结糖代谢异常增高,考虑炎性可能,转移不除外;两肺肺气肿;两侧胸膜增厚;两肺散在纤维增殖灶。2.左枕叶病损切除术后改变,术区未见明显糖代谢异常增殖灶。3.右肾小结石,前列腺增生伴钙化。完善基因检测提示基因检测示Kras突变,PD-L1高表达。
本院就诊,肺部病灶穿刺, (2023-02-14)行常规组织病理检查与诊断【肺肿块穿刺】检查提示:“肺肿块穿刺”非小细胞肺癌,待免疫组化标记明确组织学类型。(2023-2-9);二次补充报告:“肺肿块穿刺”非小细胞肺癌,结合免疫组化结果,支持肺腺癌。免疫组化染色结果:A2-1:P63(局灶+)、P40(灶+)、TTF-1(弥漫+)、NapsinA(弥漫+)、CK7(+)、Ki67(+约30%)、CK(Pan)(+)。PD-L1检测平台:Dako Autostainer Link 48,检测试剂:Dako 22C3;\X0B\PD-L1阴性对照(NC) (-);阳性对照(PC)(+);\X0B\PD-L1肿瘤细胞阳性比例(TPS):TPS≥50%;肿瘤比例评分(TPS):TPS=约70%。
既往史
既往体健,无饮酒史,无吸烟史。
症状体征:
PS评分1分,神志清,精神可,头颅术后改变,手术切口愈合良好,皮肤巩膜无黄染,双侧腋窝、锁骨上及颈部浅表淋巴结未及明显肿大,心肺听诊无特殊,腹软,无压痛,肝脾肋下未及肿大,移浊(-)。双下肢无明显水肿。病理征(-)。
诊断:
初步诊断:肺恶性肿瘤(腺癌 ,cT3N1M1 ,IV期, KRAS突变,PDL1 TPS=约70% );脑继发恶性肿瘤。
诊疗经过
2023-02-09始行胸部病灶放疗,处方剂量: PTV-boost 6MV-X,DT 5400cGy/25fx/5w, PTV 6MV-X,DT 5000cGy/25fx/5w。二程肿瘤中心区域局部加量:PTVboost 6MV-X,DT 1000cGy/2fx/1w。
2023-03-24开始行脑转移瘤术后辅助放疗,处方剂量:PTV 6MV-X,DT 2500cGy/5fx/1w,CTV 6MV-X,DT 3000cGy/5fx/1w。
2023-02-10开始行培美曲塞875mg d1+卡铂 540mg d1 q4w同步化疗2周期, 2023.04.24、2023.05.15日培美曲塞+卡铂 +免疫治疗2周期。
后续舒格利单抗 1200mg d1 q3W免疫治疗维持至今。疗效评价PR。颅脑MRI未见肿瘤复发进展。
医学博士 主任医师 硕导
肿瘤中心放疗科副主任
《中华肿瘤防治杂志》编委
浙江省抗癌协会肿瘤放疗专委会常务委员
浙江省医师协会放疗分会委员
浙江省肿瘤防治联盟肺癌专委会委员
浙江省抗癌协会抗癌药物专委会委员
江苏省、海南省科技厅重点项目评审专家
广西科技奖励评审专家
Molecular Therapy-Oncolytics等杂志审稿专家
专家点评
本病例为伴脑转移分期为cT3N1M1(IV期)寡转移非小细胞肺癌患者,分子特征为KRAS突变伴PD-L1高表达。患者的病理类型包含多形性癌成分,这类肿瘤通常恶性程度高、进展快;且患者初治时即有脑转移,以急性脑部症状就诊,治疗具有一定挑战性。然而,该患者通过“手术+放化疗+免疫治疗”的综合治疗模式,并以疗效确切且不良反应小的舒格利单抗进行长期维持治疗,已经实现了超过30个月的无进展生存期。
首先,该患者以急性脑部症状发病就诊,脑转移瘤手术治疗迅速缓解症状功不可没,为后续综合治疗创造了有利条件。
其次,寡转移患者的治疗应以长期生存,乃至治愈为目的,局部根治性放疗和全身系统治疗有机结合必不可少。该患者肺癌胸腔内分期为T3N1,且脑转移瘤术后恢复可,当时PS评分为1分,根治性同步放化疗是合适的选择。放疗与免疫治疗具有明确的协同效应,放疗可通过诱导肿瘤细胞凋亡、释放抗原、激活抗原提呈细胞,将“免疫沙漠”型的肿瘤微环境重塑为炎性浸润型的肿瘤微环境等机制增强免疫治疗的疗效[1]。而单次剂量≥5Gy的大分割放疗有更强的免疫刺激作用,该患者在常规分割放化疗后采用了5Gy*2次的补量放疗,以期与后续免疫治疗形成更好的协同效应。
再次,本例患者采用疗效确切、低毒性的舒格利单抗作为维持治疗,也为患者的长生存提供了有力保证。GEMSTONE-302研究数据显示,无论PD-L1表达状态如何,舒格利单抗联合化疗均能带来显著的PFS和OS获益;PD-L1≥50%亚组的获益更为显著,中位OS长达39.2个月(对照组19.8个月,HR 0.58)[2]。特别值得一提的是,针对临床难治的脑转移人群,GEMSTONE-302研究显示舒格利单抗联合化疗展现了卓越的疗效:基线伴脑转移患者的中位PFS达8.9个月(HR 0.29),中位OS长达26.0个月(显著优于化疗组的9.0个月),4年OS率达36.4%;同时,该方案在控制现有病灶的基础上,还能显著降低72%的新发脑转移风险[3-5]。这对于像本例这样初诊即伴有脑转移的患者而言,舒格利单抗不仅能强效控制现有的全身及颅内病灶,更能有效遏制脑部新发病灶的出现,从而实现对颅内病情的“全面封锁”。再结合本例患者PD-L1 TPS高达70%,属于免疫治疗的优势人群,理应把长生存和治愈作为目标。
当然,胸部放疗联合免疫治疗时,需要尽可能减少肺炎的发生率。荟萃分析显示,PD-L1抑制剂的肺炎发生率显著低于PD-1抑制剂[6]。GEMSTONE-302研究中,舒格利单抗组≥3级免疫相关性肺炎发生率仅为0.9%[2],而GEMSTONE-301研究中,根治性放化疗后采用舒格利单抗巩固治疗,≥3级肺炎的发生率也仅3%[7]。本例患者接受了肺癌根治剂量放疗,选择安全性更优的PD-L1抑制剂舒格利单抗,有效规避了严重的肺毒性,从而取得了安全可靠的疗效。
综上所述,寡转移非小细胞肺癌的治疗应以长期生存乃至治愈为目标。为实现这一目标,需要局部治疗(手术/放疗)和系统治疗(化疗/免疫治疗/靶向治疗)有机结合。在放疗与免疫治疗相结合时,需要同时关注疗效和不良反应,尽可能选择舒格利单抗这样有确切疗效且毒性低的药物,为患者高生活质量的长生存提供有力保障。
[1] Herrera FG, Bourhis J, Coukos G. Radiotherapy combination opportunities leveraging immunity for the next oncology practice. CA Cancer J Clin. 2017 Jan;67(1):65-85. doi: 10.3322/caac.21358.
[2] Zhou C, et al. Sugemalimab versus placebo, in combination with platinum-based chemotherapy, as first-line treatment of metastatic non-small-cell lung cancer (GEMSTONE-302): a pooled analysis of two randomised phase 3 trials. Nat Cancer. 2023 Jun;4(6)860-871.
[3] Caicun Zhou, et al. Lancet Oncol .2022 Feb;23(2):220-233.&supplement.
[4] Zhou C, et al. Lancet Oncol. 2025 Jul;26(7):887-897.&supplement.
[5] Zhou CC, et al. Poster 1318P. 2024 ESMO. September 14.
[6] Khunger M, et al. Incidence of Pneumonitis With Use of PD-1 and PD-L1 Inhibitors in Non-Small Cell Lung Cancer: A Systematic Review and Meta-Analysis of Trials. Chest. 2017;152(2):271-281.
[7] Zhou Q, et al. Sugemalimab versus placebo after concurrent or sequential chemoradiotherapy in patients with locally advanced, unresectable, stage III non-small-cell lung cancer in China (GEMSTONE-301): interim results of a randomised, double-blind, multicentre, phase 3 trial. Lancet Oncol. 2022 Feb;23(2):209-219. doi: 10.1016/S1470-2045(21)00630-6.
排版编辑:肿瘤资讯-htt











 苏公网安备32059002004080号
苏公网安备32059002004080号


