引用本文:结直肠早癌全程管理指南制定工作组, 中华医学会外科学分会结直肠外科学组, 广东省医院协会结直肠外科专委会 . 早期结直肠癌全程管理指南(2025 版)[J]. 中华胃肠外科杂志, 2025, 28(12): 1351-1368. DOI: 10.3760/cma.j.cn441530-20251012-00378.
作者:结直肠早癌全程管理指南制定工作组 中华医学会外科学分会结直肠外科学组 广东省医院协会结直肠外科专委会
通信作者:何晓生,中山大学附属第六医院,广州 510655,Email:hexsheng@mail.sysu.edu.cn;兰平,中山大学附属第六医院,广州 510655 ,Email:lanping@mail.sysu.edu.cn;张忠涛,首都医科大学附属北京友谊医院,北京 100050,Email:zhangzht@ccmu.edu.cn
摘要
结直肠癌是中国高发恶性肿瘤之一,严重威胁居民生命健康。目前,我国较低的早期诊断率及早期治疗率,成为限制进一步改善结直肠癌患者预后的瓶颈。对早期结直肠癌进行标准化的 全程管理,将促进中国早期结直肠癌诊治的同质性和规范性,提高结直肠癌患者的预后。在中华医学会外科学分会结直肠外科学组和广东省医院协会结直肠外科专委会牵头下,由中山大学附属第六医院组织涵盖外科学、内镜学、病理学、影像科、流行病学、循证医学、卫生经济学和卫生管理学等学科的专家成立指南制订专家组,基于世界卫生组织推荐的指南制定原则和方法,采取临床问卷调查及专家讨论的形式,经过证据检索和评价,制订了《早期结直肠癌全程管理指南(2025版)》。本指南涉及早期结直肠癌的筛查、诊断、治疗和随访等临床问题,并按照循证指南制订的方法整理出了33条相关的推荐意见,旨在构建覆盖全生命周期的规范化管理路径,提升早期结直肠癌的早诊率、治愈率和生活质量,助力“健康中国2030”战略目标。
结直肠癌(colorectal cancer,CRC)是中国高发 恶性肿瘤之一,疾病负担沉重。《中国结直肠癌筛查与早诊早治指南(2020)》 [ 1 ] 及《结直肠癌筛查与早诊早治方案(2024年版)》 [ 2 ] 已为早期筛查提供了科学依据,但针对早期病变的全程管理(包括筛查、诊断、治疗、随访)仍需系统化整合。本指南旨在构建覆盖全生命周期的规范化管理路径,提升早期CRC的早诊率、治愈率和生存质量,助力“健康中国2030”战略目标。
1.指南发起和支持单位:本指南制定由中华医 学会外科学分会结直肠外科学组、广东省医院协会结直肠外科专委会发起和制订,由中山大学附属第六医院具体组织实施。指南制订启动时间为 2025年1月10日。
2. 指南工作组:本指南成立了多学科工作组, 工作组成员主要涵盖外科学、内镜学、病理学、影像科、流行病学、循证医学、卫生经济学和卫生管理学等学科专家。证据的检索和评价由国家癌症中心、中山大学附属第六医院、首都医科大学附属北京友谊医院和中山大学肿瘤防治中心合作完成。全体成员签署利益冲突声明,均声明不存在与本指南直 接的经济利益冲突。
3. 指南制订的整体设计与实施:参照《世界卫 生组织指南制订手册》、《临床诊疗指南的基本方法与程序》及中华医学会发布的《制订/修订<临床诊疗指南>的基本方法及程序》来制订 [ 3-4 ] ;参考指南 评价工具(AGREEⅡ) [ 5 ] 和卫生保健实践指南的报 告条目(RIGHT) [ 6 ] 制订指南计划书(https://www.guidelines-registry.cn)和正式指南文件。本指南已 在国际实践指南注册平台注册(PREPARE2025CN194)。
4. 指南制订的目的和目标人群:目前,我国仍 缺乏基于循证医学证据的早期 CRC 全程管理指南,为规范和优化早期 CRC的临床实践及管理,进一步改善早期 CRC 患者的生存和预后,我们联合外科学、消化内科学、内镜学、病理学、影像学、临床检验学、流行病学、循证医学、卫生经济学和卫生管理学等多学科专家,成立早期 CRC 全程管理指南制定专家组,基于世界卫生组织推荐的指南制定原则和方法,制订了本指南,以期为我国早期 CRC的 规范开展提供参考,提升我国早期CRC防控效果。
共识面向的目标人群为从事早期 CRC 诊治的基层卫生服务人员、内镜医师、病理医师、影像医师和内外科医师等,旨在确保以上医务工作者掌握早 期CRC诊治的流程及原则以及技术标准。
5. 临床问题的遴选和确定:通过系统检索 CRC 筛查领域已发表的指南和系统综述,以及对早期 CRC 领域部分专家的访谈(中山大学附属第六医院,2025 年 1 月 22 日和 3 月 15 日),工作组初步拟定了 5 大类的关键问题框架,涵盖 20 个临床问题。2025年 4月 19日在中山大学附属第六医院召开指南制订启动会,以线上线下结合的形式对临床问题的重要性进行调研和评分,收集汇总两轮专家函评反馈,最终遴选出本指南拟解决的 13个关键问题。
6. 证据的检索:指南制订工作组针对最终纳入的 关键临床问题,按照人群、干预、对照和结局(population,intervention,comparison and outcome,PICO)原则对其进行多源中文和英文数据库检索,具体检索数据库包括PubMed、Embase、Clinicaltrial.org、Cochrane Library、Web of Science、Google Scholar、中国知网、万方、维普和中国生物医学文献服务系 统。证据检索截止日期为2025年6月。
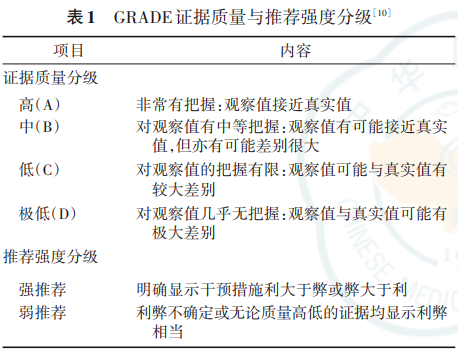
7.证据的评价与分级:证据检索与评价小组对 于纳入的随机对照试验研究采用 Cochrane Reviewer's Handbook 5.0.1标准进行评价 [ 7 ] ;对于纳 入的队列研究采用纽卡斯尔-渥太华量表(the Newcastle-Ottawa Scale)进行评价 [ 8 ] ;对于诊断准确性研究采用 QUADAS-2(Quality Assessment of Diagnostic Accuracy Studies)进行评价 [ 9 ] 。 评价过程由两人独立完成,若存在分歧,则共同讨论或咨询第三方解决。使用推荐意见分级的评估、制 订及评价(grading of recommendations assessment,development and evaluation,GRADE)方法 [ 10 ] 对证据 质量和推荐意见进行分级。
8.推荐意见的形成:基于证据评价小组提供的 国内外证据,同时考虑我国早期 CRC 目标人群的偏好和价值观、干预措施的成本和利弊后,初步拟定了早期 CRC 关键问题的推荐意见。于 2025 年7月 20日及 2025年 8月 23日进行了一轮德尔菲推荐意见调查和一轮面对面评议,共收集到 52 人次的专家意见反馈。于 2025 年 9 月至 10 月,执笔专家结合修改意见进一步完善推荐意见;在 2025 年10月 9日指南会议中,共收集 46位专家意见反馈,本指南的推荐意见赞成率达到 80% 以上即达成共 识,最终就所有推荐意见达成共识。
9. 指南的发布、传播与更新:指南发布后,指 南工作组将主要通过以下方式对指南进行传播和推广:(1)在“第十一届广州消化道疾病周”学术会议上对指南进行线上线下全国范围内宣讲;(2)在学术期刊和书籍出版社公开发表本指南;(3)通过媒体等进行推广。指南工作组将综合临床实践的需求与证据产生的进展,计划在 3 年内按照国际指南更新要求的方法,对本指南的推荐意见进行 更新。
推荐意见1:早期CRC定义为局限于结直肠黏膜层及黏膜下层的癌。(推荐强度:强推荐,证据质量:高,专家组投票赞同率:97.8%)
推荐说明
目前,中国多部指南及共识均提出,将局限于 结直肠黏膜层及黏膜下层的癌定义为早期CRC,其中局限于黏膜层的为黏膜内癌,浸润至黏膜下层、但未侵犯固有肌层者为黏膜下癌 [ 1,11-13 ] 根据美国癌症联合会(American Joint Committee on Cancer,AJCC)第8版对CRC的细化定义,早期CRC主要包括Tis期CRC及T1期CRC [ 14 ] 。
目前,国际主流指南对于早期 CRC 的定义如 下:美国国家综合癌症网络 (National Comprehensive Cancer Network,NCCN)指南认为,早期 CRC 是指 T1N0 期 CRC [ 15 ] 。 日本结直肠癌研 究学会(Japanese Society for Cancer of the Colon and Rectum,JSCCR)将早期 CRC 定义为当癌症侵袭结肠壁的深度停留在黏膜和黏膜下层,即 Tis~T1 期CRC [ 16 ] 。 欧洲医学肿瘤学会(European Society for Medical Oncology,ESMO)指南中认为,早期结肠癌是指 0 期及Ⅰ~Ⅲ期结肠癌 [ 17 ] ;而对于早期直肠癌无明确定义 [ 18 ] 。 而英国癌症研究中心支持的一项随机对照研究中认为,早期直肠癌是指 T1~2N0 的Ⅰ期直肠癌。欧洲内镜外科协会将早期直肠癌定义为T1N0期的直肠癌 [ 19 ] 。 国际主流指南对于早期CRC定义中均包含T1期CRC。本指南基于我国国情、现有文献及指南共识意见给出上述定义。
(一)高危人群的定义
推荐意见2:高危人群包括散发性CRC高危人 群及遗传性CRC高危人群。(推荐强度:强推荐,证据质量:高,专家组投票赞同率:97.8%)
推荐意见3:散发性CRC高危人群需要综合年 龄、性别、家族史、吸烟史、体质指数对人群进行风险分层。(推荐强度:强推荐,证据质量:中,专家组投票赞同率:100%)
推荐意见4:遗传性CRC高危人群包括非息肉病性 CRC 高危人群和息肉病性 CRC 综合征高危人群。(推荐强度:强推荐,证据质量:高,专家组投票赞同率:100%)
推荐说明
1.散发性CRC高危人群:采用国家卫生健康委 员会推荐的改良亚太 CRC 筛查评分 [ 2 , 20 ] ;综合年龄、性别、家族史、吸烟史和体质指数等基本信息,识别散发型 CRC 高危人群 [ 21-22 ] 。 具体风险评估方案见表2。

2.遗传性CRC高危人群:指因明确的遗传基因 突变或家族聚集性发病特征导致 CRC 发病风险显著高于普通人群的群体。遗传性 CRC 主要包括:非息肉病性 CRC 和息肉病性 CRC 综合征。其中,非息肉病性CRC包括林奇综合征和家族性CRC的X 型林奇综合征 [ 23 ] 。 息肉病性 CRC 综合征包括家族性腺瘤性息肉病、 MUTYH基因相关息肉病、遗传性色素沉着消化道息肉病综合征(也称为“PJ综合征”)、幼年性息肉综合征、锯齿状息肉病综合征等 [ 11 ] 。
(二)早期筛查方案
推荐意见 5:建议 40~74岁人群接受 CRC风险评估,对于评估结果为高风险人群,建议接受CRC筛查。有 1个一级亲属<60岁时被诊断为 CRC,或者 2 个一级亲属患 CRC,推荐从 40 岁开始、或比一级亲属中最早确诊 CRC 者诊断年龄提前 10 岁开始进行 CRC 筛查。(推荐强度:弱推荐,证据质量:低,专家组投票赞同率:100%)
推荐意见6:遗传性CRC高危人群根据不同的遗传风险进行筛查推荐。(推荐强度:弱推荐,证据质量:低,专家组投票赞同率:100%)
推荐说明
1. 筛查对象:考虑到我国国情,建议 40~74 岁 人群接受 CRC 风险评估,对于评估结果为高风险人群,建议接受 CRC 筛查。其中,如有 1 个一级亲属<60 岁时被诊断为 CRC,或者 2 个一级亲属患CRC,推荐从 40 岁开始或比一级亲属中最早确诊CRC者诊断年龄提前10岁开始进行CRC筛查 [ 24-27 ] 。 对于遗传性 CRC 高危人群,建议按如下规则开始筛查 [ 21 , 28-31 ] 。
MLH1 或 MSH2 突变引起的林奇综合征的患 者:接受结肠镜筛查的起始年龄为 20~25 岁、或比家族中最年轻患者的发病年龄提前 2~5年。
MSH6 或 PMS2 突变引起的林奇综合征的患 者:接受结肠镜筛查的起始年龄为 30~35 岁、或比家族中最年轻患者的发病年龄提前2~5年。
家族性CRC的X型和林奇综合征的患者:接受 结肠镜筛查的起始年龄比家族中最年轻患者的发病年龄前5~10年。
经典型家族性腺瘤性息肉病家系中的高危人 群:从 10~11 岁开始接受结肠镜筛查,每 1~2 年做1次结肠镜,并且持续终生。
衰减型家族性腺瘤性息肉病家系的高危人群: 应从18~20岁开始,每2年做1次结肠镜,并且持续终生。
MUTYH 基因相关息肉病患者:接受结肠镜筛 查的起始年龄为 40 岁、或比一级亲属患 CRC 的诊断年龄提前10年。
遗传性色素沉着消化道息肉病综合征患者:从 18~20岁开始接受结肠镜筛查。
幼年性息肉病综合征患者:从 15 岁开始接受 结肠镜筛查。
锯齿状息肉病综合征患者:接受结肠镜筛查的 起始年龄为 40 岁、或比一级亲属患 CRC 的诊断年龄提前10年。
2. 筛查方法:了解基本状况,包括年龄、性别、 体质指数等基本信息,CRC家族史或肠息肉等疾病史以及吸烟、饮酒等多种危险因素来进行综合判定。主要检查方法包括:(1)结肠镜:是 CRC 筛查的金标准,内镜医师在可视镜头下可以完整地检视整个结直肠的情况,对于发现的可疑病变,可以取组织活检进一步明确病理诊断;(2)大便潜血检测:大便潜血检查适用于 CRC 筛查,对 CRC 诊断灵敏度较高,但对癌前病变灵敏度有限;(3)其他还有乙状结肠镜、结肠 CT 成像、多靶点粪便 DNA 检测等方法,但其作为一线筛查方法的证据尚不充分,通常作为替代或补充方案。
3. 筛查频率:每 5~10 年进行 1 次结肠镜检查, 无病变检出者,结肠镜复查间隔可为10年;每年进行1次大便潜血检查。
(一)结肠镜检查的质量控制及诊断技术
推荐意见7:在50岁以上无症状平均风险人群中,腺瘤检出率(adenoma detection rate,ADR)应>20%。(推荐强度:强推荐,证据质量:中,专家组投票赞同率:97.8%)
推荐意见 8:肠道准备的质量需在彻底冲洗抽吸后,通过评分量表(如波士顿量表、Aronchick 量表、气泡评分CEBuS量表等)进行评估。良好的肠道准备率应>90%。(推荐强度:强推荐,证据质量:中,专家组投票赞同率:97.8%)
推荐意见 9:白光内镜盲肠插镜率应>95%;平均退镜时间(不包括活检或息肉切除)应不少于6 min。(推荐强度:强推荐,证据质量:中,专家组投票赞同率:82.6%)
推荐意见 10:高清白光结肠镜检查是检出早期 CRC 及癌前病变的有效方式,可结合图像增强内镜(image enhanced endoscopy,IEE)技术来提高病变检出率以及评估病变浸润深度。(推荐强度:强推荐,证据质量:中,专家组投票赞同率:100%)
推荐意见 11:高清白光结肠镜可适当结合人工智能辅助病变诊断技术。(推荐强度:弱推荐,证据质量:中,专家组投票赞同率:100%)
推荐说明
结肠镜检查是早期 CRC 筛查与诊断的核心手段,其质量控制(质控)水平直接影响筛查效能、患者预后及 CRC 发病率与死亡率。其中,ADR 为核心指标。研究证实,ADR 每提升 1% 可降低 3% 间期癌风险(目标:总体>20%,男>25%,女>15%) [ 32 ] 。 目前,肠道准备质量的评估优先采用波士顿肠道准备评分量表进行,要求≥90% 的肠道段达到量表评分≥2分 [ 33 ] 。 此外,还有Aronchick量表、气泡评分CEBuS量表等 [ 34-35 ] 。 分次剂量2 L的聚乙二醇(PEG)方案在低风险人群中具有非劣效性、且耐受性更佳;高危人群(如便秘、糖尿病等)需强化至 4 L PEG+促动力药 [ 36 ] 。 盲肠插镜率(≥95%)是检查完整性的核心指标。研究显示,盲肠插镜率>95% 的医师较插镜率<80%医师操作的患者间期癌风险降超 50%,需完成全结肠检查,以避免遗漏右半结肠或回盲部病变(我国右半结肠癌占 45%,隐匿性高) [ 37 ] 。 多项研究证据显示,平均退镜时间>6 min是检测早期 CRC 的最佳时机,同时能有效降低结肠镜检查后的结肠癌风险 [ 38-43 ] 。
早期发现和准确识别早期 CRC 及癌前病变,对改善患者预后至关重要。然而,传统白光成像(white light imaging,WLI)在检测扁平病变、低对比度病变及区分肿瘤性与非肿瘤性组织方面能力有限,从而推动了 IEE 的发展 [ 44 ] 。 IEE 包含窄带成像(narrow band imaging,NBI)、蓝激光成像(blue light imaging,BLI)、联动成像(linked color imaging,LCI)和纹理及色彩增强成像(texture and color enhancement for endoscopic imaging,TXI)等多种先进模式,分别通过特定波长滤光技术增强血管或表面模式识别、激光窄带宽光源提升黏膜或血管对比度、强化黏膜色彩对比度以提高扁平或锯齿状病变的可见性,以及利用先进光源技术优化亮度、色彩及纹理对比度等机制,显著提升了病变检测与表征的准确性 [ 45-50 ] 。
多项随机对照试验证实,相较于 WLI,NBI 可提高 ADR。一项荟萃分析显示,其肿瘤性病变检出能力增强(近端结肠效果尤为显著) [ 51 ] 。 Leung等 [ 52 ] 研究也表明,高清NBI较高清WLI能更有效检出结直肠腺瘤。除 NBI 外,LCI 作为提升结直肠肿瘤检出率的潜力技术亦崭露头角 [ 53 ] 。 Paggi等 [ 54 ] 的多中心随机试验,进一步支持LCI在规范筛查项目中优于 WLI 的病变检出能力。针对无蒂锯齿状病变(sessile serrated lesion, SSL)这类因扁平形态和颜色差异细微而难以检出的病变,IEE技术虽被证实可提高其检出率,但其最佳检查方式仍不明确。Fujimoto 等 [ 55 ] 研究显示,LCI 能提升 SSL 检出率;Staudenmann 等 [ 56 ] 前瞻性随机多中心研究则表明,尽管 NBI可提高 SSL检出率,但其相对于 WLI的优势,弱于对传统腺瘤的检出率。人工智能辅助结肠镜通过实时检测,显著提升了 ADR,荟萃分析显示,其可使 ADR 从 37.4% 提升至 44.8%,并降低腺瘤和息肉漏检率 [ 57 ] ;同时优化光学诊断策略,减少不必要的病理检查 [ 58 ] 。 然而,其非特异性较高,导致非肿瘤性息肉切除率增加11% [ 59 ] ;且在近端结肠的诊断特异性显著低于远端(62% 比 84%) [ 60 ] 。 尽管如此,人工智能通过减少间期 CRC 风险和推动光学诊断标准化,仍展现出变革性潜力。人工智能辅助结肠镜可实时检测病变,提升 ADR 并降低漏检率,亦有助于优化光学诊断。然而,其诊断特异性,尤其在近端结肠相对较低,可能导致非必要息肉切除率的增加。在临床实践中,建议使用人工智能初筛提示可疑病变,再由内镜医师进行最终判断,避免过度治疗。因此,人工智能辅助诊断目前应定位为医师的有效补充,其使用需建立在医师主导决策的基础上,并充分认知其技术局限性。
(二)内镜切除标本的病理评估
推荐意见 12:息肉切除、内镜下黏膜切除术(endoscopic mucosal resection,EMR)及内镜下黏膜剥离术(endoscopic submucosal dissection,ESD)标本,均应正确取材和描述。病理评估应包括组织学分型及分级、切缘、肿瘤浸润深度、肿瘤出芽、脉管浸润及神经侵犯的情况。(推荐强度:强推荐,证据质量:低,专家组投票赞同率:100%)
推荐意见13:对于所有经内镜切除术后病理新确诊为 CRC 的患者,进行错配修复(mismatch repair,MMR)蛋白表达免疫组化或微卫星不稳定性(microsatellite instability,MSI)分子检测。(推荐强度:强推荐,证据质量:低,专家组投票赞同率:97.8%)
推荐说明
1.黏膜活检标本:黏膜活检是确诊CRC的关键步骤,但对于可内镜完整切除的早期 CRC病变,应优先选择相应的切除术。活检标本应全部取材,描述标本直径和数目。病理评估应包括组织学分型及分级,如能明确看到黏膜下层浸润,可直接诊断为浸润癌;如不能,则诊断为黏膜内癌。
2.息肉切除标本:首先应全部取材并描述。带蒂息肉垂直于蒂切开,无蒂息肉垂直于烧灼面切开,描述并记录息肉的外观和颜色,测量蒂部直径(如有)和息肉的大小(长径×宽径)。
病理评估应包括:(1)组织学分型及分级;(2)切缘:需明确周边及基底部切缘有无肿瘤累及,肿瘤细胞距切缘<1 mm、或电刀切缘见肿瘤细胞,为切缘阳性;(3)浸润深度:如为浸润癌应测量。
3.EMR和ESD标本:首先应观察并描述并记录肿瘤的外观和颜色,测量标本及肿瘤的大小、肿瘤各方位距切缘的距离。避开距切缘最近处,每隔2~3 mm 平行切开标本,将标本分成大小适宜的组织块,按同一方向包埋,并在送检单上记录组织块对应的位置。
病理评估应包括:(1)组织学分型及分级;(2)切缘:需明确周边及基底部切缘有无肿瘤累及,肿瘤细胞距切缘<1 mm或电刀切缘见肿瘤细胞,为切缘阳性;(3)浸润深度:如为浸润癌应测量;(4)其他:肿瘤出芽,脉管浸润。
具体解释
1.组织学分型:主要参考世界卫生组织(World Health Organization,WHO)消化系统肿瘤分类(2019 年版) [ 61 ] 。 包括非特殊类型腺癌、锯齿状腺癌、微乳头状癌、黏液腺癌、低黏附性癌、印戒细胞癌、髓样癌、腺瘤样腺癌、腺鳞癌、非特殊类型未分化癌以及伴肉瘤样成分的癌 [ 62 ] 。
2. 组织学分级:参考 WHO 消化系统肿瘤分类 (2019 年版) [ 61 ] 。 按照腺管形成比例,分为低级别 (高分化:>95% 腺管形成,中分化:50%~95% 腺管 形成)和高级别(低分化:0~49%腺管形成),并指出分级依据分化最差的成分。侵袭前沿的肿瘤出芽 及分化差的细胞簇不纳入分级评估,需单独报告。
3.切缘:根据美国病理学家协会(the College of American Pathologists,CAP)的息肉切除标本检测规范 [ 63 ] 。 应报告周边及基底部切缘有无肿瘤累及, 肿瘤细胞距基底部切缘<1 mm 或电刀切缘见肿瘤 细胞,为切缘阳性 [ 64 ] 。 如有条件,应测量肿瘤浸润 最深处距基底或蒂部切缘的距离及距周边或侧切缘的距离。此外,周边及基底部切缘可见非浸润性 肿瘤时,切缘为阴性,但需备注。
4. 浸润深度:是内镜下切除后早期 CRC 的重要病理学因素之一 [ 64 ] 。 不同的指南有不同的表述和细微的差别 [ 63 , 65-67 ] 。 本指南推荐使用绝对数值来衡量,并对带蒂病变和扁平病变进行区分。对于扁平病变,黏膜肌层可明确时,从黏膜肌层的下缘开始测量;黏膜肌层完全损毁,则从肿瘤表面开始测量。对于带蒂病变,参考 Haggit 分级,以两侧肿瘤和非肿瘤交界点之间的连线为基线,基线以上的浸润视为头浸润,此时无论浸润深度绝对数值大小,都属于浅层浸润;基线以下的浸润,从基线开始测量 [ 65 ] 。
(三)早期CRC手术切除标本的病理评估
推荐意见14:早期CRC手术切除标本,应正确取材和描述。病理评估包括组织学分型及分级、切缘、肿瘤浸润深度、肿瘤出芽、脉管浸润和神经侵犯、区域淋巴结和病理分期情况。(推荐强度:强推荐,证据质量:低,专家组投票赞同率:100%)
推荐意见15:对于所有CRC手术切除标本,应常规进行 MMR 免疫组化或 MSI 分子检测。(推荐强度:强推荐,证据质量:低,专家组投票赞同率:97.8%)
推荐说明
1.标本固定和取材:推荐使用新鲜配制的3.7% 中性缓冲甲醛固定液固定(离体 30 min 内固定最佳),固定液量应为组织的 10倍,固定时间 8~48 h。系统观察并记录标本及肿瘤的数目、部位、大小、肉眼类型、颜色、质地、有无出血坏死、浸润深度、浸润范围以及肿瘤与两侧切缘的距离。如见明显肿块,取材应不少于 4 块,须包括肿瘤浸润最深处、肿瘤与邻近正常组织交界区域。取材组织块体积不宜 超过2.0 cm×1.5 cm×0.3 cm。
2. 病理评估应包括:(1)肉眼分型;(2)组织学 类型;(3)组织学分级;(4)切缘;(5)浸润深度(pT);(6)脉管[血管和(或)淋巴管]和神经侵犯;(7)肿瘤出芽;(8)区域淋巴结;(9)MMR免疫组化和 MSI分 子检测;(10)病理分期(pTNM分期)。
具体解释
1. 组织学类型:参考世界卫生组织(World Health Organization,WHO)消化系统肿瘤分类 (2019年版) [ 61 ] 。 包括:非特殊类型腺癌、锯齿状腺 癌、微乳头状癌、黏液腺癌、低黏附性癌、印戒细胞癌、髓样癌、腺瘤样腺癌、腺鳞癌、非特殊类型未分 化癌以及伴肉瘤样成分的癌。
2. 组织学分级:参考 WHO 消化系统肿瘤分类 (2019 年版) [ 61 ] 。 按照腺管形成比例分为低级别 (高分化:>95%腺管形成及中分化:50%~95%腺管形成)和高级别(低分化:0~49%腺管形成),并指出分级依据分化最差的成分。侵袭前沿的肿瘤出芽及分化差的细胞簇不纳入分级评估,需单独报告 [ 68 ] 。
3. 切缘评估:切缘阳性定义为肿瘤细胞距切 缘<1 mm或电刀切缘见肿瘤细胞。如有条件,应测量肿瘤浸润最深处距切缘的距离。此外,切缘见非浸润性肿瘤时,切缘为阴性,但需备注 [ 64 ] 。
4.浸润深度:推荐使用绝对数值报告浸润深度 (见黏膜、息肉、EMR和 ESD标本处理部分)。如为黏膜下层浸润癌应进行SM分级 [ 69 ] 。
5.脉管浸润和神经侵犯:应报告是否存在脉 管(淋巴管或血管)浸润和神经束侵犯。辅助诊断时可使用弹力纤维染色(即 EVG 染色)评估静脉侵犯,D2-40 或 CD31 免疫组化染色评估淋巴管及血管浸润 [ 70 ] ;S-100 免疫组化染色评估神经侵犯 [ 71 ] 。
6. 肿瘤出芽:定义为浸润前沿间质内散在 的≤4 个肿瘤细胞的孤立细胞或细胞簇。在 pT1 期CRC中,高级别肿瘤出芽提示淋巴结转移风险增高 [ 72 ] 。 推荐参考《基于肿瘤出芽国际共识(ITBCC)2016》对 CRC 肿瘤出芽进行分级,在 20 倍目镜(0.785 mm 2 )下选定一个热点区域计数:0~4 个为1级(低级别),5~9个为2级(中级别),≥10个为3级(高级别) [ 73 ] 。
7. 区域淋巴结:按淋巴引流方向取材并分组 (肠旁、中间及中央),应全部包埋分组淋巴结,较大淋巴结应剖开。未经新辅助治疗的根治术标本应检出至少12枚淋巴结。若第一次未找到12枚淋巴 结,建议复检。
8.免疫组化和分子病理检测:建议有条件的医 疗机构推荐进行 MMR 蛋白表达或 MSI 检测,用于林奇综合征筛查、预后分层及指导治疗等 [ 74 ] 。 MLH1缺陷型肿瘤应行 BRAF V600E突变和(或) MLH1甲基化检测,以评估林奇综合征的风险。
9. 病理分期:pTNM 病理分期采用 AJCC 和 UICC第8版 [ 14 ] 。
(四)早期CRC术前淋巴结转移的影像学评估
推荐意见16:对于早期CRC推荐应用CT和(或) MRI增强扫描评估术前淋巴结转移。(推荐强度:强 推荐,证据质量:高,专家组投票赞同率:100%)
推荐意见 17:CRC 术前淋巴结转移评估可适 当结合人工智能辅助诊断技术。(推荐强度:弱推 荐,证据质量:中,专家组投票赞同率:100%)
推荐说明
早期 CRC 的术前影像评估主要包括 CT、MRI、 超声及PET-CT。超声内镜能够从垂直方向直接观察病变的浸润深度及周围器官浸润情况,可作为其他横断面成像方法的补充技术。超声内镜可以提供高度准确、深入的肿瘤浸润评估,在早期 CRC的诊断中表现最佳 [ 75 ] 。 但超声内镜判断肿瘤 N 分期的准确性欠佳,难以区分炎性和转移性淋巴结,由 此限制了超声内镜的应用场景。
CT和MRI检查主要用于判断CRC有无淋巴结 转移及远处转移。一项荟萃分析研究指出,CT 评估淋巴结转移的灵敏度为 71%(95%CI:59%~81%),特异度为 67%(95%CI:46%~83%) [ 76 ] 。 盆腔 MRI检查是直肠癌术前评估的首选检查方法,对于淋巴结转移的评估,MRI 的灵敏度为 0.73(95%CI: 0.68~0.77),特异度为 0.74(95%CI:0.68~0.80) [ 77 ] 。 对于侧方淋巴结的评估,一项荟萃分析指出,盆腔MRI 的灵敏度为 0.88(95%CI:0.85~0.91),特异度为 0.85(95%CI:0.78~0.90) [ 78 ] ;而 PET-CT 的灵敏度为 0.72(95%CI:0.51~0.87),低于 MRI检查;但是特异度 0.95(95%CI:0.86~0.98),优于 MRI。因此,PET-CT 可作为检测可疑淋巴结转移的补充手段。然而,PET‑CT 在判断有无局部或远处转移方面并不优于CT或MRI,且检查费用较高,不推荐常规应用。因此,早期结肠癌推荐腹部增强CT检查,而早 期直肠癌则推荐盆腔增强MRI检查。
如何预测早期 CRC 淋巴结转移是目前临床热 点问题。系统评价和荟萃分析提出,影像组学预测 CRC 淋巴结转移的灵敏度和特异性分别为0.77(95%CI:0.69~0.84)和0.73(95%CI:0.67~0.78) [ 79 ] 。 一项纳入 3 134 例 T1 期患者的 AI结合临床信息预测模型,其性能优于指南高危因素模型(AUC:0.83 比 0.73) [ 80 ] 。 对比 JSCCR 指南模型,H&E 全扫描玻片深度学习训练的 AI模型使 15.1% 的患者避免不必要的追加手术(67.4%比82.5%) [ 81 ] 。 血液中外泌体 miRNA [ 82 ] 或基于 miRNA 及 mRNA 的表达谱 [ 83 ] 液体活检手段,可在术前有效地识别淋巴结转移患者。总而言之,未来 AI 联合临床信息、影像、病理和液体活检等多模态工具,有望成为预测早期 CRC淋巴结转移的重要工具。
(一)早期CRC局部切除指征及方式
推荐意见 18:早期 CRC 内镜切除指征为淋巴 结转移低风险、根据肿瘤大小以及部位预计内镜下能够完整切除的肿瘤。(推荐强度:强推荐,证据质量:高,专家组投票赞同率:100%)
推荐意见 19:对带蒂隆起型病变,根据其蒂部 特征选用合适的圈套器切除术进行处理。对可一次性完全切除的平坦型以及部分无蒂病变,推荐使用EMR治疗。原则上,EMR可一次性整块切除的病变最大径<20 mm。(推荐强度:强推荐,证据质量:中,专家组投票赞同率:100%)
推荐意见 20:对于最大径>20 mm、难以使用 EMR 行一次性完全切除的病变或行 EMR 切除困难的病变,推荐使用 ESD进行处理。(推荐强度:弱推荐,证据质量:中,专家组投票赞同率:100%)
推荐意见 21:对于符合指征的中低位早期直 肠癌患者,推荐使用经肛局部切除手术治疗。(推荐强度:强推荐,证据质量:中,专家组投票赞同率:100%)
推荐说明
大多数带蒂息肉可通过热圈套器息肉切除术(hot snare polypectomy,HSP)完全切除。EMR 技术的有效性和安全性在临床实践中已得到充分验证 [ 84-85 ] 。 通过切除前在黏膜下注射生理盐水的方式,黏膜病变与黏膜肌层分离,使得EMR更易于切除平坦的病变 [ 86 ] 。 对于直径>20 mm 的病变,尽管可采用分片EMR(endoscopic piecemeal mucosal resection,EPMR)对其进行处理,但有研究表明,分块切除是病变切除后复发的唯一独立危险因素 [ 87 ] 。 因此,推荐 EMR 用于直径<20 mm 的病变以实现一次性整块切除。
与传统 EMR 相比,ESD 的主要优势在于整块切除率更高、且复发率更低 [ 88-89 ] 。 其劣势在于手术时间更长、并发症发生率更高和学习曲线陡峭 [ 90 ] 。 对于最大直径超过 20 mm 的难以使用 EMR行一次性完全切除的病变、抬举征阴性的病变以及>10 mm 的 EMR 残留或治疗后复发再次行 EMR治疗困难的病变,推荐采用 ESD 治疗,尤其是根据病变的形态高度怀疑黏膜下层浅层浸润(SM1)的病变 [ 91 ] 。 内镜肌层间剥离术(endoscopic intramuscular dissection,EID)是近年新发展的内镜技术,可以完整切除早期直肠癌,且不损伤肠道完整性 [ 92 ] 。
对于中低位早期直肠癌患者,中国临床肿瘤学会(CSCO)指南推荐,病灶距肛缘<8 cm的高级别上皮内瘤变行经肛局部切除术或内镜下切除术;而T1 期直肠癌,对保留肛门括约肌有困难的患者行经肛门局部切除术,也可根据临床实际情况和患者意愿(如保肛意愿强烈),选择同步放疗等综合治疗方案,但应充分告知相关风险并密切观察等待,如肿瘤复发或重新生长,及时予以外科治疗 [ 13 ] 。 NCCN 推荐,行经肛局部切除术必须满足以下全部要求:(1)肿瘤长径<3 cm;(2)肿瘤侵犯肠周<30%;(3)切缘距离肿瘤≥3 mm;(4)活动而不固定;(5)距肛缘<8 cm;(6)T1 期肿瘤;(7)无血管和淋巴管浸润及神经侵犯;(8)高-中分化;(9)影像学检查无淋巴结转移征象。
经肛局部切除术包括传统经肛局部切除术、经肛内镜显微手术(transanal endoscopic microsurgery,TEM)及经肛微创手术(transanal minimally invasive surgery,TAMIS) [ 93 ] 。 多项荟萃分析提示,对比全直肠系膜切除术(total mesorectal excision,TME),TEM手术在早期直肠癌治疗中具有生存率高、复发率低、并发症发生率低以及安全性和有效性好 [ 94-95 ] 。 在治疗早期直肠癌方面,TAMIS 具有与 TEM 相当的短期疗效和长期疗效 [ 96 ] 。 但由于 TAMIS 手术开展时间相对较晚,其与 TEM 的疗效对比仍有待大样本及前瞻性临床研究证实。一项针对T1期直肠癌局部切除术后复发风险的荟萃分析指出,与其他局部手术切除技术相比,T1 期直肠癌患者在 TEM和TAMIS术后的复发风险可能显著降低 [ 97 ] 。
(二)早期 CRC 局部切除后追加手术的指征及 方式
推荐意见 22:早期 CRC 内镜切除后追加手术 的指征主要包括:(1)病理学检查显示阳性水平切 缘(癌组织距切缘<1 mm,存在肿瘤或电刀切缘可 见肿瘤细胞);(2)阳性垂直切缘或黏膜下层浸润深 度≥1 000 μm;(3)存在脉管浸润和神经侵犯;(4) 肿瘤分化程度差;(5)肿瘤出芽 G2 或 G3;(6)非完 整切除,标本破碎,切缘无法评价,病理检查结果不 明确等。(推荐强度:强推荐,证据质量:中,专家组 投票赞同率:95.6%)
推荐意见23:追加外科手术的时机暂无定论。对 于结肠癌,建议在追加手术指征明确后尽快(4~8 周 内)完成追加手术。对于直肠癌,应综合患者情况, 确保手术安全性后尽快完成追加手术。(推荐强度: 弱推荐,证据分级:极低,专家组投票赞同率:100%)
推荐意见 24:(1)推荐追加根治性手术。(2)对 于低位直肠癌患者,也可根据临床实际情况和患者 意愿,选择放疗等综合治疗方案。(推荐强度:强推 荐,证据质量:中,专家组投票赞同率:95.6%)
推荐意见25:追加手术中常规清扫至第2站淋 巴结(D 2 ),仅在影像学检查或术中探查发现血管根 部存在肿大淋巴结时,清扫范围扩大至第3站淋巴 结(D 3 )。(推荐强度:强推荐,证据质量:中,专家组 投票赞同率:100%)
推荐说明
某些早期 CRC 患者内镜治疗后,病理结果提示存在高风险特征,如阳性切缘、淋巴血管浸润或深层浸润等,需考虑追加手术以确保完全清除肿瘤并降低复发风险 [ 98-99 ] 。 因此,明确何时进行追加手术以及如何选择合适的手术方式,对于提高患者生存率至关重要。
JSCCR 指南推荐,T1期 CRC内镜切除后,若伴随以下任一高危因素,则属于“非治愈性切除”,需追加根治性外科手术 [ 16 ] :(1)黏膜下层浸润深度≥1 000 μm;(2)存在淋巴血管浸润;(3)肿瘤分化差(低分化癌、未分化癌、黏液腺癌、印戒细胞癌);(4)肿瘤出芽中度或高度(Bd2/Bd3);(5)切缘阳性。2024 年的大规模真实世界多中心研究结果,证实了 JSCCR 标准针对局部切除后的 pT1 期 CRC 患者的有效性,可有效识别存在淋巴结转移风险的患者 [ 100 ] 。 本指南结合我国的《早期结直肠癌内镜切除术后追加手术中国专家共识(2025 版)》 [ 101 ] 而推荐的追加外科手术的指征主要包括:(1)病理学检查显示阳性水平切缘(癌组织距切缘<1 mm,存在肿瘤或电刀切缘可见肿瘤细胞);(2)阳性垂直切缘或黏膜下层浸润深度≥1 000 μm;(3)存在脉管浸润和神经侵犯;(4)肿瘤分化程度差(低分化癌、未分化癌、黏液腺癌、印戒细胞癌);(5)肿瘤出芽 G2/G3;(6)非完整切除,标本破碎,切缘无法评价,病理检查结果不明确等情况。
追加外科手术的时机暂无定论,需考虑淋巴结转移、水肿消退、溃疡愈合、残余肿瘤定位和患者意愿等因素。研究表明,在早期胃癌中,非治愈性切除后 30 d 内与超过 30 d 行追加手术,其长期总体生存率、无复发生存率及复发率方面比较,均无显著差异 [ 102 ] 。 在 CRC 中,类似的结果同样成立 [ 103 ] 。 已有研究表明,内镜切除术后局部创面会经历相对规律的修复过程,即术后最初的 1~2 周,以急性炎性病变与充血渗出为主,随后炎性病变逐步减轻;4~8 周时,绝大多数创面已进入明显缩小、上皮再生与瘢痕化阶段 [ 104-105 ] 。 本指南建议,结肠癌患者可根据经验,尽早行追加手术治疗,并在内镜下切除后 4~8 周完成追加手术。直肠癌患者需充分评估伤口局部状况,确保手术安全性后尽快完成追加手术。追加手术前建议采用多学科综合治疗协作组(multidisciplinary team,MDT)模式以期达到最佳外科学和肿瘤学结果 [ 106 ] 。
追加手术的具体方式也尚无统一规定,局部切除或是肠管切除、淋巴结是否清扫以及清扫范围尚存争议。《国家卫生健康委员会中国结直肠癌诊疗规范(2023版)》 [ 67 ] 和《中国临床肿瘤学会(CSCO)结直肠癌诊疗指南 2025》 [ 13 ] 推荐追加肠段切除术+区域淋巴结清扫术,即根治性手术。台湾多中心回顾性研究发现,T1 期 CRC 患者在内镜非治愈性切除后追加根治性手术,其 5 年生存率与原手术相当,但若合并≥2 个高危病理因素,则复发风险显著升高,强调了淋巴结清扫的必要性 [ 107 ] 。 另一项荟萃分析显示,局部切除手术较根治性手术的复发率更高,仅适合极低危患者,提示对大多数非治愈性病例仍应选择根治性切除 [ 108 ] 。 对于低位直肠癌患者,也可根据临床实际情况和患者意愿(如保肛意愿强烈),选择放疗等综合治疗方案,但应充分告知相关风险并密切观察等待,如肿瘤复发或重新生长,及时外科治疗。
根治性切除术具有较严格的要求。对于残余病灶在结肠和上段直肠的患者,如残余病灶术中难以定位,可行内镜下定位(如纳米炭、亚甲蓝)后按照常规根治术标准切除肠段,或双镜联合的方式进行手术 [ 109-111 ] 。 推荐远近端切缘距离原创面溃疡边缘(瘢痕)≥5 cm [ 112 ] 。 对于残余病灶在中低位直肠的患者,在根治肿瘤基础上需要尽可能保留肛门,提高患者术后生活质量。因而,对于远端切缘距离要求可适当放宽,在严格遵循 TME原则的基础上,推荐远端切缘距离溃疡边缘≥1 cm [ 113 ] 。 对于低位直肠癌残留,采用经肛全直肠系膜切除(transanal total mesorectal excision,taTME)能更准确控制下缘切除距离,可接受更短的远切缘,但需对远端切缘进行术中快速病理检查,明确有无肿瘤浸润 [ 101 ] 。
但对于早期CRC淋巴结清扫范围,NCCN指南未对其作出明确推荐。JSCCR 指南指出,cTis期可行 D 0 和 D 1 切除,cT1 期可行 D 2 切除,若评估为 cN(+),则需行 D 3 切除 [ 114 ] 。 现我国推荐,在追加手术中常规清扫至第 2站淋巴结(D 2 ),仅在影像学检查或术中探查发现血管根部存在肿大淋巴结时,清扫范围扩大至第3站淋巴结(D 3 ) [ 110 ] 。
(三)早期CRC多学科联合诊疗
推荐意见 26:早期 CRC,建议纳入结直肠外 科、胃肠外科、病理科、消化内镜、医学影像科、肿瘤 内科和肿瘤放疗科等多个学科团队组成的MDT模 式进行诊疗。MDT 的临床实践病种包括早期 CRC 伴高危因素患者、早期低位直肠癌患者和 T 分期不明确患者等。(推荐强度:弱推荐,证据质量: 极低,专家组投票赞同率:97.8%)
推荐说明
目前,美国的 NCCN 和欧洲的 ESMO 指南均推荐采用 MDT 诊疗模式来指导 CRC 的治疗方案。CRC的 MDT诊疗理念和模式在国内已处于普及推广阶段,以中低位直肠癌、T4b期结肠癌、CRC肝转移或肺转移、复发性 CRC 患者为诊疗对象的 MDT诊疗模式已经见诸各大型综合医院和肿瘤医 院 [ 115 ] 。 然而,针对早期 CRC 的 MDT 诊疗模式却鲜有提及。
针对早期 CRC,建议纳入结直肠外科、胃肠外科、病理科、消化内镜、医学影像科、肿瘤内科、肿瘤放疗科、临床营养科、康复科和造口师等多个学科团队组成协作组进行 MDT 模式的诊疗。可针对早期 CRC 患者进行分期及病理危险因素评估,探讨其治疗方式。对于 MDT 专家组成员的要求,建议专家职称应为副主任医师或者主任医师,具有临床决断力和执行力。MDT 专家组的人员和场所应该相对固定,并配备工作秘书,负责协调MDT参与人员、准备会诊材料以及分配和执行MDT诊疗决策等。
早期 CRC 的 MDT,建议临床实践病种包括早期 CRC 伴高危因素患者、早期低位直肠癌患者、T分期不明确患者、伴可疑淋巴结转移患者以及追加外科手术的患者。在高危 pT1 期低位直肠癌非治愈性局部切除患者中,等待观察或辅助放化疗相较于根治性手术具有保留直肠的优势。一项针对高危T1期CRC追加手术的研究发现,5年癌症特异性生存率局部切除组+追加手术组与局部切除组的差异仅为 1.8% [ 116 ] 。 荟萃分析显示,高危 pT1 期直肠癌患者的局部切除联合辅助放化疗与追加 TME手术比较,其复发风险相当 [ 117 ] 。 因此,针对早期低位直肠癌伴高危因素,可利用 MDT 模式为病例提供个性化的治疗方案,还能通过集体智慧减少个体决策的局限性,提高疾病诊断的精确度,从而显著提升患者的生活质量和生存率。
(四)特殊类型早期CRC的治疗
推荐意见 27:林奇综合征伴发早期 CRC 的治 疗可选肠段切除或次全结肠切除术,需综合分析患 者的基因突变情况、年龄、个人意愿、后期随访监测 的依从性和当地医疗水平进行个体化选择。(推荐强度:弱推荐,证据质量:低,专家组投票赞同率: 100%)
推荐意见 28:家族性腺瘤性息肉病伴发早期 CRC 推荐行手术治疗,手术方式根据息肉情况可 选择全结肠切除或全结直肠切除。(推荐强度:弱推 荐,证据质量:低,专家组投票赞同率:100%)
推荐意见 29:溃疡性结肠炎合并早期 CRC 建 议行全结直肠切除手术治疗;克罗恩病合并早期 CRC,可根据病变局限情况考虑肠段切除术。(推 荐强度:强推荐,证据质量:中,专家组投票赞同率: 100%)
推荐说明
林奇综合征是由于 DNA 的 MMR基因( MLH1、 MSH2、 MSH6、 PMS2)和 EPCAM基因胚系突变而引起的遗传性癌症综合征,占所有 CRC 的 3%~ 5% [ 11 , 118 ] 。 MLH1和 MSH2基因突变携带者患 CRC的风险显著高于 MSH6和 PMS2基因突变携带者。 EPCAM基因 3'端缺失突变的林奇综合征患者的临床表现和 MSH2突变者相似。林奇综合征相关CRC的组织学特征为组织学分化差、淋巴细胞浸润肿瘤、黏液腺癌、印戒细胞癌或筛孔状组织学特征。但是此类CRC患者的预后好于散发性CRC [ 119 ] 。 只有找到了有临床意义的 MMR基因的胚系突变(致病性变异或疑似致病性变异),才能确诊为林奇综合征 [ 120 ] 。 对于林奇综合征合并结肠癌的患者,欧洲指南指出,考虑到异时性 CRC的风险较高,因此推荐 MHL1和 MSH2突变的患者行次全结肠切除术,而 MSH6及 PMS2突变患者建议行结肠节段切除术 [ 112 ] 。 而对于林奇综合征合并直肠癌,可以考虑行保留或不保留括约肌的 TME。仅对同时患有结直肠肿瘤的年轻携带者,建议行次全结肠切除术。由于常规结肠镜检查是 CRC 的有效预防措施,因此不建议对林奇综合征进行预防性结直肠手术 [ 121 ] 。
家族性腺瘤性息肉病(familial adenomatous polyposis,FAP)是一组以结直肠多发腺瘤为特征的常染色体显性遗传综合征。其表现为青春期大量结直肠腺瘤,与 APC基因的胚系致病突变有关,约占所有诊断的 CRC 的 1%。欧洲遗传性息肉病临床管理指南提出,合并 CRC 的 FAP 是绝对手术指征 [ 28 ] 。 手术方式则根据息肉的数量和部位进行选择:其中直肠腺瘤数不超过 5 个、且结肠腺瘤数<500个的患者,建议选择全结肠切除+回肠直肠吻合术(total colectomy and ileorectal anastomosis,IRA);而直肠腺瘤>20个或结直肠腺瘤>500个的患者,建议选择全结直肠切除+回肠贮袋肛管吻合术(ileal pouch-anal anastomosis,IPAA)。研究提示,患者最初的直肠腺瘤<5个、且结肠腺瘤<1 000个,则IRA 后直肠切除术的风险为 0。据报道,在术前5~20个直肠腺瘤的患者中,直肠切除术率为 13%,但当有 20 个或更多直肠腺瘤时,直肠切除术率增加到 54% [ 122 ] 。 此外,具有严重基因型(密码子1250-1464)的患者也建议行IPAA手术,因为他们在保留直肠手术后,具有最高的直肠癌累计发生率 (15 年内 8%)和继发直肠切除术率(20 年内 74%) [ 123-124 ] 。
炎症性肠病(inflammatory bowel disease,IBD)作为一类慢性复发性免疫介导的胃肠道炎性疾病,包括溃疡性结肠炎(ulcerative colitis,UC)和克罗恩病(Crohn's disease,CD)。研究表明,IBD 患者的CRC发病风险是一般人群的2~3倍 [ 125 ] 。 目前,根据欧洲克罗恩病和结肠炎组织(European Crohn's and Colitis Organisation,ECCO)指南,对于息肉样病变或无侵袭性癌或纤维化、边界明显的非息肉样病变,建议内镜专家行内镜下整块切除(EMR、ESD、混合ESD);对于无法切除的边界不清的大病灶、侵袭性癌、多灶性低级别或高级别上皮内瘤变,建议外科手术 [ 126 ] 。 然而,UC 患者和 CD 患者合并早期CRC的手术方式却大相径庭。对于 UC而言,IPAA是UC外科治疗的首选术式,全结直肠切除+永久性回肠造口术、IRA 也是常见的手术方式。中国 UC外科治疗指南及 ECCO的 UC外科治疗指南推荐行二期或三期IPAA [ 127-128 ] 。 一项回顾性研究报道,二期IPAA与三期IPAA相比,早期并发症(≤30 d)发生率相似( P>0.05);然而,晚期并发症(>30 d)更常见于三期 IPAA(39% 比 77%, P=0.03),尤其是吻合口狭窄 [ 129 ] 。 改良二期 IPAA(二期手术不行预防性回肠造口)颇受关注,已被证实是安全可行的治疗方法 [ 130 ] 。 对于 CD 而言,ECCO 的 CD 外科治疗指南建议,将结直肠切除术作为 CD相关性 CRC或高级别上皮内瘤变的治疗方法 [ 131 ] 。 选定病例中可进行节段结肠切除,然后内镜监测随访。因此,CD合并早期 CRC,可根据病变局限情况考虑肠段切除术。此类患者的治疗方案极具个体化,必须由包含结直肠外科、消化内科和病理科在内的 MDT评估后决定。
(一)早期CRC内镜治疗术后的随访
推荐意见 30:完全切除、无高危特征的早期 CRC,术后 1 年内应进行首次复查。(推荐强度:强推荐,证据质量:中,专家组投票赞同率:100%)
推荐意见 31:对于具有高危特征的人群,建议 术后初始随访间隔为6~12个月,并根据复查结果,动态调整后续随访间隔。(推荐强度:强推荐,证据质量:中,专家组投票赞同率:100%)
推荐意见 32:所有随访须基于高质量结肠镜, 若首检未达标需缩短随访周期。(推荐强度:强推荐,证据质量:中,专家组投票赞同率:100%)
推荐说明
研究表明,对于完全切除、且无高危特征的早 期 CRC(如切缘阴性、无 Haggitt 分级高危特征、非分块切除等),可适当延长随访周期 [ 132 ] 。 欧洲胃肠内 镜 学 会(European Society of Gastrointestinal Endoscopy,ESGE)等国际指南支持对这类低风险病变减少监测频率,以优化医疗资源配置 [ 131 ] 。 特别是对于散发性早期 CRC,若无黏膜下层浸润≥1 mm、低分化腺癌、淋巴血管浸润或肿瘤出芽等高危病理特征,短期(6~12 个月)内镜监测的必要性较低 [ 132-134 ] 。
存在任一高危特征(如阳性切缘、深部黏膜下 浸润、不良病理类型等)的患者,需要缩短随访间隔或考虑追加手术治疗 [ 134 ] 。 分片内镜黏膜切除术EMR后的病变由于局部复发率高,通常建议6个月内进行首次监测 [ 135-136 ] 。 对于拒绝手术的高风险患者,需采用更密集的监测方案并联合肿瘤标志物检测 [ 134 ] 。 值得注意的是,IBD 相关早期 CRC 即使完全切除,仍需更频繁地监测,这与散发病例的管理策略存在明显差异 [ 137-138 ] 。
若首检存在肠道准备不足(波士顿量表评 分 <7 分)或盲肠插管失败,需立即缩短随访间隔(如 3~6 个月首次复查)) [ 32 , 87 , 139-141 ] 。 多发腺瘤(≥10个)或家族史阳性者,需结合基因检测排除遗传综合征(如林奇综合征或FAP),必要时转为每年复查 [ 142-143 ] 。
(二)早期CRC术后的随访
推荐意见 33:内镜治疗后追加手术者或局部 切除术患者,按照CRC分期行术后随访,推荐Ⅰ期患者每6个月复查1次,至少5年。随访内容包括:体格检查、血癌胚抗原、肝脏超声和结肠镜检查等。(推荐强度:强推荐,证据质量:高,专家组投票赞同率:100%)
推荐说明
对早期 CRC 内镜下非治愈性切除追加手术者 的随访,可参考Ⅰ期CRC术后的随访策略 [ 13 , 101 ] 。 以分期为标准进行。对于行根治性手术患者的术后随访,推荐Ⅰ期患者每6个月复查1次,至少5年。
随访内容包括:(1)体格检查,尤其是直肠指 检;(2)血癌胚抗原;(3)肝脏超声检查;(4)推荐术后1年内进行结肠镜检查,如检查发现进展期腺瘤(绒毛状腺瘤、直径>1 cm、或有高级别上皮内瘤变),需在结肠镜检查后1年内复查;如未见进展期腺瘤,则可于3年内复查1次结肠镜,之后每5年复查 1 次结肠镜。随诊检查出现的结直肠腺瘤均推荐切除。直肠癌患者必要时可增加每年 1 次盆腔增强MRI。
如复查期间出现血癌胚抗原持续升高、肝脏超 声异常或其他复发证据,则需行相关体格检查、结肠镜检查和胸腹盆增强 CT 检查。如提示阳性结果,则需按照复发性 CRC 处理;如提示阴性结果,建议3个月后复查胸腹盆增强CT,或根据患者经济情况行PET-CT检查。
规范和标准化早期 CRC 的全程管理,将促进 中国早期 CRC 诊治的同质性和规范性,提高 CRC患者的预后。本指南首次对早期 CRC 的全程管理(包括筛查、诊断、治疗和随访)的循证医学证据进行系统化整合,结合专家意见,在早期 CRC 的定义、筛查、诊断、治疗及随访各个方面提供了详尽而切实可行的推荐意见。
本指南也发现一些重要的临床问题缺乏足够 的临床研究证据支持,包括:(1)早期 CRC 与进展期 CRC 之间筛查、随访及高危人群的区别;(2)早期 CRC 追加手术时机;(3)需追加手术但未追加手术的早期CRC患者的随访推荐;(4)早期CRC的预防方案推荐。期待进一步的高质量临床研究为这些问题提供更加坚实的研究证据,更有效地推动早期CRC的临床管理。
《早期结直肠癌全程管理指南(2025 版)》制订专家组成员 名单
顾问组成员: 兰平(中山大学附属第六医院)、张忠涛(首都 医科大学附属北京友谊医院)、吴小剑(中山大学附属第六医院)、王贵英(河北医科大学第二医院)
专家组组长: 何晓生(中山大学附属第六医院)
专家组成员 (按姓氏汉语拼音字母排序):蔡木炎(中山大学 肿瘤防治中心);曹海龙(天津医科大学总医院);柴宁莉(解 放军总医院);陈明锴(武汉大学人民医院);陈钰锋(中山大 学附属第六医院);崔春晖(南方医科大学珠江医院);董学 思(国家癌症中心/国家恶性肿瘤临床医学研究中心/中国医 学科学院肿瘤医院);高显华(海军军医大学附属长海医 院);杭栋(南京医科大学);何宋兵(苏州大学附属第一医 院);何伟玲(厦门大学附属翔安医院);胡健卫(复旦大学附 属中山医院);胡健聪(中山大学附属第六医院);胡军红(郑 州大学第一附属医院);黄艳(中山大学附属第六医院);江 从庆(武汉大学中南医院);姜维(首都医科大学附属北京友 谊医院);赖家骏(粤北人民医院);李明(北京大学首钢医 院);李霓(国家癌症中心/国家恶性肿瘤临床医学研究中心/ 中国医学科学院肿瘤医院);林俊忠(中山大学肿瘤防治中 心);凌逸虹(中山大学肿瘤防治中心);刘再毅(广东省人民 医院);刘志国(空军军医大学西京医院);陆丽明(广州中医 药大学);马景光(哈尔滨医科大学附属第二医院);孟晓春 (中山大学附属第六医院);潘骏(海军军医大学附属长海医 院);孙晶(上海交通大学医学院附属瑞金医院);童强(武汉 大学人民医院);童卫东(陆军军医大学陆军特色医学中 心);汪挺(中华胃肠外科杂志编辑部);王超(中山大学附属 第六医院);王贵玉(哈尔滨医科大学附属第二医院);魏波 (中山大学附属第三医院);吴现瑞(中山大学孙逸仙纪念医 院);肖乾(浙江大学医学院附属第二医院);谢传淼(中山 大学肿瘤防治中心);谢睿(遵义医科大学);谢霞(陆军军 医大学第二附属医院);杨鋆(首都医科大学附属北京友谊 医院);叶再生(福建省肿瘤医院);张鹏(华中科技大学同济 医学院附属协和医院);张卫(海军军医大学附属长海医 院);张子臻(上海交通大学医学院附属仁济医院);郑建勇 (空军军医大学西京医院)
执笔组成员 (按姓氏汉语拼音字母排序):董学思(国家癌症 中心/国家恶性肿瘤临床医学研究中心/中国医学科学院肿 瘤医院);何晓生(中山大学附属第六医院);胡健聪(中山大 学附属第六医院);姜维(首都医科大学附属北京友谊医 院);凌逸虹(中山大学肿瘤防治中心);王超(中山大学附属 第六医院);杨鋆(首都医科大学附属北京友谊医院);张斌 (中山大学附属第六医院)
秘书:张斌(中山大学附属第六医院)
利益冲突 参与本共识制定的专家组所有成员均声明无利益冲突
滑动阅读参考文献
排版编辑:肿瘤资讯-as











 苏公网安备32059002004080号
苏公网安备32059002004080号


