随着以免疫检查点抑制剂(ICI)为核心的联合治疗方案不断取得突破,基于生物标志物的精准免疫治疗策略已成为晚期胃肠肿瘤临床实践的新范式。双免联合为MSI-H/dMMR晚期结直肠癌(CRC)患者开启“去化疗”长生存时代,“免疫+化疗”亦使部分晚期胃癌(GC)迈向“慢病化管理”。然而,创新药物的可及性仍是影响患者获益的关键瓶颈,多层次医疗保障体系的建立和发展正为破解这一难题提供新思路。【肿瘤资讯】特邀专访了西安交通大学第一附属医院锁爱莉教授,围绕晚期胃肠道肿瘤的免疫治疗新进展、免疫增敏的创新研究以及多层次支付体系对提升创新药物可及性的重要作用。
西安交大一附院肿瘤内科副主任
美国Emory大学访问学者
中国抗癌协会食管肿瘤整合康复专委会常委
中国抗癌协会肿瘤胃病学专委会常委
中国抗癌协会整合肿瘤肾脏病专委会委员
陕西省抗癌协会化疗专委会青委主任委员
陕西省抗癌协会老年肿瘤外科专委会副主任委员
陕西省抗癌协会安宁疗护专委会副主任委员
主持国科金面上项目2项,一作/通讯作者SCI论文20余篇,IF>10的10余篇,授权国家发明专利3项
免疫联合治疗实现破局:
超1/3 晚期结直肠癌患者获CR,
近1/4晚期胃癌实现5年长生存
锁爱莉教授:近年来,以免疫检查点抑制剂(ICI)为代表的免疫治疗,确实为晚期胃肠道肿瘤的治疗带来了深刻变革。这一变革的核心趋势,是从过去的化疗或化疗联合靶向治疗模式,迈向了基于生物标志物的精准联合治疗新时代。
在晚期胃癌(GC)领域,对于HER2阴性患者,CheckMate-649研究率先确立了“免疫联合化疗”的一线标准治疗地位,随后多项同类研究也相继取得了积极结果[1]。该研究证实,纳武利尤单抗联合化疗对比单纯化疗,能够显著改善GC患者的总生存期(OS)和无进展生存期(PFS)。尤其令人振奋的是,今年ASCO GI大会上公布的CheckMate-649研究中国亚组5年随访数据显示,在PD-L1 CPS≥5的患者中,近1/4的患者实现了5年长期生存,这一比例是单纯化疗组的3倍(24% vs 8%),且免疫联合治疗的安全性良好[2]。这标志着部分晚期GC患者的管理,正逐步向“慢病化”模式转变。
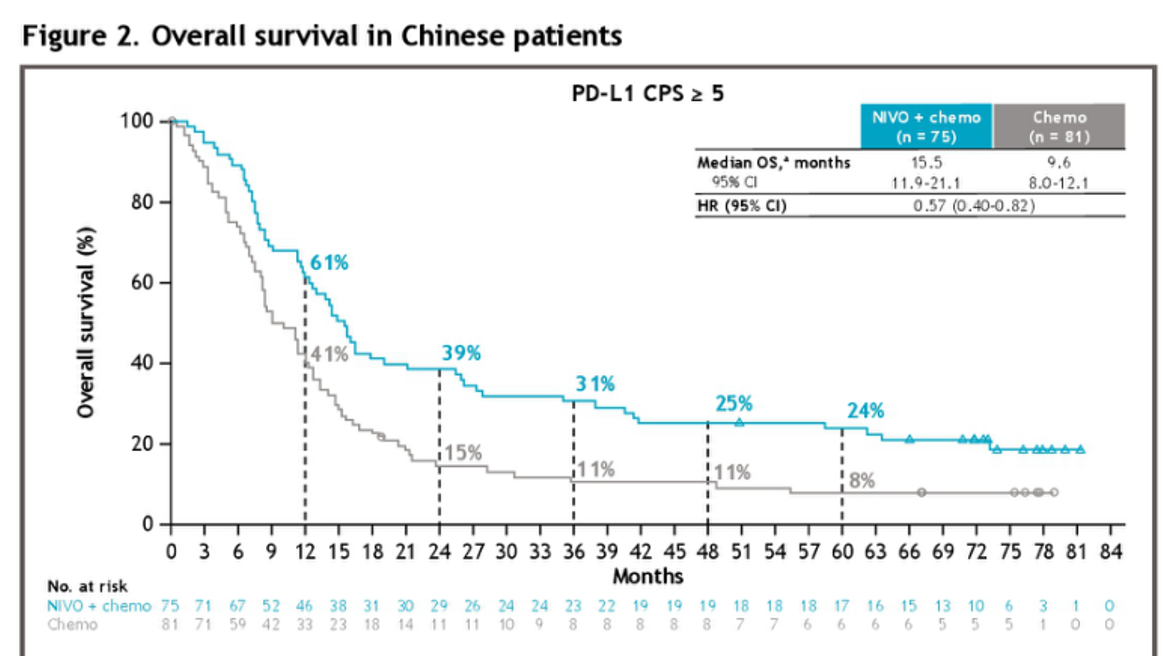
在结直肠癌(CRC)领域,微卫星高度不稳定(MSI-H)或错配修复缺陷(dMMR)的患者,因其肿瘤具有高突变负荷和强免疫原性,成为免疫治疗的优势人群。最初,KEYNOTE-177研究证实,PD-1抑制剂单药一线治疗的疗效优于传统化疗[3],为此类患者开启了“去化疗”时代。这本身已是较大进步,但我们在临床应用中发现该效果因人而异,疗效不够令人满意。作为临床医生,我们仍在探索能否获得更优的疗效。
在此基础上,CheckMate 8HW研究为我们提供了新的循证医学证据。这是一项关键的III期临床试验,旨在探索在MSI-H/dMMR晚期CRC患者中双免联合(纳武利尤单抗+伊匹木单抗)对比化疗或免疫单药(纳武利尤单抗)的疗效。研究早期结果就已证实,一线使用纳武利尤单抗+伊匹木单抗对比化疗,PFS获益显著(HR=0.21)[4],基于该研究结果,O+Y双免联合方案已获批MSI/dMMR mCRC一线治疗适应证。根据2025 ESMO大会上公布的最新数据,在MSI-H/dMMR mCRC一线治疗中,纳武利尤单抗联合伊匹木单抗对比纳武利尤单抗单药,展现出更优的PFS获益(HR=0.69)和更高的客观缓解率(ORR 73% vs 61%),尤其是完全缓解(CR)率达到了35%[5]。这意味着O+Y双免联合不仅能让更多CRC患者的肿瘤缩小,更能让超过1/3的患者肿瘤肉眼完全消失。这表明,在PD-1抑制剂的基础上联合CTLA-4抑制剂,能够激活更广泛、更深度的抗肿瘤免疫反应,从而可能带来更持久的生存获益。
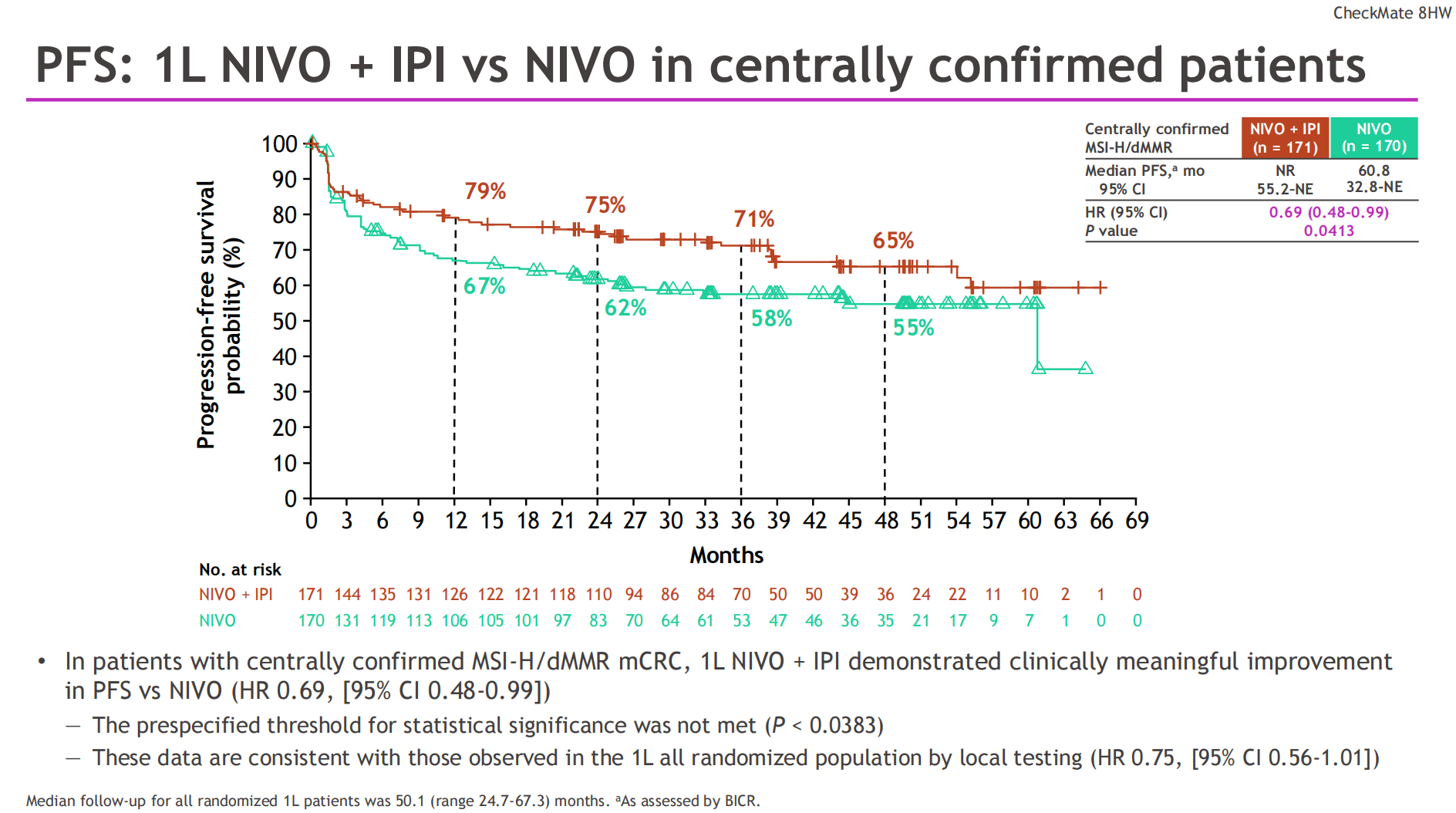
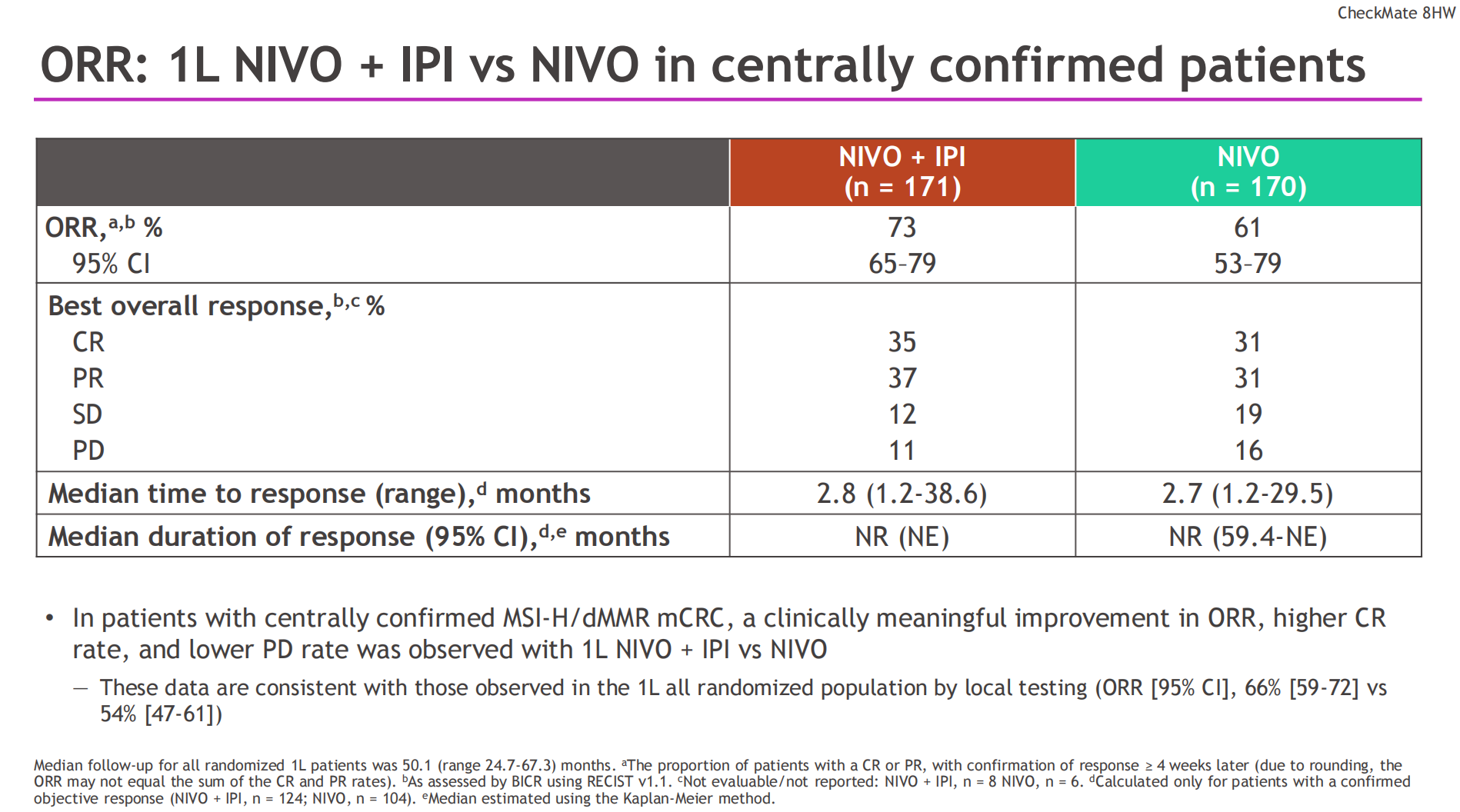
总而言之,这些进展共同凸显了生物标志物(biomarker)检测在临床决策中的核心地位。无论是胃癌的PD-L1 CPS评分,还是结直肠癌的MSI/dMMR状态,都必须在治疗前进行检测和明确。通过精准的分子分型,我们才能为不同特征的患者选择最合适的免疫联合策略,真正实现个体化治疗,最大程度地改善患者的预后。
创新策略点燃“冷肿瘤”,
为PD-1阻断增效赋能
锁爱莉教授:免疫检查点抑制剂(ICI)为肿瘤患者带来了新的治疗希望,但临床实践中我们观察到,部分患者对免疫治疗的应答率并不理想。以结直肠癌为例,虽然免疫治疗对dMMR/MSI-H患者效果非常好,但此类患者在晚期CRC中仅占约5%,其余约95%的微卫星稳定(MSS)患者对免疫治疗的疗效并不理想。这背后的核心问题可能在于,许多肿瘤存在免疫抑制性微环境,CD8+T细胞浸润不足,免疫抑制性细胞大量聚集。因此,如何增强肿瘤免疫原性、重塑免疫微环境,是提高免疫治疗疗效的重要突破口。
我们团队围绕这一核心问题开展了相关研究,主要聚焦于通过诱导免疫原性细胞死亡(ICD)来激活系统性抗肿瘤免疫,从而增强PD-1阻断治疗的疗效。我们开发了多种创新性治疗平台,包括肿瘤微环境响应性的纳米递送系统和具有多重酶活性的治疗平台,这些平台通过免疫检查点抑制剂、化疗、光动力治疗等多种方式协同作用,能够有效诱导ICD并促进树突状细胞成熟[6-8]。
我们的研究揭示了:首先,ICD诱导是将“冷肿瘤”转化为“热肿瘤”的有效策略。通过诱导ICD,肿瘤细胞释放肿瘤相关抗原,激活树突状细胞,进而启动特异性的抗肿瘤T细胞免疫应答。其次,重塑肿瘤免疫微环境是增强PD-1阻断疗效的关键。我们的研究证实,通过促进CD8+ T细胞向肿瘤内浸润、抑制髓源性抑制细胞(MDSCs)的扩增和迁移、下调M2型巨噬细胞比例,可以打破免疫抑制屏障,为免疫检查点抑制剂发挥作用创造更有利的环境。第三,ICD诱导与PD-1阻断的联合治疗能够激活强大的系统性抗肿瘤免疫。在多个肿瘤小鼠模型中,这种联合治疗策略不仅能够有效清除原发肿瘤,还能抑制远处肿瘤生长和预防肿瘤复发[6-8]。这些发现为优化联合治疗方案、提高患者应答率指明了方向。
多维支付模式提升可及性,
让优质创新药物真正惠民
锁爱莉教授:新药在不断涌现,为肿瘤治疗带来了新希望。然而,临床实践中相当比例的患者因为经济问题无法真正使用到这些创新药物,使得科技发展并未给患者带来实质性获益。因此,用药的可及性和支付能力是患者获得有效治疗的核心问题,如何让优质药物真正应用到患者身上是我们面临的关键挑战。当前,以国家医保、城市惠民保、商业健康保险和患者援助项目为核心的多层次医疗保障体系正在逐步完善,这为更多患者获得规范、有效的治疗创造了条件。
首先,国家医保药品目录的动态调整是提升创新药物可及性的关键。近年来,包括PD-1抑制剂在内的多种创新抗肿瘤药物通过医保谈判进入医保目录,价格大幅下降,使更多肿瘤患者有机会获得能够带来长期生存获益的治疗方案。其次,城市惠民保(如陕西全民健康保:是由陕西省医保局、省财政厅、省税务局、国家金融监督管理总局陕西监管局共同指导,由陕西省内17家保险公司联合推出的面向陕西基本医保参保人及“新市民”的一款普惠型健康保险[9])作为基本医保的有益补充,在覆盖医保目录外创新药物、降低患者自付比例方面发挥了重要作用。创新药物如果能够被地方惠民保覆盖,会极大提升患者的治疗意愿和依从性。此外,患者援助项目同样不可或缺。我们注意到,许多跨国药企和部分本土创新药企都设立了规范的患者援助项目,为符合条件的患者提供免费用药服务。
要让这些模式真正与临床实践深度结合,我认为还需要在信息传递和服务流程上做更多工作。目前很多患者对“惠民保”的保障范围、慈善赠药的申请条件并不清楚,作为医生,我们有责任在诊疗过程中向患者告知这些支付渠道。同时,医院、医保部门、商业保险和慈善机构之间如果能建立更顺畅的协作机制,减少患者在多个部门之间的奔波,将极大提高这些惠民政策的实际落地效果。
总而言之,创新支付模式的价值在于帮助患者克服经济障碍,坚持完成有效治疗。相信随着多层次医疗保障体系的不断完善和优化,会有越来越多的胃肠道肿瘤和其他肿瘤患者能够获得规范、及时、有效的创新药物治疗,实现更长的生存期和更好的生活质量。
[1] 2025《CSCO胃癌诊疗指南》.
[2] Lin Shen, Yuxian Bai, Xiaoyan Lin, et al. First-line (1L) nivolumab (NIVO) plus chemotherapy (chemo) vs chemo in patients (pts) with advanced gastric cancer, gastroesophageal junction cancer, and esophageal adenocarcinoma (GC/GEJC/EAC): 5-year (y) follow-up of Chinese pts from CheckMate 649. 2025 ASCO GI, Abstract 392.
[3] André T, Shiu KK, Kim TW, et al. Pembrolizumab versus chemotherapy in microsatellite instability-high or mismatch repair-deficient metastatic colorectal cancer: 5-year follow-up from the randomized phase III KEYNOTE-177 study. Ann Oncol. 2025 Mar;36(3):277-284.
[4] Thierry Andre, Elena Elez, Eric Van Cutsem, et al. Nivolumab (NIVO) plus ipilimumab (IPI) vs chemotherapy (chemo) as first-line (1L) treatment for microsatellite instability-high/mismatch repair-deficient (MSI-H/dMMR) metastatic colorectal cancer (mCRC): First results of the CheckMate 8HW study. 2024 ASCO GI, Abstract LBA768.
[5] Sara Lonardi, Heinz Josef Lenz, Elena Elez Fernandez, et al. Nivolumab plus ipilimumab vs nivolumab monotherapy for microsatellite instability-high/mismatch repair-deficient (MSI-H/dMMR) metastatic colorectal cancer (mCRC): New results from CheckMate 8HW. 2025 ESMO, LBA29.
[6] Wang Y, Qian J, Xu W, et al. Coordination polysaccharide nanomissiles with size/charge dual-transformability and immunomicroenvironment-reeducating activity potentiate PD-1 blockade in hepatocellular carcinoma. Chemical Engineering Journal, 2023.
[7] Wang Y, Qian J, Xu W, et al. Polysaccharide Nanodonuts for Photochemotherapy-Amplified Immunogenic Cell Death to Potentiate Systemic Antitumor Immunity Against Hepatocellular Carcinoma. Advanced Functional Materials, 2022.
[8] Hou G, Qian J, Guo M. Copper coordinated nanozyme-assisted photodynamic therapy for potentiating PD-1 blockade through amplifying oxidative stress. Chemical Engineering Journal, 2022.
[9]www.shaanxi.gov.cn/xw/ldx/bm/202410/t20241015_3063029.html
1506-CN-2500380
排版编辑:Niko











 苏公网安备32059002004080号
苏公网安备32059002004080号


