SEGNO研究是由厦门大学附属第一医院张开颜教授团队于2024年发起的一项研究者发起的临床研究(Investigator-Initiated Trial,IIT)[1]。该研究基于基因检测结果,对局部进展期及寡转移前列腺癌患者给予分子分层的新辅助治疗,旨在探索不同分子亚型匹配相应强化三联方案的安全性与初步疗效,为高危/极高危前列腺癌患者的围手术期综合治疗提供证据支持。
在已入组并完成疗效评估的患者中,部分患者经个体化的精准新辅助治疗后,肿瘤病灶经PSMA PET/CT评估可达临床完全缓解(clinical complete response,cCR),根治性前列腺切除术后病理残留肿瘤负荷极低,部分病例达到病理最小残留病灶(pathologic minimal residual disease,pMRD),甚至接近病理完全缓解(pathologic complete response,pCR),显示出基因分层的三联新辅助策略在特定分子亚型中的深度应答潜力。SEGNO研究在PUNCH研究[2]、FAST-PC研究[3]、GUNS研究[4] 等前列腺癌新辅助探索性试验基础上,进一步将“基因分层+三联强化”的理念引入局部进展期及寡转移人群,探索以分子特征为核心的前列腺癌新辅助治疗模式。
值得关注的是,BRCA2等HRR(homologous recombination repair,HRR)通路致病变异相关前列腺癌常呈更强生物学侵袭性与更高复发/转移风险,预后相对不良;因此,在可手术窗口期前移精准新辅助强化治疗,以实现更深度的肿瘤减负并行根治性切除,有望降低术后复发风险并延长整体生存期,具有重要的临床策略意义。为此,《肿瘤资讯》特邀张开颜教授对SEGNO研究及其中一例合并BRCA2突变患者接受帕米帕利+戈舍瑞林缓释微球+NHA的三联新辅助治疗下实现深度缓解的典型病例进行系统解读,与泌尿肿瘤领域同道分享基因分层新辅助策略的实践经验与思考。
研究背景:从经验性新辅助到基因分层的精准治疗
对于局部进展期及寡转移前列腺癌(prostate cancer,PCa)患者,即便接受根治性前列腺切除术(radical prostatectomy,RP),仍面临较高的阳性切缘率、淋巴结转移以及术后生化复发风险,提示单纯局部手术难以充分控制高危疾病负荷,加强围手术期全身治疗具有潜在必要性。基于此,早期多项研究尝试采用新辅助雄激素剥夺治疗(androgen deprivation therapy,ADT),结果显示可在一定程度上缩小原发肿瘤体积、降低阳性切缘比例,但在随机对照研究中尚未证实对长期生存结局具有明确获益,其循证证据不足以支持在指南中作为标准推荐,但从侧面强调了新辅助全身治疗在高危人群中的潜在价值。
随着新型内分泌药物(novel hormonal agents,NHA)及化疗方案在晚期转移性和生化复发PCa中的广泛应用,多项探索性新辅助Ⅱ期研究提示,基于NHA或化疗的术前强化治疗可在一定程度上提高pCR/pMRD比例并降低切缘阳性率,相较传统ADT呈现出一定的疗效改善。然而,从总体病理应答率及随访结果来看,这类基于未分层人群的新辅助强化策略总体获益仍然有限,疗效差异较大,在肿瘤生物学高度异质的前列腺癌人群中尚难以形成统一的最优新辅助方案。
在基因检测技术日益普及的背景下,BRCA1/2及其他DNA损伤修复(DNA damage repair,DDR)基因改变、MSI-H/TMB-H、CDK12失活等分子特征被陆续报道与药物敏感性和预后相关,这些发现为在新辅助阶段尝试基于基因分层的精准治疗策略提供了理论基础。其中,BRCA2及其他HRR/DDR通路致病改变不仅具有治疗预测价值(如对 PARP抑制剂的潜在敏感性),亦常与更高分级、局部浸润与更早期转移倾向等不良生物学行为相关,提示该亚型患者在传统局部治疗或经验性新辅助策略下可能更易出现早期复发与进展。在此背景下,围手术期治疗的核心目标不再仅是“术前缩瘤”,更在于通过分子分层识别高风险亚型,在可手术窗口期前移强化全身治疗以实现更深层次的肿瘤减负与微小残留控制,从而为后续根治性切除创造更优条件,并有望降低术后救治性治疗的复杂度与负担,改善长期结局的可能性。
以GUNS研究为代表的“伞式”新辅助研究即在高危局限性PCa人群中引入分子分层理念,根据不同分子亚型匹配差异化新辅助方案,作为“基因分层+新辅助强化”模式的重要探索。在此基础上,SEGNO研究进一步在局部进展期及寡转移PCa人群中系统应用“基因分层+三联新辅助强化”的设计框架,以新型内分泌药物联合ADT,并在不同分子特征队列中叠加PARP抑制剂、含铂化疗或免疫治疗等策略,探索以分子特征为核心构建前列腺癌新辅助治疗模式的可行性。
SEGNO研究:基因分层指导的三联新辅助方案
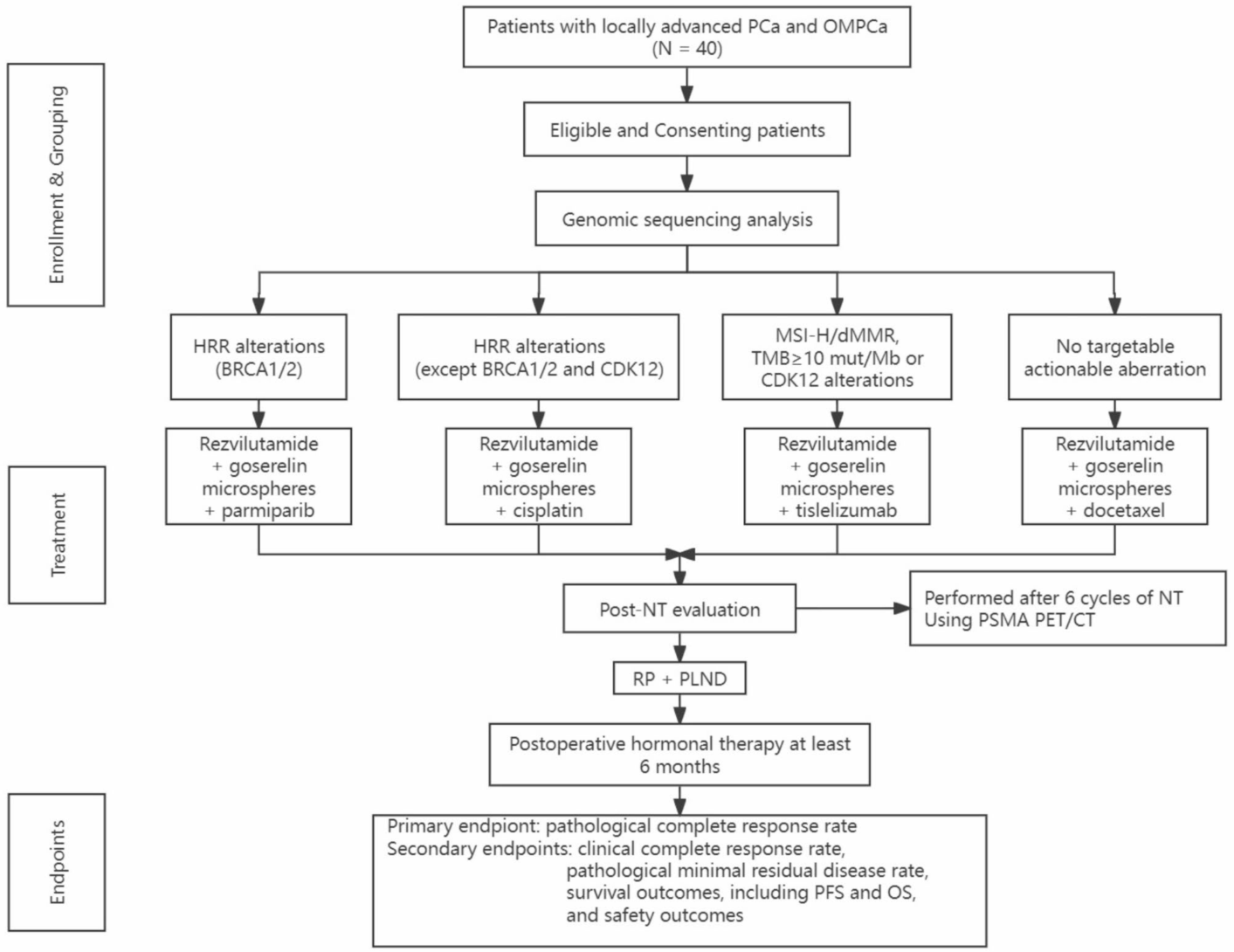
SEGNO研究是一项单中心、前瞻性、开放标签的干预性研究,计划纳入影像学诊断(前列腺多参数MRI+全身骨扫描+PSMA PET/CT)证实为局部进展期前列腺癌(cT3b-4,N0-1,M0)或寡转移前列腺癌(无内脏转移且骨转移灶≤5 处)的患者40例,且既往未接受过系统性治疗。所有受试者在入组前接受统一的下一代测序(next-generation sequencing,NGS)分子检测,根据BRCA1/2及其他DDR基因改变、MSI-H/dMMR、肿瘤突变负荷(tumor mutational burden,TMB)或CDK12失活等分子特征进行分层,划分为4个生物标志物队列,并分别接受以下新辅助三联方案:
1) 合并BRCA1/2突变者给予NHA(瑞维鲁胺)+ADT(戈舍瑞林缓释微球)+PARP抑制剂(帕米帕利);
2) 合并除BRCA1/2外DDR基因突变者给予NHA+ADT+顺铂;
3) 合并MSI-H/dMMR、TMB≥10 mut/Mb、PD-L1阳性或CDK12失活突变者给予NHA+ADT+免疫检查点抑制剂(替雷利珠单抗);
4) 未检出上述基因改变者给予NHA+ADT+多西他赛。
新辅助三联强化治疗一般持续6个周期。完成新辅助治疗后,通过PSMA PET/CT进行影像学评估以判定临床缓解情况,随后符合手术指征的患者接受根治性前列腺切除术。术后继续给予NHA联合ADT维持治疗,疗程不少于6个月。研究主要终点为病理完全缓解(pCR)率,次要终点包括临床完全缓解(cCR)率、病理最小残留病灶(pMRD)率、总生存(overall survival,OS)、无进展生存(progression-free survival,PFS)和安全性等(图1)。
病例报道
一例BRCA2突变局部进展期前列腺癌经帕米帕利+戈舍瑞林缓释微球+NHA三联新辅助治疗后实现深度缓解
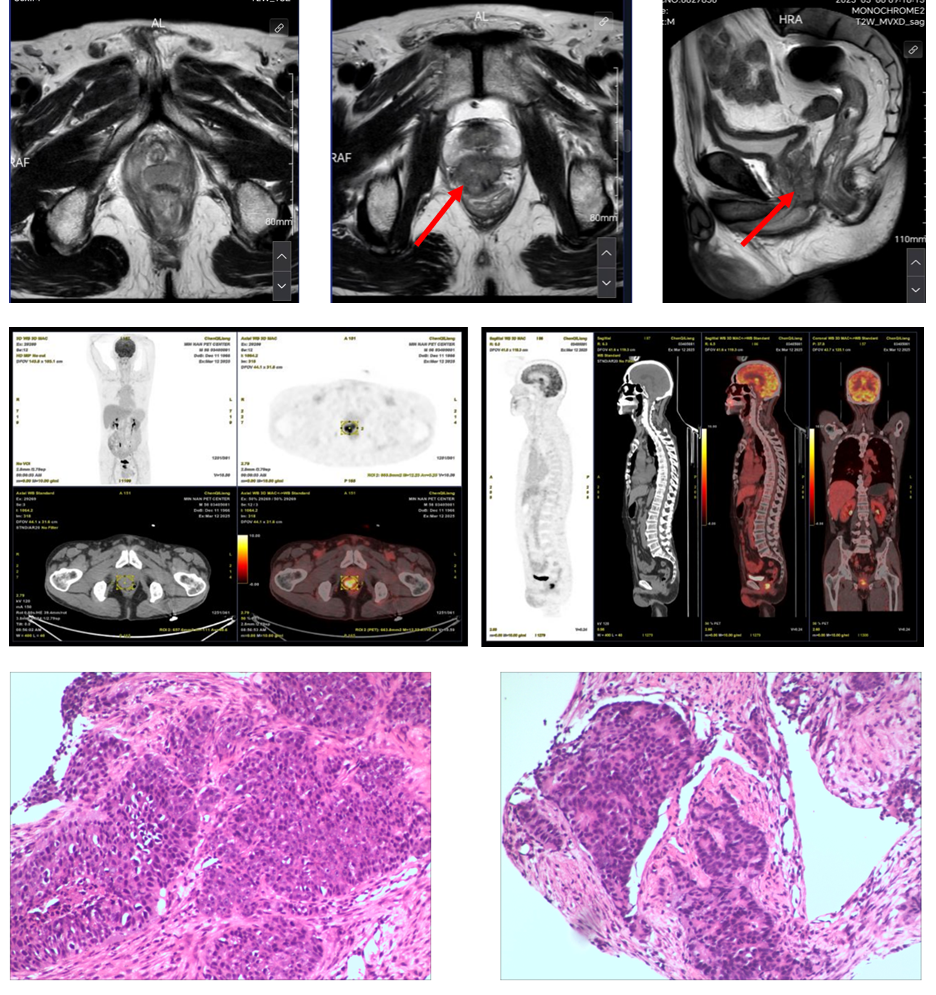
本例患者男,58 岁,有糖尿病病史,血糖控制尚可,无明确前列腺癌家族史。2025年3月因“进行性排尿困难1年”就诊当地医院,入院后查肿瘤标记物发现PSA 0.96ng/ml。直肠指检提示前列腺明显增大、质地偏硬、表面可触及多个结节。MRI扫描显示前列腺大小约4*4.4*3.8cm,外周带多发团块状异常信号,累及直肠,PI-RADS评分5分。PET-CT检查显示前列腺右叶外周带高代谢结节,考虑肿瘤性病变侵及直肠可能,盆腔多发稍大淋巴结,转移待排。经前列腺穿刺活检证实为前列腺腺泡腺癌,Gleason评分5+4=9分(ISUP 5级)(图2)。综合临床及影像学资料,诊断为前列腺癌,cT4N1M0(IV期)。基因检测提示BRCA2及其相关通路存在多基因致病性改变,提示同源重组修复(HRR)功能受损,符合PARP抑制剂潜在获益的分子亚型。结合本例cT4N1M0的局部肿瘤负荷较高及BRCA2/HRR缺陷这一高风险生物学特征,可推测其疾病进展与复发/转移风险相对更高。鉴于患者仍处于可手术窗口期,拟采用以PARP抑制剂为核心、联合雄激素受体(androgen receptor,AR)通路深度抑制的精准新辅助强化策略,以期获得更深层次的肿瘤学缓解、降低潜在微小残留负担,并优化后续根治性切除的局部条件与病理学结局。在此依据下,患者符合SEGNO研究BRCA1/2突变队列的入组标准,经多学科团队(multidisciplinary team,MDT)讨论后纳入该队列并启动新辅助三联治疗方案。
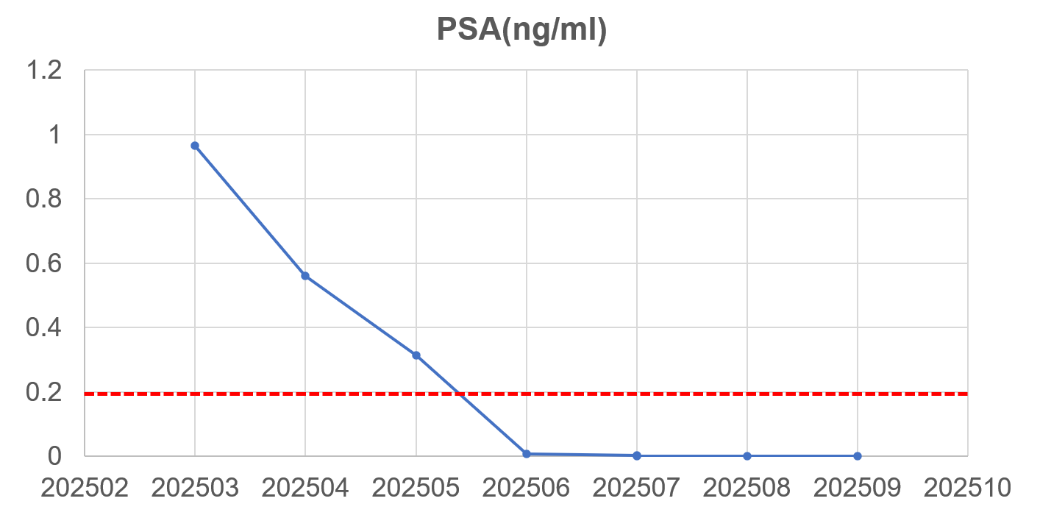
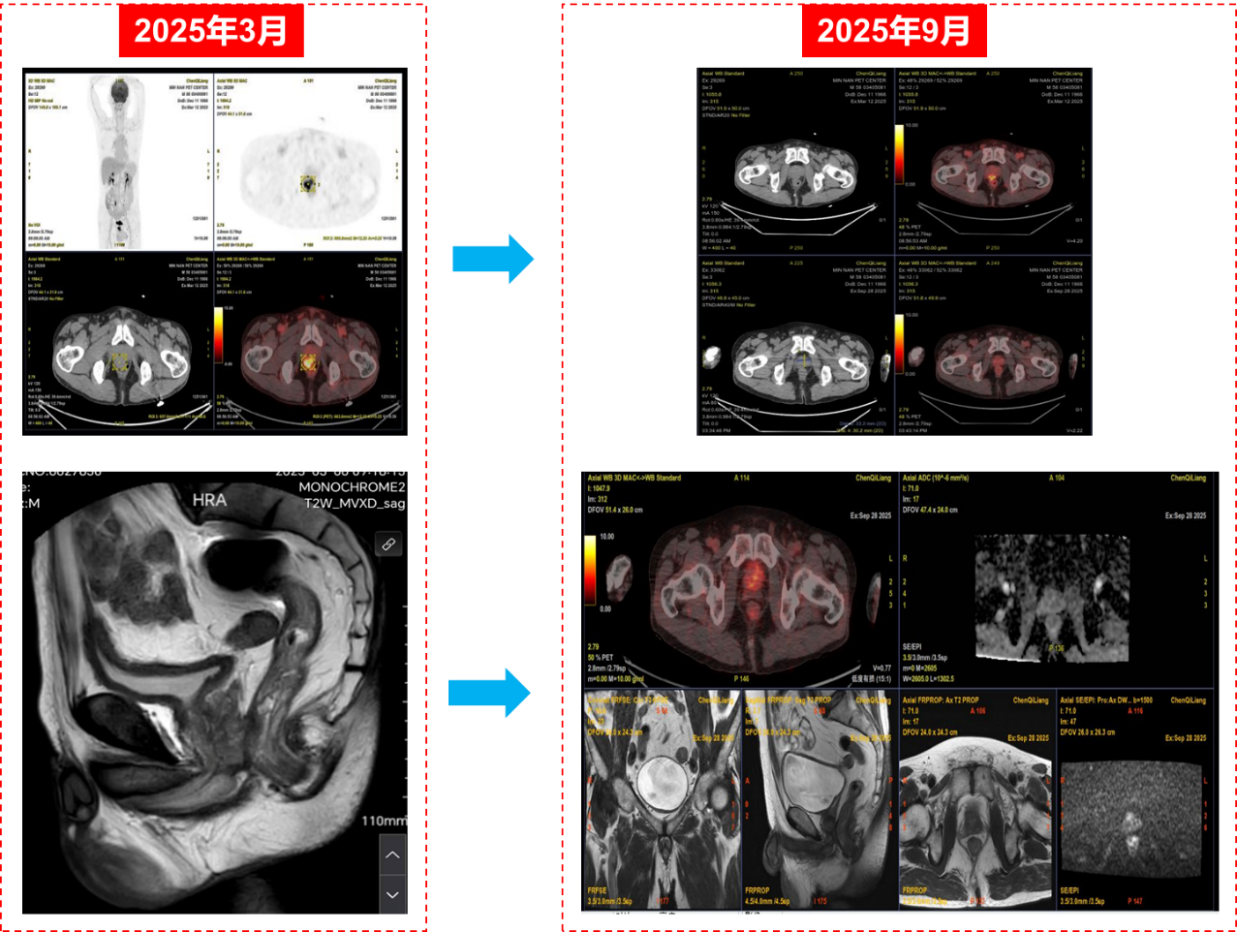
根据SEGNO研究预设方案,患者接受NHA + ADT + PARP抑制剂的新辅助三联治疗,具体用药为:瑞维鲁胺 240 mg 口服 每日一次+戈舍瑞林缓释微球 3.6 mg 肌内注射,每 4 周一次+帕米帕利 60 mg 口服 每日两次。整个新辅助治疗历时约6个月,期间患者总体耐受性良好,未出现剂量限制性毒性。随访过程中PSA水平迅速下降并维持在不可测水平(图3);新辅助治疗结束时复查PSMA PET/CT未见前列腺原发灶、盆腔淋巴结及远处骨骼异常摄取灶,与基线相比病灶代谢信号基本消失,影像学评估达到临床完全缓解(cCR)(图4)。
新辅助治疗结束并经术前评估确认具备手术条件后,患者接受机器人辅助根治性前列腺切除术联合盆腔淋巴结清扫。术中未观察到显著治疗相关纤维化黏连或广泛肿瘤浸润,手术顺利完成,术后恢复平稳。术后病理检查显示前列腺标本内仅残留极少量散在癌细胞,瘤床肿瘤细胞减少>90%,肿瘤负荷较基线显著下降,切缘阴性,盆腔淋巴结未见癌转移,病理学评估显示达到病理最小残留病灶(pMRD),并接近病理完全缓解(pCR)。综合术前cT4N1M0分期、BRCA2/HRR通路致病性改变这一高风险生物学背景及新辅助后PSMA PET/CT评估为cCR的结果,本例呈现影像学与病理学一致的深度缓解(pMRD,近pCR)。该个案提示在BRCA2/HRR缺陷亚组中,PARP抑制剂参与的分层三联新辅助策略可获得早期深度肿瘤学缓解,并可能预示更有利的长期结局,尚需进一步随访数据加以验证。同时,本病例亦为SEGNO研究所采用的基因分层新辅助治疗路径提供了临床层面的支持性证据。
作者述评
主任医师,医学博士,硕导
中国抗癌协会泌尿系统肿瘤专委会委员
中国抗癌协会生育力保护专委会委员
中国抗癌协会前列腺癌整合防筛专委会委员
中国医师协会(CUDA)膀胱癌学组委员
海峡两岸医药卫生交流协会泌尿外科专委会(CSCU)单孔学组副组长
福建省抗癌协会泌尿男生殖系肿瘤协会委员
福建省基层卫生协会基层泌尿疾病防治专业委员会常委
厦门市医学会泌尿外科学分会委员
新加坡中央医院泌尿外科中心高级访问学者
《JCO中文版-泌尿男生殖系统肿瘤专刊》编委
从现有证据综合来看,本例BRCA2突变局部进展期前列腺癌在SEGNO研究框架下获得临床与病理深度缓解,与近年来多项前列腺癌新辅助研究的结果具有一定一致性。FAST-PC研究中,氟唑帕利联合阿比特龙的新辅助治疗在高危局限期人群中取得了较高的pCR/pMRD率(46%),尤其在伴HRR/BRCA2改变的患者中表现出更深度的PSA下降缓解;南京鼓楼医院开展的帕米帕利+阿比特龙+ADT前列腺癌新辅助研究同样观察到相当比例的患者实现pCR/pMRD(27.5%)和病理降期(62%),且毒性谱可管理[5]。这些研究共同提示:在经严格筛选的高危局限性前列腺癌患者中适度强化全身系统治疗,有望显著提升病变局灶与潜在微小残留灶的应答缓解。本例在cT4N1M0且合并BRCA2通路致病变异的背景下,经帕米帕利+瑞维鲁胺+戈舍瑞林缓释微球三联新辅助治疗后达到PSMA PET/CT评估的cCR,并获得接近pCR的病理学缓解,为PARP抑制剂联合强化内分泌方案在此类人群中的应用提供了具有代表性的临床实例。
与以高危局限期为主的FAST-PC及南京鼓楼医院队列相比,GUNS研究的创新在于在新辅助阶段引入“伞式”设计,根据BRCA/DDR、PTEN、PI3K/AKT等分子特征进行预先分层,并分别匹配不同的强化组合,在以雄激素受体(AR)通路抑制为基础的三联方案中探索病理缓解率的改善趋势。SEGNO研究在此基础上进一步将研究人群扩展至局部进展期及寡转移前列腺癌,将BRCA1/2突变、非BRCA的DDR突变、MSI-H/TMB-H/CDK12 失活以及未检测到可选靶点等四类生物标志物队列纳入同一研究平台,分别匹配PARP抑制剂、含铂化疗、免疫检查点抑制剂和多西他赛三联方案,在统一的围手术期路径下进行系统评价。与传统仅按临床分期进行“统一方案”新辅助策略相比,这种“基因分层+治疗匹配”的设计更加贴近前列腺癌本身的生物学异质性,也为后续在不同分子亚型间比较长期结局差异奠定了方法学基础。
从精准医疗的视角来看,本病例最具启示意义之处在于:其深度肿瘤学应答并非单纯依赖“治疗强度”,而是特定分子亚型与治疗方案精准匹配的结果。对于BRCA1/2突变/HRR缺陷这一亚组而言,既往研究与临床观察普遍提示其生物学行为更具侵袭性,复发与远处进展风险更高[6-7];一旦进入系统性进展阶段,后续治疗序贯的复杂度与不确定性亦随之增加。因此,该亚组围手术期治疗策略的关键不在于采取统一的强化策略,而在于基于分子特征前移精准强化,以最大化早期深度缓解并尽可能降低潜在微小残留负担。机制层面,BRCA2介导的同源重组修复缺陷为PARP抑制剂提供了明确的生物学干预基础;同时,新型内分泌药物(NHA)联合雄激素剥夺治疗(ADT)可进一步强化雄激素受体信号轴抑制,二者联用具有潜在协同抑制肿瘤细胞存活与进展的可能。在SEGNO研究BRCA1/2队列既定框架下,本例接受PARP抑制剂参与的三联新辅助治疗后,达到PSMA PET/CT评估的临床完全缓解(cCR),并在根治性切除标本中获得病理最小残留病灶(pMRD),近pCR水平的病理学缓解,呈现“影像学—病理学一致”的深度缓解特征。该个案从临床层面支持了在BRCA2/HRR缺陷这一高风险亚组中实施分层精准新辅助强化的可行性,并提示在可手术窗口期实现更深层次的肿瘤减负、提高根治性切除(R0)可行性/切缘阴性率,可能有助于降低术后救治性治疗负担,为长期结局获益奠定更有利的基础。
当然,作为单中心、小样本的探索性IIT,SEGNO研究目前仍处于继续入组、随访积累与数据成熟阶段,尚难以回答不同分子亚型之间OS、PFS等长期结局差异以及最佳治疗持续时间等关键问题。后续有必要在更大规模、多中心前瞻性研究中,结合组织学病理、ctDNA(circulating tumor DNA)/循环肿瘤细胞(circulating tumor cells,CTC)以及纵向PSMA PET/CT评估,系统评估新辅助三联方案对“病理完全缓解(pCR)/微小残留病灶(MRD)—转移复发—生存结局”整个演变过程的影响。即便如此,SEGNO研究通过标准化的分子检测流程、明确界定的四个生物标志物队列以及围手术期一体化治疗路径,已初步展示出一种具有较强可复制性和方法学借鉴意义的研究范式:在前列腺癌新辅助领域,从“经验性强化”逐步迈向“基因分层指导下的精准三联治疗”,不再仅仅回答“是否需要新辅助”,而是进一步聚焦于“适宜获益人群的识别以及治疗方案的优化”等关键问题。这一转变,正是当前泌尿肿瘤学向精准治疗与全程管理持续推进的重要方向。
[1] Huang H, et al. Safety and efficacy of genomic biomarker-guided neoadjuvant therapy for locally advanced and oligometastatic prostate cancer (SEGNO): study protocol for an open-label prospective phase II umbrella clinical trial. BMC Cancer. 2025 Mar 10;25(1):432
[2] Eastham JA, et al. Cancer and Leukemia Group B 90203 (Alliance): Radical Prostatectomy With or Without Neoadjuvant Chemohormonal Therapy in Localized, High-Risk Prostate Cancer. J Clin Oncol. 2020 Sep 10;38(26):3042-3050.
[3] Zhang T, et al. Neoadjuvant fuzuloparib combined with abiraterone for localized high-risk prostate cancer (FAST-PC): A single-arm phase 2 study. Cell Rep Med. 2025 Mar 18;6(3):102018.
[4] Martin Gleave, et al. Genomic alterations and their pathologic responses in high-risk localized prostate cancer (HRLPC) in subprotocol 1 of the Genomic Umbrella Neoadjuvant study (GUNS). 2025 ASCO GU Abs403.
[5] Junlong Zhuang, et al. Neoadjuvant pamiparib plus abiraterone and ADT for high-risk/very high-risk localized prostate cancer: Results of a prospective study. 2024 ASCO GU Abs327.
[6] Olmos D, et al. BRCA1/2 and homologous recombination repair alterations in high- and low-volume metastatic hormone-sensitive prostate cancer: prevalence and impact on outcomes. Ann Oncol. 2025 Oct;36(10):1190-1202.
[7] Bilen MA, et al. Comparison of Real-World Outcomes between Patients with BRCA1/2-Positive and Homologous Recombination Repair-Negative Metastatic Castration-Sensitive Prostate Cancer. Adv Ther. 2025 Aug;42(8):3945-3959.
排版编辑:肿瘤资讯-Sally











 苏公网安备32059002004080号
苏公网安备32059002004080号


