
2025年,巴塞罗那临床肝癌小组(BCLC)发布了其最新的肝细胞癌(HCC)预后评估与治疗推荐策略更新。本次更新延续了BCLC系统一贯的科学性与实用性,旨在将近年来不断涌现的新证据整合进已有的分期框架中,以便为全球临床医生提供更具操作性的决策依据。与2022年版本相比,2025年版并未对BCLC分期结构进行根本性改动,但在多个关键领域进行了精细化调整,尤其在对BCLC-B期(中期)肝癌的定义、治疗选择的个体化推荐以及面对不确定性时的决策支持方面,引入了全新的CUSE框架(复杂性、不确定性、主观性、情绪性),以更好地指导多学科团队在复杂临床情境下做出以患者为中心的决策。
BCLC系统自2000年首次提出以来,已成为全球范围内最具权威性的肝癌分期与治疗推荐体系之一。其核心优势在于将肝癌患者的预后评估与治疗选择紧密结合,依据肿瘤负荷、肝功能状态与患者体能状况三大关键因素,将患者划分为五个不同的临床阶段(0、A、B、C、D),并为每一阶段推荐最具循证依据的首选治疗方案。2025年更新版继续保留了这一结构,但在细节处理上更加精准。例如,在BCLC-B期的定义中,2025版明确将“多发病灶”细化为“超过3个肿瘤结节,或≤3个结节但至少有1个直径>3厘米”,以避免以往版本中因表述模糊而导致的临床误判。
在BCLC-0期(极早期)与A期(早期)患者中,治疗选择的核心仍围绕肝移植、肝切除与局部消融展开。2025版强调,若患者无明显门静脉高压(CSPH),肝切除仍是首选方案,尤其在肿瘤位于肝脏外周、残余肝功能充足的情况下,推荐采用微创方式进行切除。而对于存在CSPH的患者,则更倾向于选择肝移植,若移植不可行,则局部消融(如射频消融或微波消融)成为主要替代手段。值得注意的是,2025版首次将立体定向放疗(SBRT)与经动脉放射栓塞(TARE)纳入BCLC-0/A期的可选治疗方案,前提是患者不适合手术或消融,且治疗中心具备相应技术能力。这一变化反映了近年来放射治疗在早期肝癌中积累的积极数据,尤其在肿瘤位置复杂或患者合并症较多的情况下,SBRT与TARE提供了新的可能性。
进入BCLC-B期,治疗选择的复杂性显著增加。2025版明确指出,TACE(经动脉化疗栓塞)仍是该阶段的标准治疗手段,尤其适用于肝功能良好、肿瘤分布较为局限的患者。然而,若患者存在弥漫性、浸润性或多灶性病变,TACE的疗效可能受限,此时应优先考虑系统治疗。2025版特别强调,TACE与系统治疗的界限并非绝对,CUSE框架在此过程中发挥关键作用。CUSE不仅帮助医生识别治疗失败的风险因素(如肿瘤异质性、肝功能边缘状态、患者意愿等),还鼓励团队在证据不足或治疗方案难以权衡时,采用“时间限定性治疗”策略,例如先尝试TACE,若短期内出现不可控进展,则迅速转向系统治疗。
在系统治疗方面,2025版BCLC策略全面更新了BCLC-C期(晚期)患者的治疗推荐。免疫联合治疗已成为该阶段的首选方案,尤其是阿替利珠单抗联合贝伐珠单抗、度伐利尤单抗联合替雷利珠单抗、以及伊匹木单抗联合纳武利尤单抗等方案,均已在全球范围内显示出优于传统靶向药物索拉非尼的总生存期(OS)获益。2025版指出,在选择具体方案时,应结合患者的肝功能状态、合并症、药物可及性与个人意愿进行综合评估。CUSE框架在此阶段的应用尤为关键,因其不仅帮助医生权衡不同方案之间的疗效差异,还鼓励团队与患者共同设定治疗目标(如延长生存、控制肿瘤、维持生活质量等),并在治疗过程中定期回顾与调整。
值得一提的是,2025版对“治疗阶段迁移”(Treatment Stage Migration, TSM)的概念进行了进一步拓展。TSM指的是患者在治疗过程中因肿瘤反应、肝功能变化或主观意愿等因素,从一个BCLC阶段迁移至另一个阶段,从而获得原本不属于该阶段的治疗机会。例如,部分BCLC-C期患者在接受免疫治疗后出现显著肿瘤缩小,进而被重新评估为可切除或可进行肝移植的状态。2025版指出,这种“治疗性转化”虽未在前瞻性研究中得到充分验证,但在临床实践中已显示出潜在价值,应在CUSE框架下进行个体化评估与决策。
此外,2025版还对BCLC-D期(终末期)患者的管理提出了更为人性化的建议。该阶段患者通常伴有严重肝功能失代偿或明显癌症相关症状,治疗目标应以缓解症状、提供心理支持与优化生活质量为主。2025版强调,部分D期患者仍可能通过治疗基础肝病(如抗病毒治疗、戒酒等)实现“再代偿”,从而重新获得接受抗肿瘤治疗的机会。因此,D期并非绝对终点,而应根据患者具体情况进行动态评估。
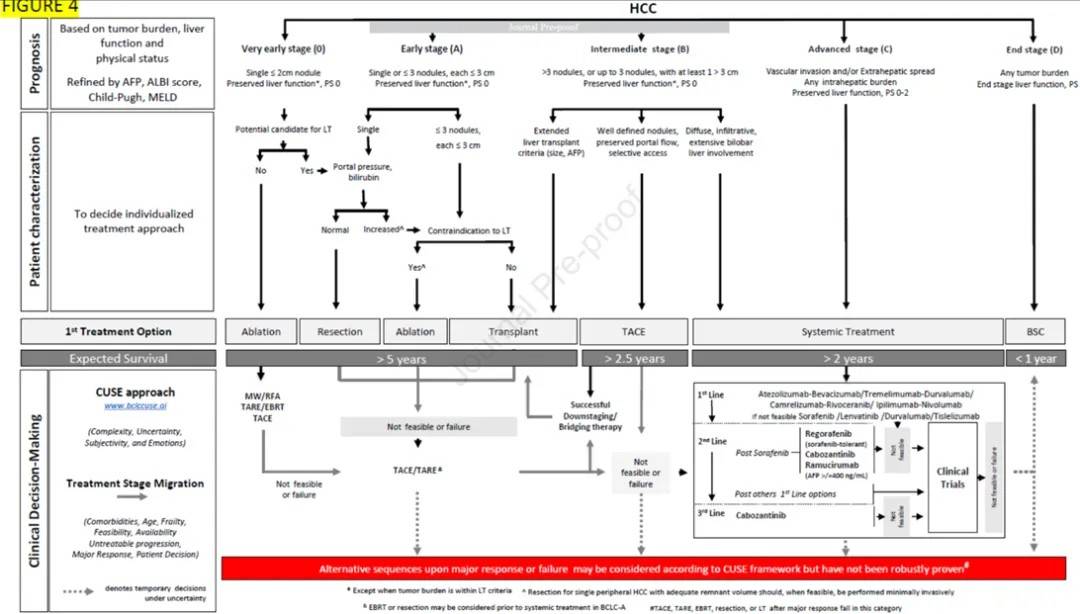
图4. 2025年BCLC分期与治疗策略
BCLC系统根据与一线治疗推荐相绑定的5个分期来判定预后,各期预期结局以现有科学证据所支持的肿瘤阶段中位生存期表示。截至2025年8月5日的现有数据要求治疗团队整合所有可获得的信息,并结合每位患者的具体病情进行个体化临床决策。需要注意的是,肝功能评估应超越传统的Child-Pugh分级。
缩写:AFP:甲胎蛋白;ALBI:白蛋白-胆红素评分;BCLC:巴塞罗那临床肝癌分期;BSC:最佳支持治疗;CUSE理念:临床决策过程中涉及的复杂性、不确定性、主观性与情绪性因素;EBRT:体外放射治疗;ECOG PS:美国东部肿瘤协作组体能状态评分;LT:肝移植;MELD:终末期肝病模型评分;TACE:经动脉化疗栓塞;TARE:经动脉放射栓塞;ST:系统治疗
* 肿瘤负荷符合移植标准者除外
^ 对位于外周、单发且残余肝体积足够的HCC,可行微创手术切除
ç TACE属非消融性治疗
& BCLC-A期可在系统治疗前酌情考虑EBRT或切除
# 免疫联合治疗(ICI)后获得显著缓解者,后续TACE、TARE、EBRT、切除或LT均归入此类
虚线箭头指向"临床决策"章节,提示某些治疗序列或可暂时跳过系统治疗;然而,这并非普遍推荐,而是在证据有限与存在不确定性时的权宜之计。
在整个2025版BCLC策略中,CUSE框架的引入无疑是最具创新性的部分。CUSE并非一套刚性规则,而是一种结构化思维方式,旨在帮助临床团队在面临证据缺口、治疗选择复杂或患者意愿多元时,仍能做出科学、透明且以患者为中心的决策。CUSE强调四个核心维度:复杂性(多重合并症与治疗方案交织)、不确定性(预后不明或证据不足)、主观性(患者与医生对信息的理解差异)与情绪性(患者情绪、信仰、期望对决策的影响)。通过系统性地评估这些因素,CUSE鼓励医生与患者共同制定“最优”而非“最佳”方案,并在治疗过程中设定复查节点,以便根据新证据或病情变化及时调整策略。
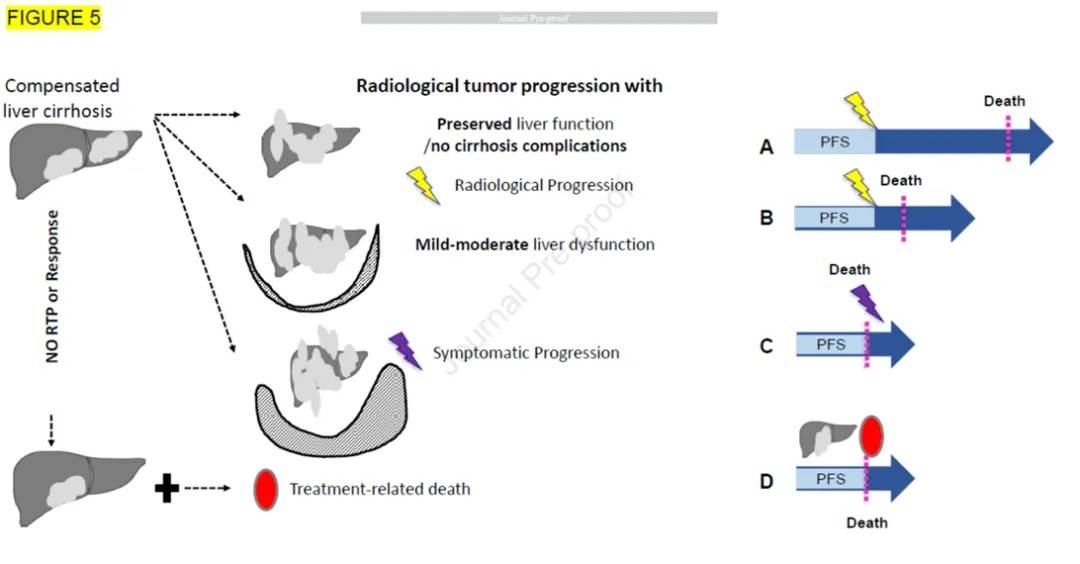
图5. 无进展生存期作为总生存期替代指标的局限性
同样的无进展生存期(PFS)区间可能预示着截然不同的结局,这取决于其定义事件的具体性质。在图A中,PFS同样以肿瘤进展为终点,但此类进展呈惰性模式,对长期生存并无实质性影响,总生存期(OS)仍维持较长。在图B中,PFS的终点是直接导致死亡的疾病进展,OS因此显著缩短;图中阴影区域代表根据具体情境可能出现的水肿或腹水。图C所示的进展则体现了肿瘤的高度侵袭性,其后OS迅速下降。而在图D中,PFS因治疗相关毒性及死亡而终止,这一结局与肿瘤本身行为完全无关,凸显了事件类型如何同时决定患者体验与最终预后。
缩写:PFS,无进展生存期;OS,总生存期;RTP,影像学肿瘤进展。
图B中的阴影区域依据具体情境可指瘤周水肿或腹水,而非肝硬化本身的并发症。
为了便于CUSE框架的推广与标准化,BCLC小组还开发了一个在线决策支持平台(www.bclccuse.ai),该平台集成了最新循证数据、治疗指南与个体化评估工具,旨在为不同资源背景下的医疗团队提供可操作的决策辅助。2025版指出,CUSE的实施效果仍需通过前瞻性研究加以验证,但其初步应用已显示出在提升决策一致性、减少医疗纠纷与改善患者满意度方面的潜力。
综上所述,2025年BCLC更新版在保持原有系统简洁性与科学性的基础上,进一步细化了对各期肝癌患者的个体化治疗推荐,尤其在BCLC-B期的界定、系统治疗的排序、治疗性转化的探索以及终末期患者的管理方面,均体现出更强的临床适应性与人文关怀。CUSE框架的引入不仅为临床医生提供了面对复杂决策时的思维工具,也为未来肝癌治疗的精准化、个性化与多学科协作奠定了坚实基础。随着更多高质量研究的开展,BCLC系统将在不断演进中继续引领全球肝细胞癌治疗的规范化与标准化进程。
排版编辑:肿瘤资讯-as











 苏公网安备32059002004080号
苏公网安备32059002004080号


