乳腺癌是全球女性发病率最高的恶性肿瘤[1]。与此同时,随着老龄化趋势的加速和生活方式的改变,我国女性乳腺癌的发病死亡人数预计将持续上升。其中老年女性乳腺癌发病数和死亡数预计将分别增加40%和52%[2],60岁及以上人群中乳腺癌所致疾病负担呈现明显上升趋势[3]。
高达70%的乳腺癌患者被确诊为激素受体阳性(HR+)且人表皮生长因子受体2阴性(HER2-)[4]。细胞周期蛋白依赖性激酶4/6(CDK4/6)抑制剂为晚期HR+乳腺癌一线标准治疗方案[5]。然而,老年乳腺癌作为一个特殊群体,治疗应兼顾合理性和特殊性,这对治疗策略的优化提出更高要求。
本期由东莞市人民医院张蓉医生分享一例72岁IV期HR+/HER2-乳腺癌患者的诊疗经过,该患者因右乳肿物破溃半年入院,诊断为右乳浸润性癌伴肺转移(T4N1M1 Ⅳ期 LuminalB1型),接受瑞波西利联合内分泌治疗方案后实现PR,达到理想疗效,特邀中山大学孙逸仙纪念医院曾银朵教授对该病例的诊疗进行专业点评。
病例简介
基本情况
基本信息:患者女,72岁 。
主诉:右乳肿物3年余,破溃半年余。
现病史:
2025年5月5日,患者因右乳肿物破溃半年入院。
入院查体: 双乳外观欠对称,双乳头欠齐平,右乳头内陷,指向外上,无溢血及溢液,酒窝征(-),左乳未及明显肿物,右乳外上象限可及一肿物,大小约6.0×4.0cm,质硬,界欠清,活动差,压痛(-),与胸壁有粘连,皮肤破溃渗液渗血。右腋下可及直径约2.0cm肿大淋巴结。左腋下及双侧锁骨上下窝未及肿大淋巴结。

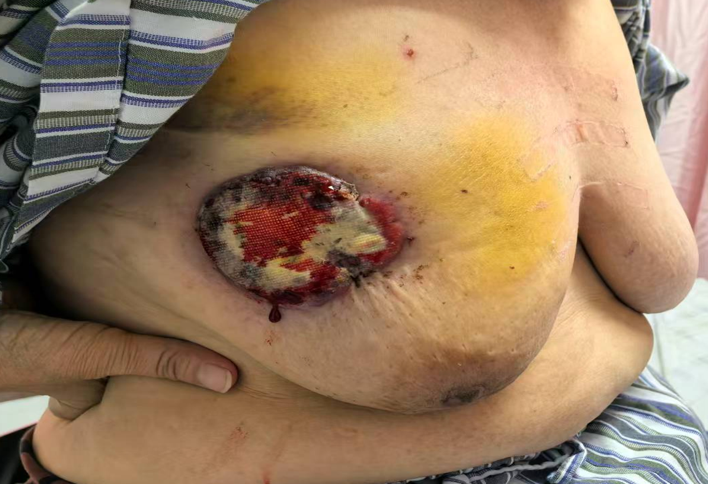
婚育史:适龄结婚,G1P1A0,50岁绝经
家族史:否认家族肿瘤及遗传病史
诊治经过
辅助检查:
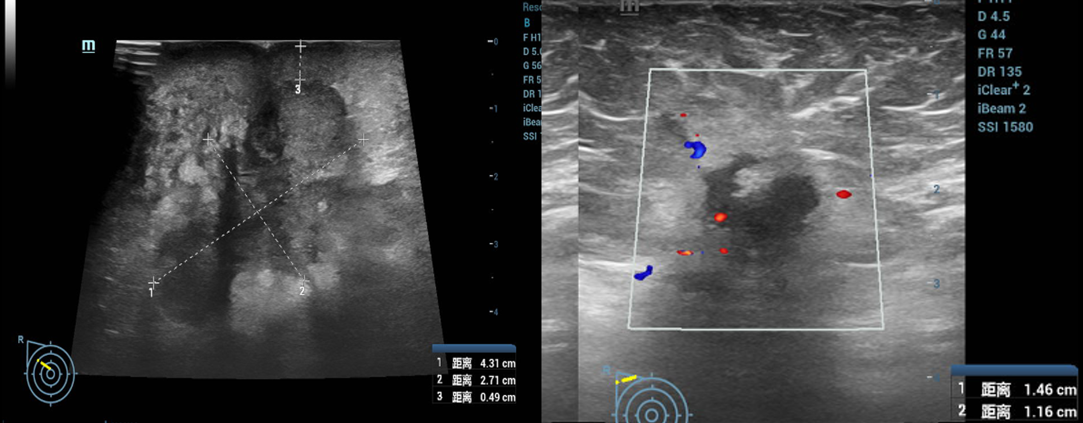
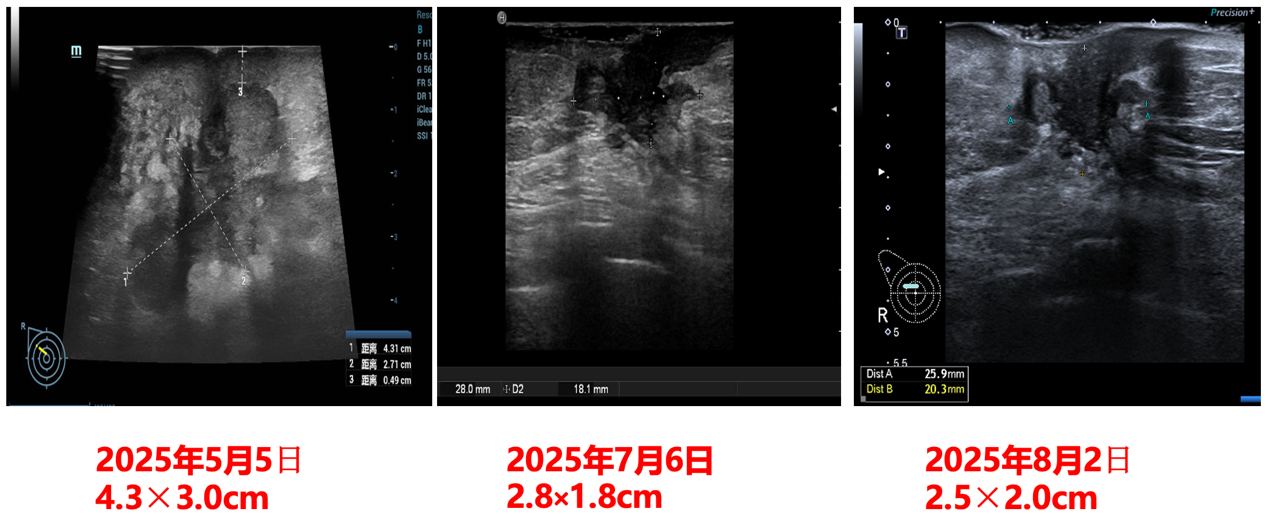
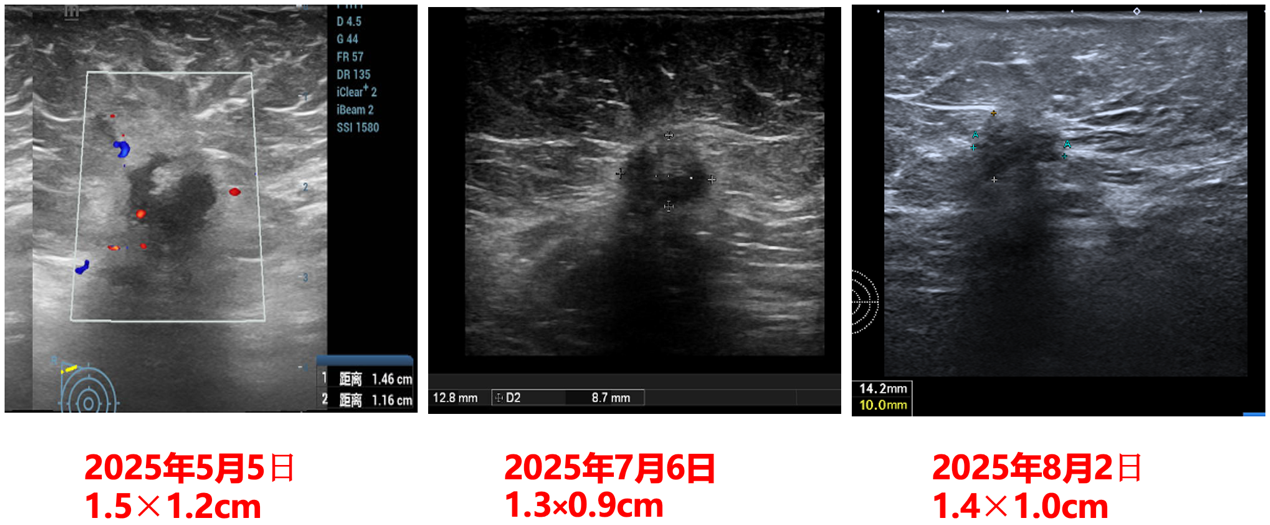
(2025-5-5)乳腺及腋窝淋巴结(双侧)浅表脏器彩超检查:1.右乳腺外上实性占位:考虑乳腺癌(4.3×3.0cm),符合BI-RADS 5类;2.右腋窝多发淋巴结肿大,考虑转移可能(1.5×1.2cm)。
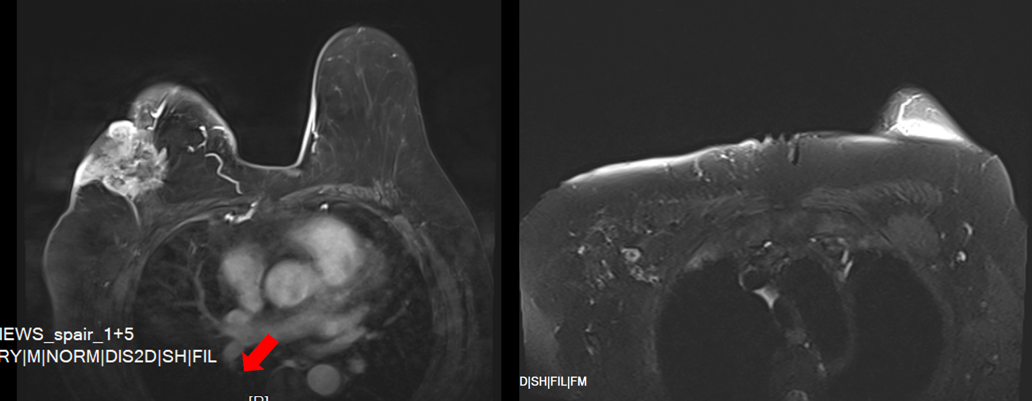
(2025-5-5)乳腺及腋窝淋巴结(双侧)MRI检查:1.右乳外上肿块4.6x5.1×3.9cm,MRI-BI-RADS V类。2.右腋窝淋巴结肿大:考虑癌转移(1.7×1.5cm)。
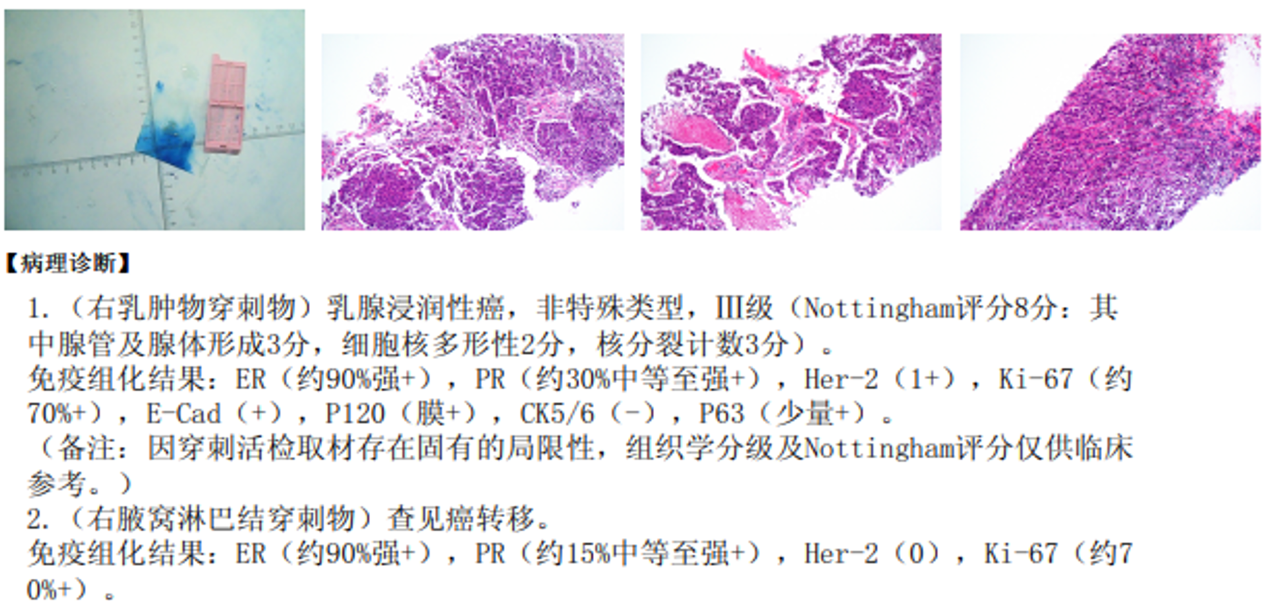
(2025-5-7)超声下右乳肿物、右腋窝淋巴结穿刺活检术(结果见下):
(2025-5-8)全身PET-CT检查:1.右侧乳腺外上象限软组织肿块,糖代谢增高,考虑乳腺癌,侵犯邻近右乳皮肤,与邻近右侧胸大肌可疑粘连,右乳头及乳晕、周围皮肤增厚,糖代谢增高,请结合临床。右侧腋窝多发高代谢淋巴结转移。2.双肺散在多发结节,糖代谢增高,考虑转移。
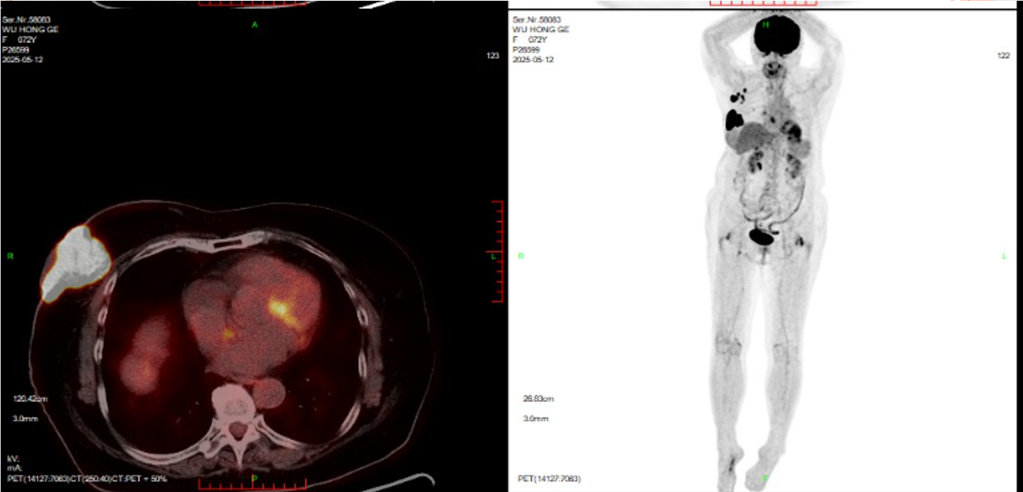
(2025-5-13)胸外科会诊:

诊断:
1. 右乳浸润性癌 非特殊类型 伴肺转移
2. T4N1M1 Ⅳ期 Luminal B1型
治疗方案:
1. 瑞波西利 (600mg,每3周停1周)
2. 来曲唑 (2.5mg qd)
安全性评估及监测:
1. 治疗期间每两周监测血常规,肝功能。
2. 每1个月复查乳腺B超、心电图,
3. 每三个月复查胸部CT,乳腺MRI。
疗效评价:部分缓解(PR)
乳腺彩超检查结果前后对比:
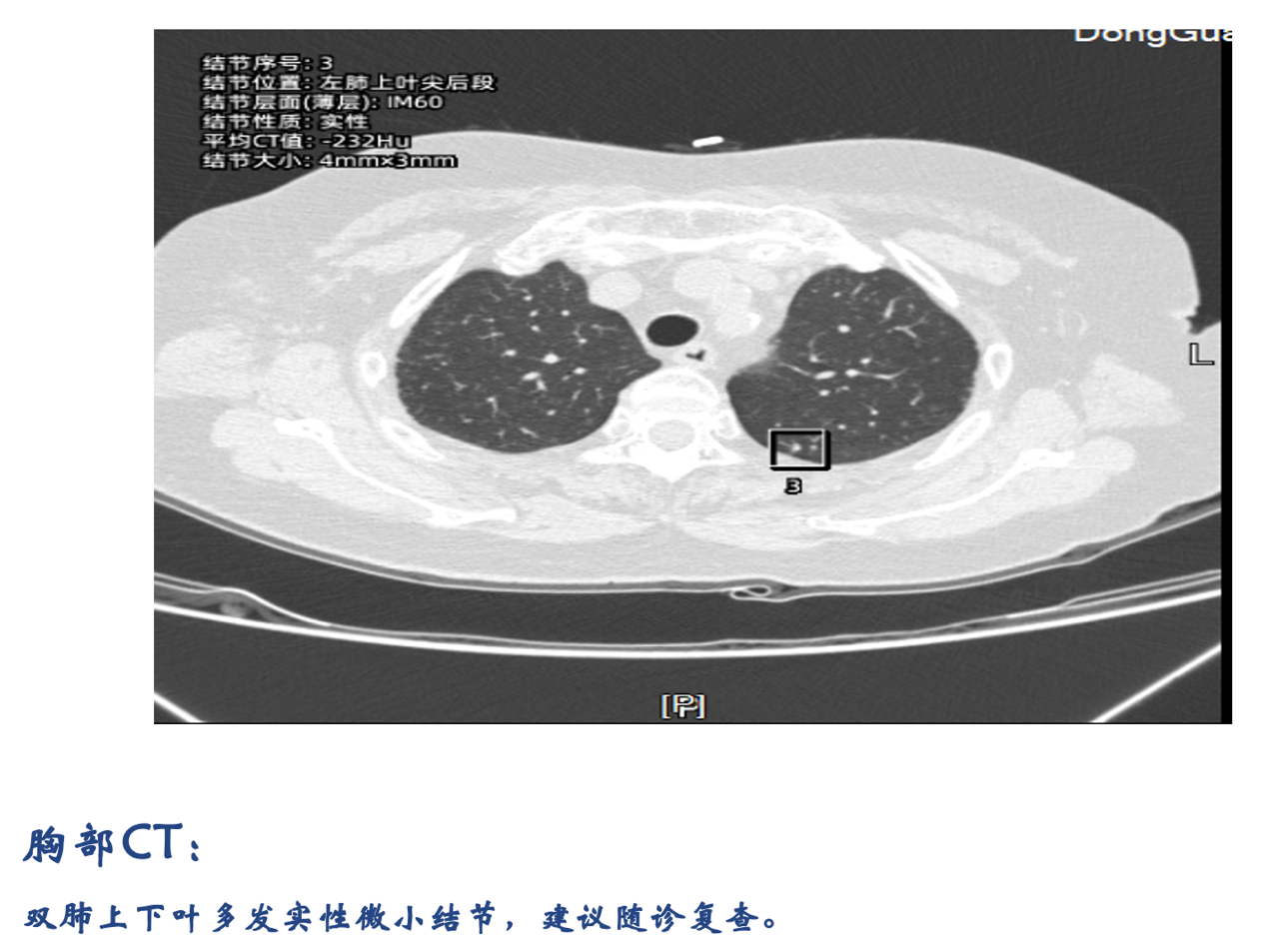
胸部CT检查结果:
查体结果前后对比:
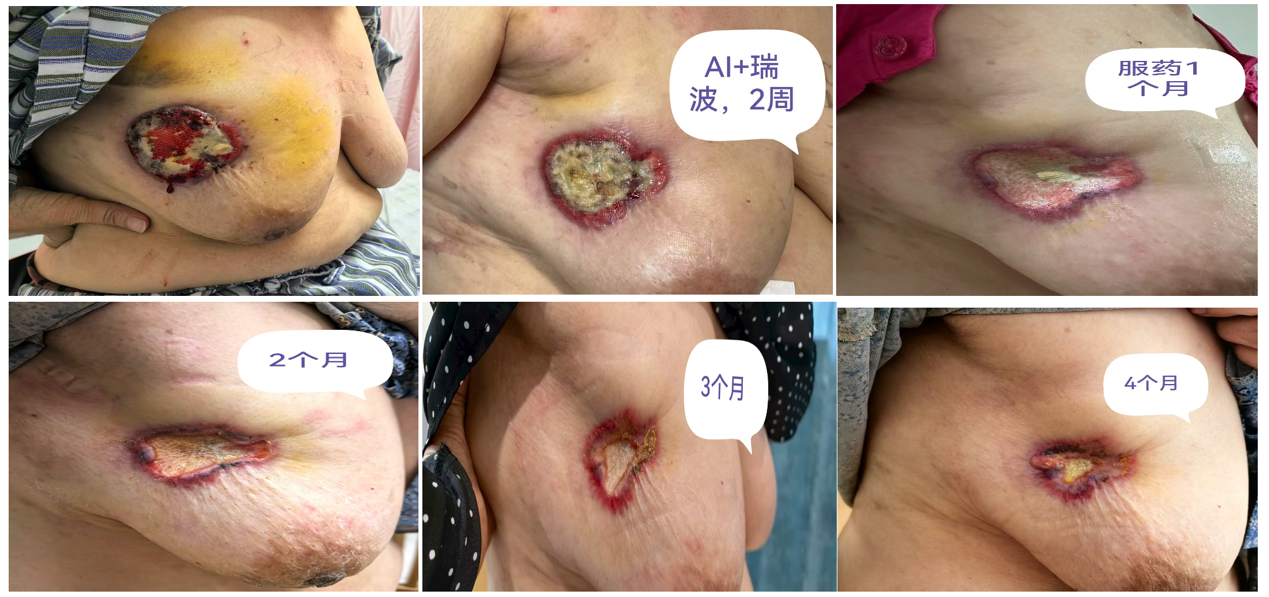
安全性评估:主要不良反应为2级白细胞及中性粒细胞减少,未出现严重不良事件;肝功能及心电图未见异常。
专家点评
乳腺癌是女性最常见的癌症,乳腺癌对我国居民造成的寿命缩短和残疾等严重影响了患者的生命质量[6]。随着人口老龄化,乳腺癌中位发病年龄有逐渐增大的趋势,中国>65岁老年女性患者有11.1%患乳腺癌,发病率约64/10万[6,7]。2008年的数据表明,中国16.6%的乳腺癌患者年龄≥65岁,预计到 2030 年会提高到27.0%[6,8]。老年乳腺癌有其自身特点,老年患者常伴发多种疾病,且自然年龄相同患者的生物学年龄差别较大, Luminal 型比例更高[6]。此外,老年患者还存在治疗相关的风险,因此,老年乳腺癌作为一个特殊群体,治疗应兼顾合理性和特殊性[6]。
内分泌治疗副反应低、耐受性好。对于HR+老年晚期乳腺癌患者,基于循证医学证据和指南推荐,一线推荐CDK4/6抑制剂联合内分泌治疗[5]。针对绝经后HR+/HER2-晚期乳腺癌患者的Ⅲ期随机对照试验MONALEESA-2研究提示,相较于内分泌单药治疗,CDK4/6抑制剂瑞波西利联合来曲唑可实现无进展生存期(PFS)、总生存期(OS)双重获益:与安慰剂+来曲唑组相比,瑞波西利+来曲唑组的PFS显著较长(25.3个月vs.16.0个月;OS达63.9个月,较安慰剂组的51.4个月显著延长12.5个月,死亡风险降低24%(HR=0.76,P=0.008),且6年OS率提升至44.2%(安慰剂组为32.0%)[9]。同时,按患者和疾病特征、地理区域、既往治疗和转移部位定义的探索性患者亚组进行OS分析,获益与总体人群的结果一致。这一长期生存优势是其他CDK4/6抑制剂在HR+晚期一线治疗领域至今尚未实现的。
此前,临床也有部分观点认为,对于内脏转移且需要快速减轻肿瘤负荷的患者,化疗也不失为一项治疗选择。然而针对这一问题,瑞波西利联合内分泌治疗“头对头”对比化疗方案的Right Choice研究提示瑞波西利联合内分泌方案在晚期HR+治疗领域同样交付了理想答卷。该研究提示,中位随访24.1个月后10,瑞波西利组的中位PFS相较于化疗组延长近1年[10];接受瑞波西利治疗的患者疾病进展或死亡的风险显著降低了46%[10]。此外,与化疗组相比,瑞波西利组的ORR和CBR均有所提升;至缓解时间(TTR)也相似,这提示,在保证有效性和起效时间的前提下,瑞波西利联合方案可推迟患者接受化疗的时间,有效提升患者的生活质量,这无疑给担心化疗毒副作用的老年患者提供了更为优化的解决方案。
此外,对于晚期乳腺癌老年患者而言,“活得更好”与“活得更久”同样重要。欧洲肿瘤内科学会(ESMO)推出的临床获益量表(MCBS)评分为新型药物评价提供了持续更新的全面客观决策依据,在非治愈性疾病中,评估新型疗法相较于标准疗法需综合考虑生存期获益、毒性评估及生活质量改善等多维度。瑞波西利凭借在PFS、OS双重获益及生活质量改善方面的综合表现,成为目前在ESMO-MCBS评分中,相较同类CDK4/6抑制剂获最高评分的药物[11-13],反应出其疗效与生活质量的双重获益。
此病例患者为72岁HR+/HER2-晚期老年乳腺癌女性患者,并发肺转移,接受瑞波西利联合来曲唑一线治疗后,影像学检查显示乳腺病灶PR、肺结节缩小,查体见肿瘤短期内缩小,患者病情维持稳定,且治疗过程中未见严重不良反应。目前仍在定期继续瑞波西利靶向治疗中。该病例的临床转归与既往研究的疗效数据高度契合,为瑞波西利广泛用于临床实践进一步提供了真实世界印证。
专家简介
中山大学孙逸仙纪念医院 乳腺内科
广东省胸部肿瘤防治研究会乳腺肿瘤内科专业委员会,主任委员
中国医药卫生事业发展基金会乳腺肿瘤学组,常委兼秘书长
广东省药学会第二届肿瘤全程管理专家委员会,副主任委员
广东省卫生信息网络协会智慧肿瘤研究分会,副会长
广东省临床医学学会泛家族遗传性肿瘤防控专业委员会,常委
广东省胸部肿瘤防治研究会胸部肿瘤脑转移专业委员会委员
广东省抗癌协会乳腺癌专业委员会委员
中国抗癌协会肿瘤分子医学专业委员会委员
中国抗癌协会肿瘤标志专业委员会会员
主持国家自然科学基金青年基金1项
主持中山大学5010培育项目1项
主持逸仙临床研究培育项目1项
参加编写《临床肿瘤内科学》和《乳腺癌保乳治疗》
英国卡迪夫大学访问学者
参加多项国际及国内多中心临床研究
东莞市人民医院乳腺科 副主任医师 教学秘书
东莞市抗癌协会乳腺癌专业青年委员会常委
广东省老年保健协会乳腺疾病专业委员会常委
广东省中西结合学会乳腺病专业委员会委员
广东省中医药学会乳腺病专业委员会委员
广东省基层医药学会乳腺微创重建专业委员会委员
广东省保健协会乳腺保健分会委员
广州抗癌协会乳腺病专业委员会委员
东莞市肿瘤防治联盟乳腺癌专业委员会委员
[1] 何思怡,李贺,曹毛毛,等人. 全球及我国女性乳腺癌疾病负担年龄分布及变化趋势.中国肿瘤 2023;32(1):1-7.
[2] Shi Z,Lin J,Wu Y,et al. Burden of cancer and changing cancer spectrum among older adults in China: trends and projections to 2030[J]. Cancer Epidemiol,2022,76:102068.
[3] 张蒙,崔永春,王春平,等. 1990-2019 年中国女性乳腺癌疾病负担及其危险因素变化趋势分析[J]. 中华肿瘤防 治杂志,2022,29(7):456-462.
[4] https://seer.cancer.gov/statfacts/html/breast-subtypes.html.
[5]《中国临床肿瘤学会乳腺癌(CSCO BC)诊疗指南(2025版)》.
[6]王心丽 , 薛妍. 老年晚期乳腺癌的治疗探索[J]. 医药导报, 2024, 43(3): 360-365 https://doi.org/10.3870/j.issn.1004-0781.2024.03.005
[7]ARNOLD M, MORGAN E, RUMGAY H, et al. Current and future burden of breast cancer: global statistics for 2020 and 2040[J]. Breast, 2022, 66:15-23.
[8]FAN L, STRASSER-WEIPPL K, LI J J, et al. Breast cancer in China[J]. Lancet Oncol, 2014, 15(7):279-289.
[9] Hortobagyi GN, et al.N Engl J Med. 2022 Mar 10;386(10):942-950.
[10] Mahidin E, et al. 2022 SABCS GS1-10.
[11] https://www.esmo.org/guidelines/esmo-mcbs/esmo-mcbs-for-solid-tumours/esmo-mcbs-scorecards?scorecard=9.[MONALEESA-2]
[12] https://www.esmo.org/guidelines/esmo-mcbs/esmo-mcbs-for-solid-tumours/esmo-mcbs-scorecards?scorecard=159.[monarch 3]
[13] https://www.esmo.org/guidelines/esmo-mcbs/esmo-mcbs-for-solid-tumours/esmo-mcbs-scorecards?scorecard=7.[PALOMA-2]
[14] US Food and Drug Administration. Clinical trial endpoints for the approval of cancer drugs and biologics. Available at: https://www.fda.gov/media/71195/download. Accessed December.
[15] Matthew P, Masakazu T, Jens H, et al. 2023 SABCS. GS01-12.
[16] Hortobagyi GN, et al. N Engl J Med. 2022;386(10):942-950.
[17] Richard S. Finn, et al.N Engl J Med 2016;375:1925-1936.
[18] Yen-Shen Lu, et al. 2022 Mar 1;28(5):851-859.
[19] Bishal Gyawali, et al. Nat Rev Clin Oncol. 2022 Oct;19(10):613-614.
[20] Oosting SF, et al. Ann Oncol. 2023 Apr;34(4):431-439.
[21] https:// www.esmo.org/guidelines/ esmo-mcbs/ esmo-mcbs-for-solid-tumours/ esmo - mcbs-scorecards/scorecard-338-1. [NATALEE]
排版编辑:肿瘤资讯-CYX












 苏公网安备32059002004080号
苏公网安备32059002004080号


