2025年9月16日,备受瞩目的学术盛会“MDT中外面对面”顺利举行。会议汇聚上海交通大学附属胸科医院陆舜教授团队、新加坡国家癌症中心Kevin Lee Min Chua教授团队、南京医科大学第一附属医院郭人花教授团队和中山大学肿瘤防治中心杨弘教授团队等国内外顶尖肺癌研究团队,聚焦肺癌免疫治疗的最新进展,系统分析当前诊疗实践与未来研究趋势,助力该领域的学术交流与发展方向探索。【肿瘤资讯】特别整理会议精华内容,以飨读者。

NSCLC新辅助免疫治疗联合化疗——病例分享
本病例由新加坡国家癌症中心Kevin Lee Min Chua教授分享,具体诊疗过程如下:
病史资料
71岁男性
既往吸烟史(40包年,戒烟12年),无饮酒史。家族中有肿瘤史,母亲、哥哥及姐姐均患有结肠癌。
曾患高脂血症、结肠憩室病。
2023年9月,因血尿入院检查时,偶然发现肺部占位性病变。
辅助检查
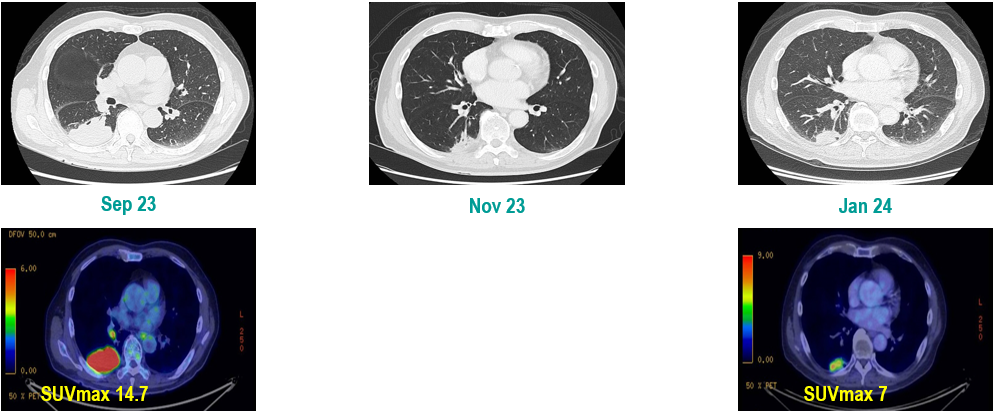
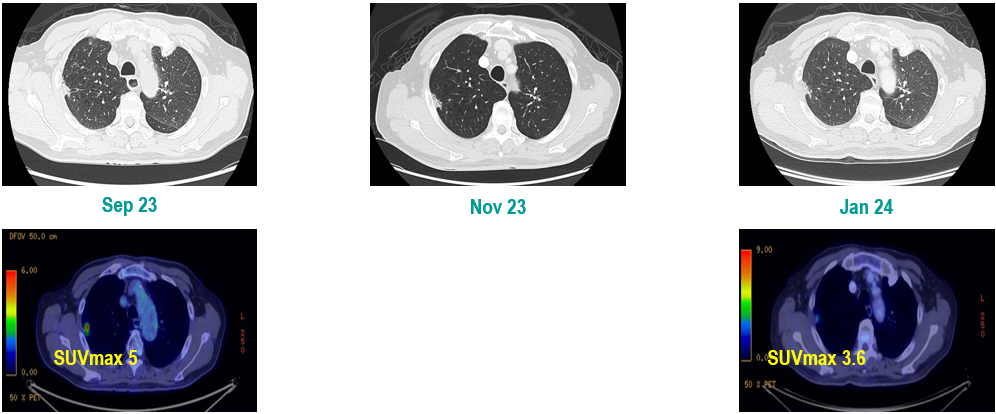
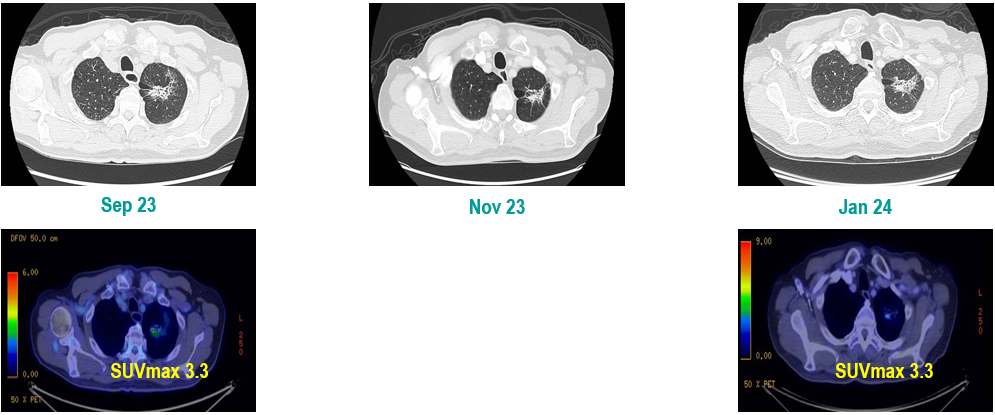
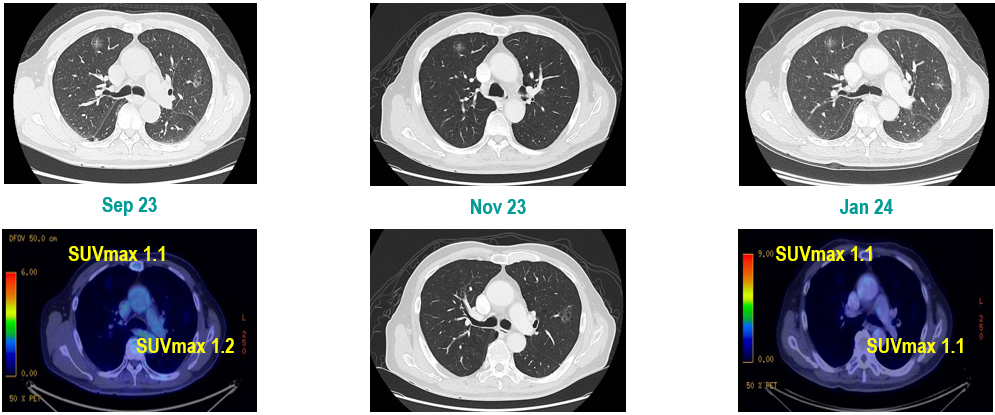
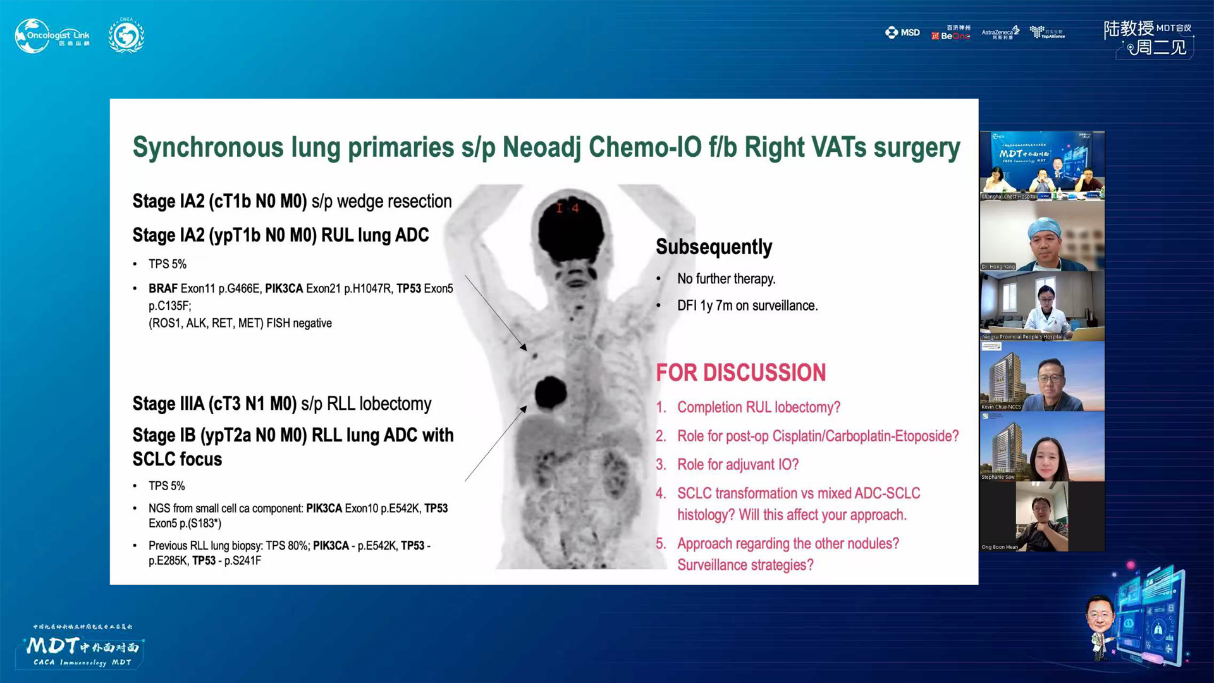
PET-CT(2023年9月):右下肺叶发现6.9×6.7×6.6cm的FDG高摄取肿块,伴右侧第7、8肋骨侵犯可疑,右肺门淋巴结肿大,双肺上叶多发结节,考虑腺癌谱系疾病。
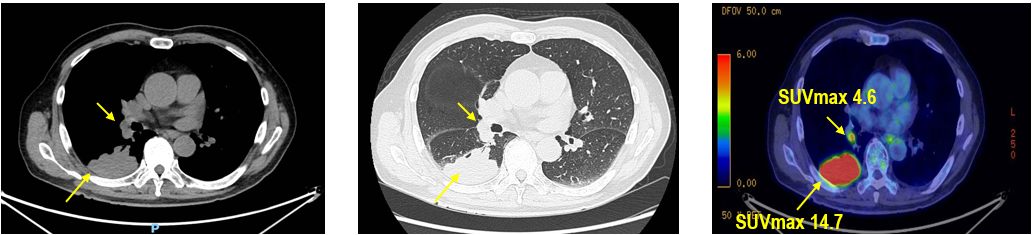
 CT引导下活检:确诊为NSCLC,免疫表型支持腺癌,PD-L1表达达80%。
CT引导下活检:确诊为NSCLC,免疫表型支持腺癌,PD-L1表达达80%。
NGS检测:检测到PIK3CA E542K(VAF 19%)、TP53 E285K(12.7%)、TP53 S241(27.8%)突变。
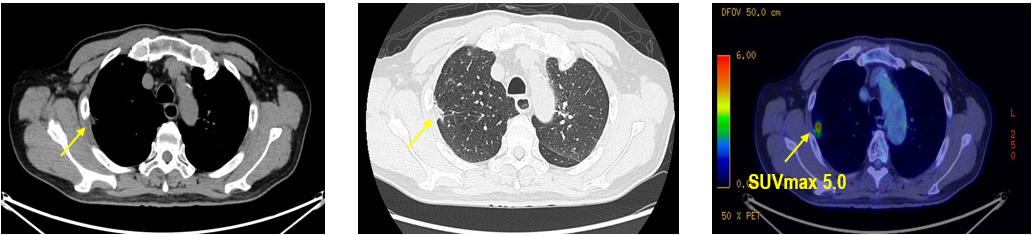
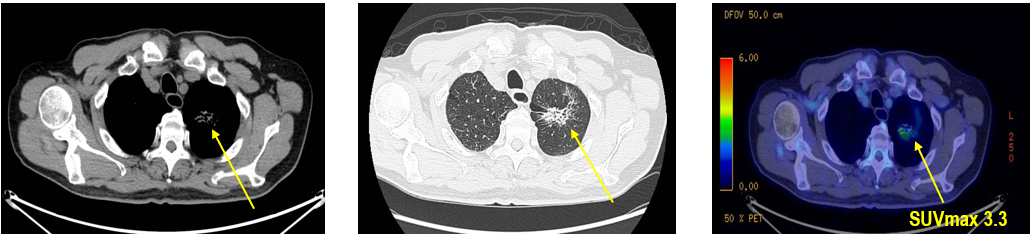
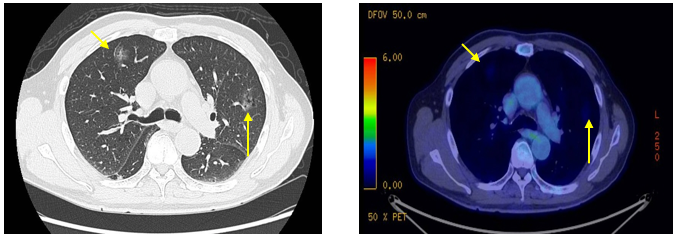
CT及PET-CT随访(2023年11月、2024年1月):评估新辅助治疗效果,右下肺叶肿块缩小,右肺门淋巴结代谢活性消失,右肺上叶结节稳定但代谢活性降低,左肺上叶及双侧磨玻璃样病变稳定。
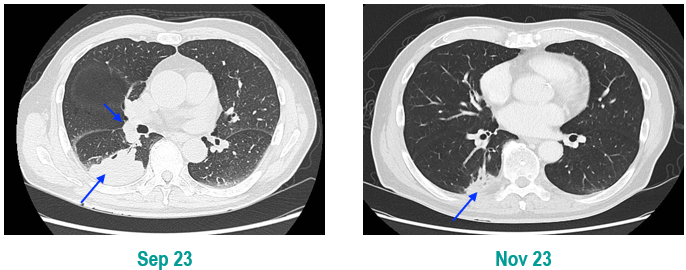
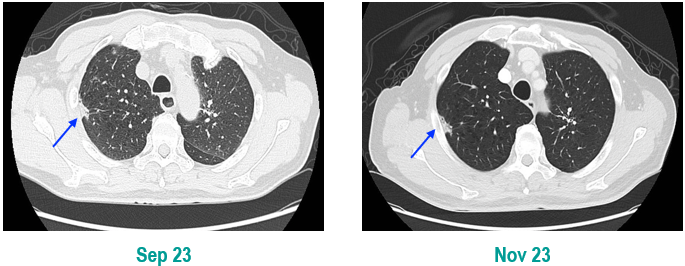
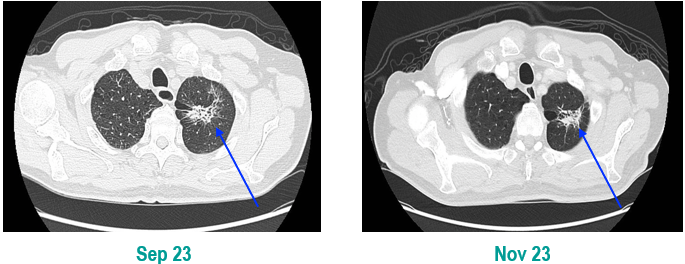
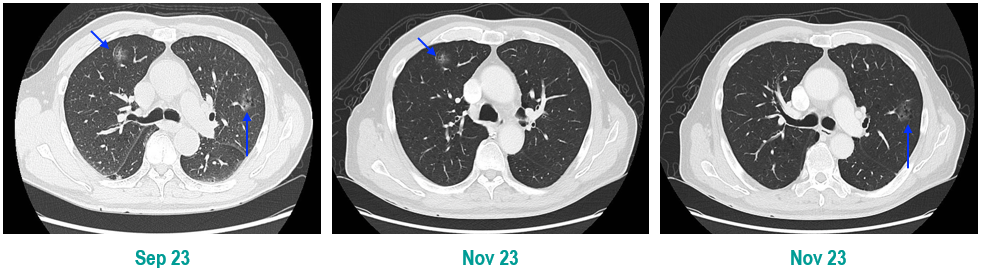
临床诊断
右肺下叶腺癌(cT3N1M0期)
诊疗经过
新辅助治疗:患者接受4周期新辅助化疗联合免疫治疗(培美曲塞、顺铂、纳武利尤单抗),治疗后影像学显示肿块缩小,代谢活性降低。
手术治疗:2024年1月行右肺下叶切除术及右肺上叶楔形切除术,术中病理显示右肺下叶为腺癌伴SCLC灶,右肺上叶为腺癌。术后病理分期:右肺下叶腺癌为ypT2aN0M0(IB期),伴SCLC灶,考虑为治疗后转化;右肺上叶腺癌为ypT1bN0M0(IA2期)。
术后随访:术后未进一步治疗,随访1年7个月未见复发。
本病例讨论点:
1. 是否需要完成右上肺叶切除术?
2. 术后顺铂/卡铂-依托泊苷的治疗价值是什么?
3. 辅助免疫治疗的必要性是什么?
4. SCLC转化与混合腺癌-SCLC组织学的比较?这是否会影响治疗方案?
5. 其他结节的处理方法和监测策略是什么?
中山大学肿瘤防治中心杨弘教授:推荐进行右肺上叶楔形切除术,这既能有效处理该病灶,又能最大限度保留患者的肺功能。考虑到病灶为边界清晰的磨玻璃影,大小约1-2cm,具备楔形切除的可行性。而且,患者已接受手术治疗,未来再次手术难度较大,此次术中一并切除该右肺上叶磨玻璃病灶,可实现“一次手术解决多个病灶”的目标。当然,患者也可以选择SBRT放疗,但从肺功能评估来看,其应可耐受此次手术切除。建议患者考虑接受为期1年的辅助免疫治疗,鉴于主要病灶位于右肺下叶且术后病理评估为NPR,辅助免疫治疗可能有助于改善预后,但最终还需结合患者意愿。对于术后发现转化SCLC,但因病灶微小且分期较早,建议给予辅助化疗,方案可采用顺铂联合依托泊苷。鉴于其占比极小且已R0切除,可能无需过度强化治疗。对于左侧上叶残留的磨玻璃影,建议采取密切观察策略,暂不干预。
上海交通大学附属胸科医院艾星浩教授:71岁患者,右肺上叶结节确诊为同期原发性腺癌,考虑到高龄因素,当前的部分切除已足够,无需进行右肺上叶切除术;术后建议接受辅助免疫治疗,因SCLC可能由NSCLC转化而来,且检测到PIK3CA突变,患者有望从中获益;同时,双侧的磨玻璃影病灶建议定期监测。
上海交通大学附属胸科医院李子明教授:右肺上叶病灶应属原发性早期病变,而右肺下叶病灶则倾向由NSCLC转化为SCLC。目前,对于已发生转化SCLC患者,治疗策略尚不明确。若患者年龄较轻,可考虑卡铂联合依托泊苷并加用免疫治疗;但由于患者为NPR,预期获益可能有限。至于左肺上叶病灶,我认为应是混合性病变,后续随访中应重点监测病灶变化。
上海交通大学附属胸科医院陆舜教授:患者为同期、同步性多原发肺癌病例,右肺上叶混合磨玻璃影虽PET未见明显摄取,但高度怀疑腺癌。若患者可耐受手术,建议先行右肺上叶GGO切除,同时切除SCLC病灶,左肺上叶结节则继续监测。术中同步切除右肺上叶混合GGO,因高度怀疑腺癌;针对SCLC病灶进行NGS检测,发现PIK3CA突变,结合活检及右肺上叶结节表现,高度怀疑存在SCLC转化。鉴于病灶较小,暂时不用卡铂联合依托泊苷化疗。右肺上叶和右肺下叶病灶均为NPR,尽管右肺下叶有部分缓解,整体仍为NPR。基于现有辅助免疫治疗研究,建议患者接受辅助免疫治疗,未来必要时考虑ADC或其他药物。
本病例由南京医科大学第一附属医院鲁希夷教授分享,具体诊疗过程如下:
病史资料
57岁男性患者,因“反复胸部不适,确诊为左肺上叶腺癌后经历多次治疗方案失败”入院。2020年4月,患者因胸部不适就诊,影像学检查发现左肺上叶占位性病变,同年6月在本院胸外科接受“胸腔镜下左肺上叶切除术+淋巴结清扫术”。术后病理诊断为左肺上叶浸润性腺癌(II-III级,腺泡+实体型),肿瘤大小1.5×1.2×1cm,未侵犯肺门及胸膜,支气管切缘未见肿瘤残留。免疫组化显示肿瘤细胞TTF-1(+)、Napsin A(+)、CK(+)、P63局灶(+)、P40(-)、CK5/6(-)、Syn(-)、CgA(-)、Ki67约40% (+)。基因检测发现EGFR 19号外显子非移码缺失突变(13.2%)、BRAF-TRIM24融合(12.4%)、SMARCA4 26号及9号外显子移码突变。PD-L1表达TPS为50%,PS评分为0。
临床诊断
左肺上叶腺癌(pT1bN1M0,IIB期)
诊疗经过
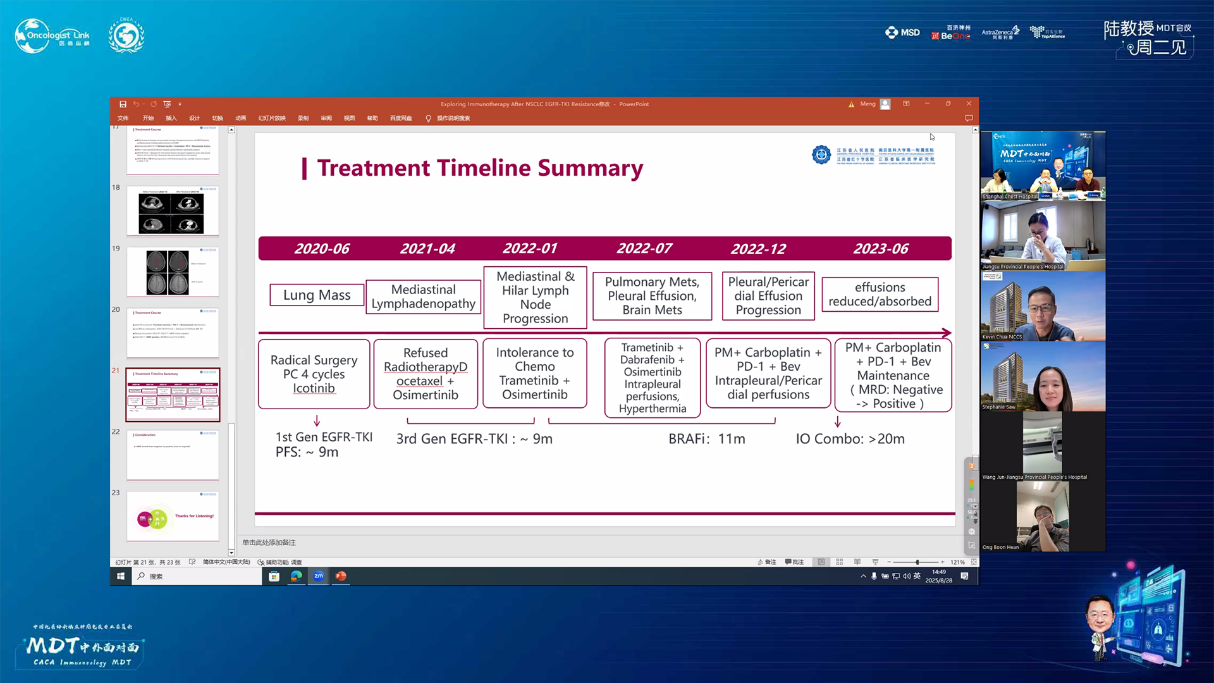
术后辅助治疗(2020年7月):培美曲塞+卡铂化疗4周期,后改为埃克替尼靶向治疗。
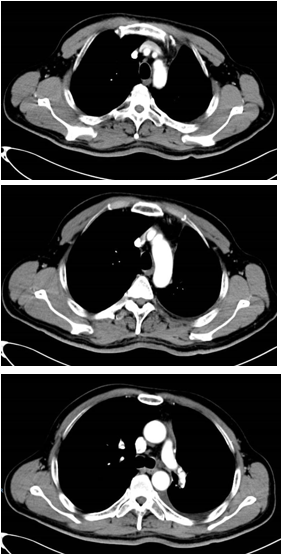
复发及治疗调整(2021年4月):拒绝放疗,改用多西他赛联合奥希替尼治疗。
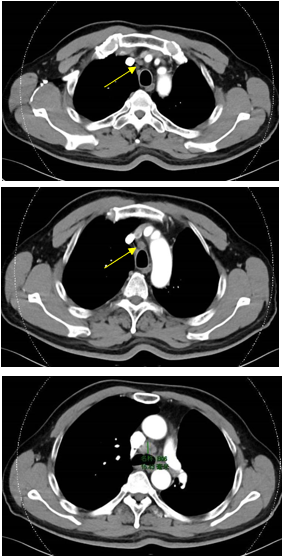
靶向联合治疗(2022年1月):曲美替尼+奥希替尼治疗,后因病情进展改为曲美替尼+达拉非尼+奥希替尼联合治疗,辅以胸腔药物灌注及热疗。
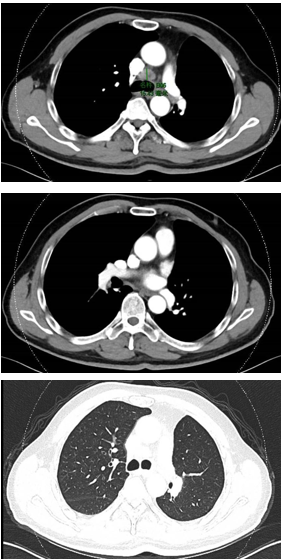
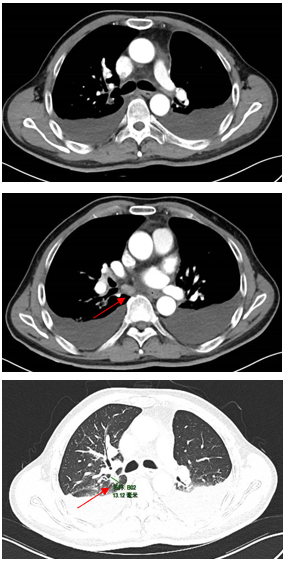
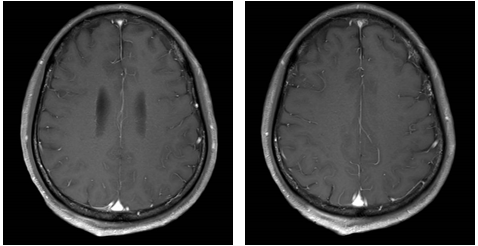
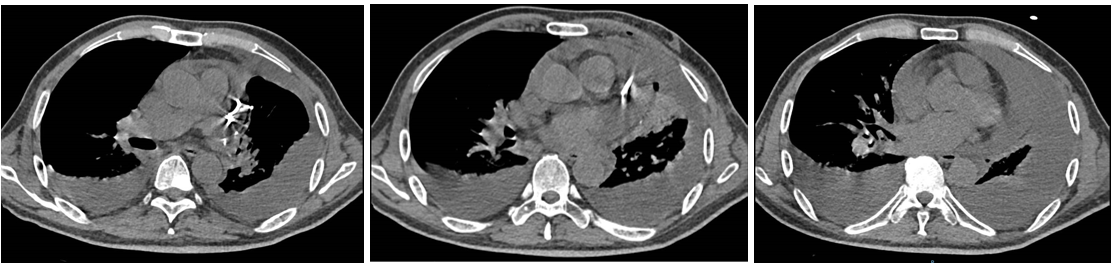
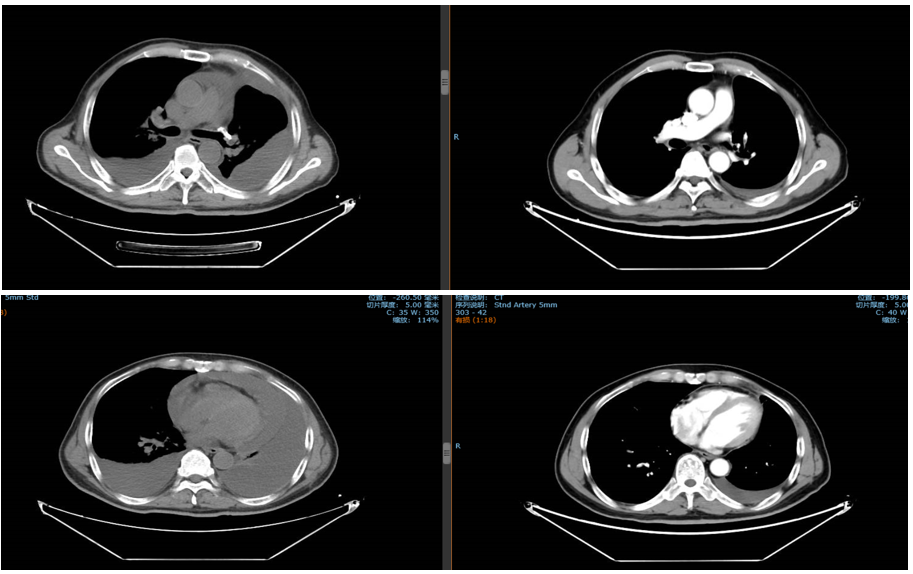
免疫联合化疗(2022年12月):紫杉醇+卡铂+PD-1抑制剂+贝伐珠单抗,共6周期。治疗后积液显著吸收,脑转移灶缩小。
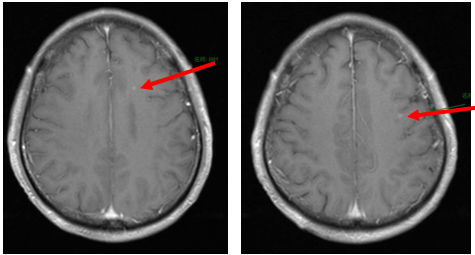
维持治疗及随访(2023年6月至今):紫杉醇+PD-1抑制剂+贝伐珠单抗维持治疗。2025年6月MRD检测发现SMARCA4突变低丰度阳性,提示可能复发,需进一步评估。
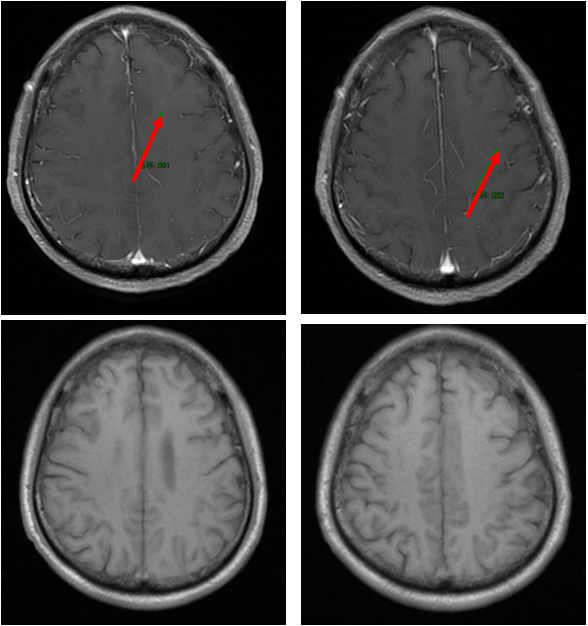
本病例讨论点:
MRD由阴性转为阳性,这种情况下该如何处理?
新加坡国家癌症中心Kevin Lee Min Chua教授:在分析患者治疗情况时,我们发现其接受的系统治疗虽全面,但疾病控制效果短暂,每6个月随访便显示病情进展。同时,患者对紫杉醇+PD-1抑制剂+贝伐珠单抗维持治疗缓解不佳,这促使我们思考后续治疗策略。MRD检测揭示复发风险,却未明确复发位置。此时,借助PET-CT或脑部MRI检查,或许能定位潜在复发病灶。
中山大学肿瘤防治中心陈宝清教授:在分析脑转移病例时,关键在于患者是否已接受或考虑过放疗。在我们的临床实践中,针对脑转移,是否放疗取决于患者具体情况。若脑转移范围有限且其他病灶控制良好,放疗通常是重要选择。因此,我认为放疗在此案例中可作为优先选项。
上海交通大学附属胸科医院艾星浩教授:如果MRD从阴性转为阳性,这是重要的监测信号,但治疗方案的调整不能仅凭此一项指标。即只有当患者出现明确的疾病进展,特别是影像学上出现显著变化时,才考虑调整治疗方案。这样的判断标准能帮助避免因检测误差或早期波动而做出过激的治疗方案调整,确保治疗决策更加理性合理。
上海交通大学附属胸科医院李子明教授:患者并非EGFR驱动型,但从NGS检测结果来看,存在EGFR 19外显子缺失突变,未来我们应更多地关注这类患者。我认为目前不宜用MRD来诊断,CT影像检查对患者而言可能更具益处。
上海交通大学附属胸科医院陆舜教授:MRD虽具有一定预后价值,但目前尚缺乏足够证据支持其作为预测性生物标志物或用于临床终点评估,且在中国尚未有MRD检测获得NMPA批准。不过,若患者已接受MRD检测且结果由阴转阳,我会密切监测,直到影像检查发现复发、进展或新发病灶,再调整治疗方案。对于携带EGFR 19外显子缺失突变的患者,由于此突变对EGFR-TKI治疗的敏感性尚未明确,该患者对TKI治疗无缓解,治疗思路需跳出标准EGFR-TKI路径。对于术后局部复发的患者,通常会优先推荐放疗,但该患者拒绝这一局部治疗方案,错失最佳干预时机。鉴于患者表现为PD-1高表达,同时又不具备典型EGFR敏感突变,若患者拒绝同步放化疗,可考虑免疫治疗联合化疗作为替代方案,这已成为PD-1高表达患者的常用标准治疗策略之一。若出现寡进展,可评估是否可行局部治疗;若为系统性进展,则需考虑更换全身治疗方案,如ADC药物或双特异性抗体等。
新辅助SBRT联合化疗及免疫治疗IIIA期NSCLC——病例分享
本病例由中山大学肿瘤防治中心王炜东教授分享,具体诊疗过程如下:
病史资料
64岁男性患者,因左上肺占位性病变入院。患者既往健康状况良好,未有重大疾病及手术史。症状表现为轻微咳嗽及咳痰,但无明显的体重下降、发热或其他全身症状。既往吸烟史不详,患者无特殊家族病史。
辅助检查
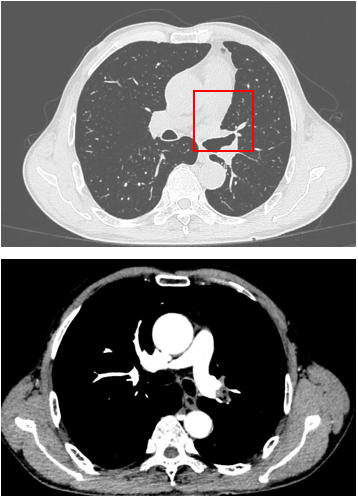
胸部CT显示左侧上叶支气管旁部发现一不规则、边界不清的软组织肿块,大小约为41mm×26mm。增强扫描后,肿瘤呈显著不均匀强化,与肿大的淋巴结粘连且难以区分,部分包裹左上叶支气管,导致管腔狭窄。左上叶肺叶间裂增厚,多个结节灶提示可能存在肺内转移。
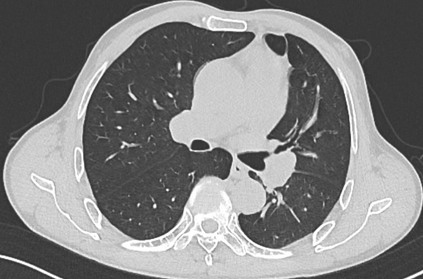
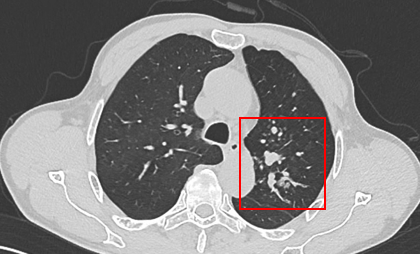
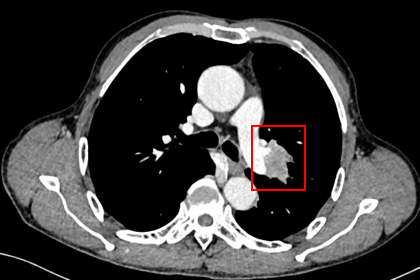
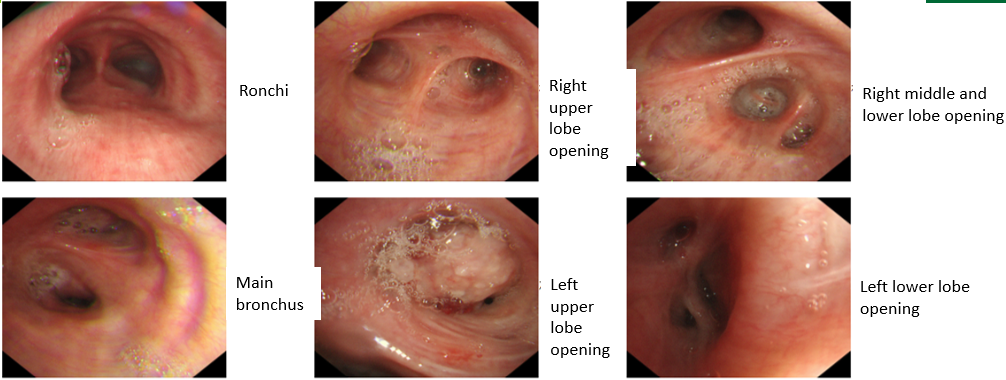
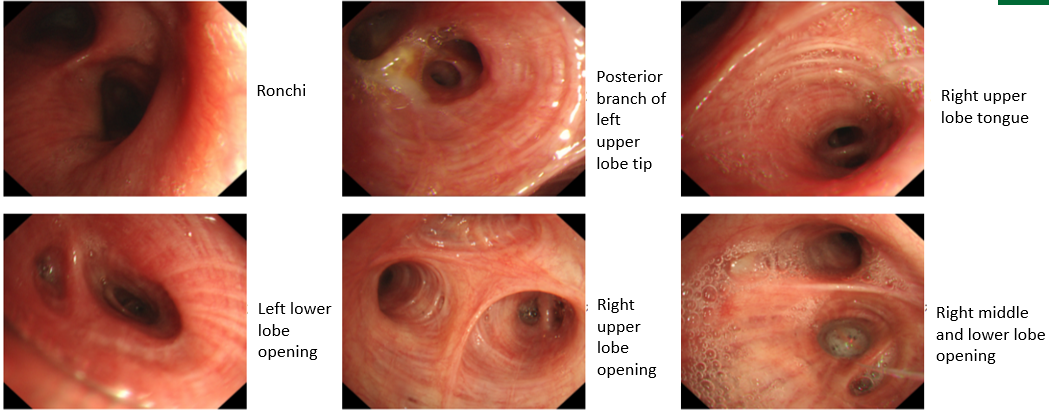
支气管镜检查显示左上叶支气管口可见一脆弱、表面粗糙的肿块,触碰易出血;活检病理提示为鳞状细胞癌。其他支气管(右上叶、左下叶等)的开口通畅,未见明显占位或其他异常。
临床诊断
左肺上叶鳞状细胞癌(cT3N1M0,IIIA期)。
诊疗经过
新辅助治疗:SBRT方案的剂量为24Gy/3次(每次8Gy),连续3天完成;靶区为仅针对原发肿瘤(GTV),未照射淋巴结;PTV中位体积为152cc(范围20–584cc);化疗方案(每3周一次)为紫杉醇274mg(第1天),顺铂40mg(第1–3天);免疫治疗为替雷利珠单抗(PD-1抑制剂)200mg(第1天,每3周)。
治疗缓解评估:影像学(CT)显示原发肿瘤及叶间淋巴结明显缩小;支气管镜显示左上叶开口通畅,原肿块显著退缩,可见白色坏死组织;疗效评估为PR。
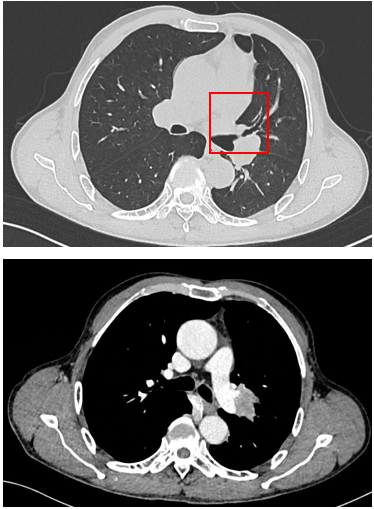
手术治疗:新辅助治疗完成后6周,行VATS辅助左上肺叶切除+肺门及纵隔淋巴结清扫;术中血管解剖清晰,淋巴结清扫顺利;切口小,胸腔镜辅助下完成重建。
术后病理结果:鳞状细胞癌;残留肿瘤细胞为5%;间质成分(纤维化/炎症)为90%;淋巴结为0/13转移;ypT1aN0M0,IA期;疗效评估为MPR。
本病例讨论点:
1. 在放疗计划中,是否应包括转移性淋巴结?术前放疗是否会增加手术难度?
2. 大多数III期临床试验采用3周期的化疗联合免疫治疗,选择2周期的原因是什么?有何优势,是否可能影响疗效?
3. 与常规方法相比,新辅助治疗方案是否会产生特定的不良反应?围手术期需要采取哪些预防措施来应对这些不良反应?

新加坡国家癌症中心Kevin Lee Min Chua教授:SBRT相较于传统新辅助治疗,治疗周期大幅缩短,有效减轻患者负担,提高依从性;凭借高剂量、少分次精准照射,最大限度保护正常组织,降低不良反应,结合淋巴结区域屏蔽策略,进一步减少不良反应;还可能降低肿瘤负荷,简化手术流程。剂量选择上,我们采用36Gy分次方案,平衡疗效与不良反应,避免提高剂量增加阳性切缘风险。当前治疗聚焦原发病灶局部控制,未来有望联合免疫治疗、化疗等,构建多模态联合治疗方案。
上海交通大学附属胸科医院艾星浩教授:这是一项极具价值的临床试验,聚焦于评估术前放疗联合化疗与免疫疗法能否提升患者pCR率。目前,部分小规模研究已初步验证此模式或可提高pCR率,但现有数据尚显不足,仍需大量研究加以佐证,以确定这一治疗方案是否能成为患者更优的选择。
上海交通大学附属胸科医院李子明教授:这项临床试验采用新辅助治疗联合SBRT作为诱导治疗的方案。目前来看,该方案的pCR率相较于传统化疗联合免疫治疗呈现出更高的趋势。然而,为更全面地评估这一治疗方案的效果,我们仍需进行更长期的随访研究,以获取更详尽的患者远期疗效数据。
上海交通大学附属胸科医院陆舜教授:该临床试验在随机化分组前已公布Ⅱ期数据,显示新辅助免疫联合治疗可提高MPR率和pCR率,具有一定的探索价值。然而,在临床实践中,部分患者因放化疗不良反应无法耐受手术;亦有研究在术后给予辅助治疗,观察到更高的MPR率。当前将免疫治疗引入新辅助阶段,基于既往随机对照研究的积极结果,值得进一步验证其疗效,并评估是否推进至Ⅲ期临床试验。尽管pCR率与EFS之间的相关性尚存争议,但更高的pCR率可能有助于缩短术前等待时间,提高肿瘤的可切除性。此外,SBRT作为术前放疗手段,虽具备疗程短、肺炎风险可控等优势,但其在可切除NSCLC中的应用仍属研究性干预。外科医生对放疗后手术安全性的担忧,亦需在临床试验设计中予以充分考虑。
总结
在2025年9月16日的“MDT中外面对面”学术会议上,国内外肺癌专家深入探讨肺癌免疫治疗、靶向治疗及MDT的前沿进展。会议聚焦NSCLC新辅助免疫治疗联合化疗、IIB期NSCLC多线治疗择及新辅助SBRT联合化疗及免疫治疗IIIA期NSCLC,强调精准化、个体化治疗理念和MDT的重要性。专家普遍认为,肺癌治疗未来的突破口在于:将免疫与靶向药物有机整合,合理设计化疗联合免疫的方案,并依据患者基因组学特征进行个体化决策。本次会议的结论不仅为临床选择提供循证依据,也明确后续研究重点,更凸显多学科团队在复杂病例管理中的不可替代作用。
排版编辑:肿瘤资讯-Vickey











 苏公网安备32059002004080号
苏公网安备32059002004080号


