胰腺癌恶性程度高、预后极差,素有“癌中之王”之称。2024年流行病学数据显示:胰腺癌的5年生存率仅为13%,分别占我国以及美国癌症相关死亡人数的第6位与第4位,已成为威胁全球公共卫生的问题与难题[1]。与此同时,胰腺癌患者的营养不良发生率极高,而严重的营养不良和恶病质是导致治疗不耐受、生活质量下降乃至死亡的重要原因。因此,积极有效的营养干预是胰腺癌综合治疗中不可或缺的关键环节。西北大学附属长安区医院(西安交通大学肿瘤内科在职研究生)王兴主治医师分享了一例晚期胰腺癌伴肝转移患者的诊疗过程,点评嘉宾为西安交通大学第一附属医院肿瘤内科孔莺教授。该患者初诊时已存在中度营养不良,在肿瘤特医食品全程营养支持下,通过化疗、放疗靶向及免疫治疗联合,运动康复,实现了超过三年的高质量长生存。
【肿瘤资讯】特将此病例整理如下,以期为临床实践提供参考。
本期特邀点评专家——孔 莺 教授
博士,副主任医师,副教授,副研究员,硕士研究生导师
美国哥伦比亚大学及康奈尔大学访问学者
中国食管肿瘤整合康复专委会 委员
陕西省药理学会化疗药物专业委员会 常务委员
陕西省抗癌协会药物专业委员会 常务委员
陕西省抗癌协会肿瘤消融治疗专业委员会 常务委员
陕西省抗癌协会转化医学委员会 委员
陕西省抗癌协会化疗专业委员会 委员
陕西省抗癌协会生物治疗专业委员会 委员
陕西省医师协会肝胆胰疾病专业委员会 委员
陕西省医师协会腹部肿瘤医学综合康复分会 委员第三届全国胃癌中青年MDT菁英挑战赛全国总冠军
目前专业方向:消化道肿瘤综合治疗,及肿瘤的介入治疗。
研究方向:肿瘤耐药基因的靶点筛查。
主持省市级科研项目6项,国家自然科学基金1项,主持临床项目1项,发明专利2项并发表SCI多篇
本期特邀专家——王 兴 医师
西安交通大学肿瘤内科在职研究生
医学硕士、主治医师中国肉瘤青年肿瘤专委会会员
陕西抗癌协会会员
陕西省细胞分子协会会员
中国抗癌协会青年理事会会员
中国抗癌协会肿瘤热疗专业委员会会员
擅长消化道肿瘤、肺癌、乳腺癌及妇科肿瘤等综合治疗,以及癌性疼痛、肿瘤营养支持治疗
病例介绍
基本情况:患者男性,62岁,ECOG PS评分1分。
主诉:确诊胰腺癌肝转移3年余。
现病史:于2022.6.27起予以 AG化疗方案1-8周期,具体:吉西他滨,1.40g d1,d8+白蛋白结合紫杉醇200mg,dl,d8;于2022.9.19加用尼妥珠单抗治疗,具体为:尼妥珠单抗400mg微量泵泵入q1w。
综合评估病情为PR,于2022.12.13起行维持治疗5周期,具体为:吉西他滨(4+7 药品)(#B),1.40gd1、8iv.drip q3w+尼妥珠单抗400mg iv.drip q1w。
2023-04-25行胸部+全腹+盆腔增强CT示: 1.两肺上叶肺气肿,左肺多发钙化灶,左肺门、纵隔多发钙化淋巴结影:。2.胰尾部弱强化肿块,较前略增大。3.肝实质内多发大小不等环形强化病灶,考虑转移瘤,较前缩小。
结合患者影像学检查肝脏病灶较前减小,MDT最终会诊意见,胰尾病灶考虑局部进展,肿瘤活性成分较前增加,肝脏病灶较前缩小,且肿瘤标志物升高(CEA 10.6(0-5)ng/ml;CA199 87.3(0-39)U/mL,建议更换为二线方案联合胰尾部放疗,家属考虑患者身体耐受性,要求继续吉西他滨(4+7 药品)(#B),1.40gd1、8iv.drip q3w+尼妥珠单抗400mg iv.drip q1w治疗。
2024.02.18腹部CT: 1.胰尾部弱强化肿块较前变化不著;2.肝多发转移瘤同前。
2024.04.22腹部CT: 1.胰尾部弱强化肿块略增大;2.肝多发转移瘤较前略缩小。
行MDT会诊后综合评估病情进展,遂更改二线方案联合胰尾部放疗,由于患者消化道不良反应较重,家属考虑患者身体耐受性,暂不考虑放射治疗,行UGT1 A1检测示:野生纯合型,于2024-04-26行伊立替康150mg,i v.drip,d1,8+替吉奥(集采),50mg,PO,bid,d1-14+尼妥珠单抗400mg iv.drip d1,8,15 q1w治疗。考虑药物不良反应,后将伊立替康调整为伊立替康脂质体。前期治疗疗效评估SD,消化道不良反应2级,化疗后骨髓抑制I°。
2024.7.8腹部增强CT示:1.胰尾部弱强化肿块,大小形态较前变化不著;2.肝多发转移瘤,同前。
2024.10.21腹部增强CT示:1.胰尾部弱强化肿块,大小同前;2.肝多发转移瘤,数目和大小同前。
2025.02.21腹部增强CT:胰尾部弱强化肿块,体积较前变化不著;胰尾部性病变,变化不大;2.肝多发转移瘤,数目和大小同前。
2025-4-10患者在本院行CT评估胰尾部强化肿块,体积较前稍增大,肝多发转移瘤,数目和大小同前,综合评估胰腺病灶局部进展。MDT会诊后于2025-04-14起行局部放疗,具体放疗计划为: IMRT,6MVX线,靶区范围包括胰腺原发灶DT45Gy/15f。
2025-7患者复查CT,病情稳定,结合临床试验数据,局部放疗后能够起到免疫增敏效果,结合目前最新相关研究数据,MDT会诊后遂于2025-07-21给予更换方案为卡度尼利单抗375mg d1+尼妥珠单抗400mg d1+伊立替康脂质体43mg d1,d8+替吉奥50 bid d1-14 q3w治疗3周期,2025-10-13再次复查CT提示病情稳定,现为求进一步治疗来院,门诊以“胰腺恶性肿瘤”收住我科。
既往史:既往糖尿病2年余,予以胰岛素调控血糖,自觉血糖控制可。
个人史及家族史:生于当地,久居本地,无疫区、疫情、疫水接触史,无牧区、矿山、高氟区、低碘区居住史,无化学性物质、放射性物质、有毒物质接触史,有吸烟史,约30年,平均20支/日,有饮酒史,约15年,平均250克酒精量/日,无冶游史。结婚年龄25岁,育有1子1女,配偶健康状况良好。
查体:体表面积:1.91㎡ KPS评分:90分 NRS评分:1分,神清,生命体征平稳,双肺呼吸音清,未闻及干湿性啰音。心脏听诊未闻及病理性杂音,腹平软,无压痛,未及异常包块,移动性浊音阴性。
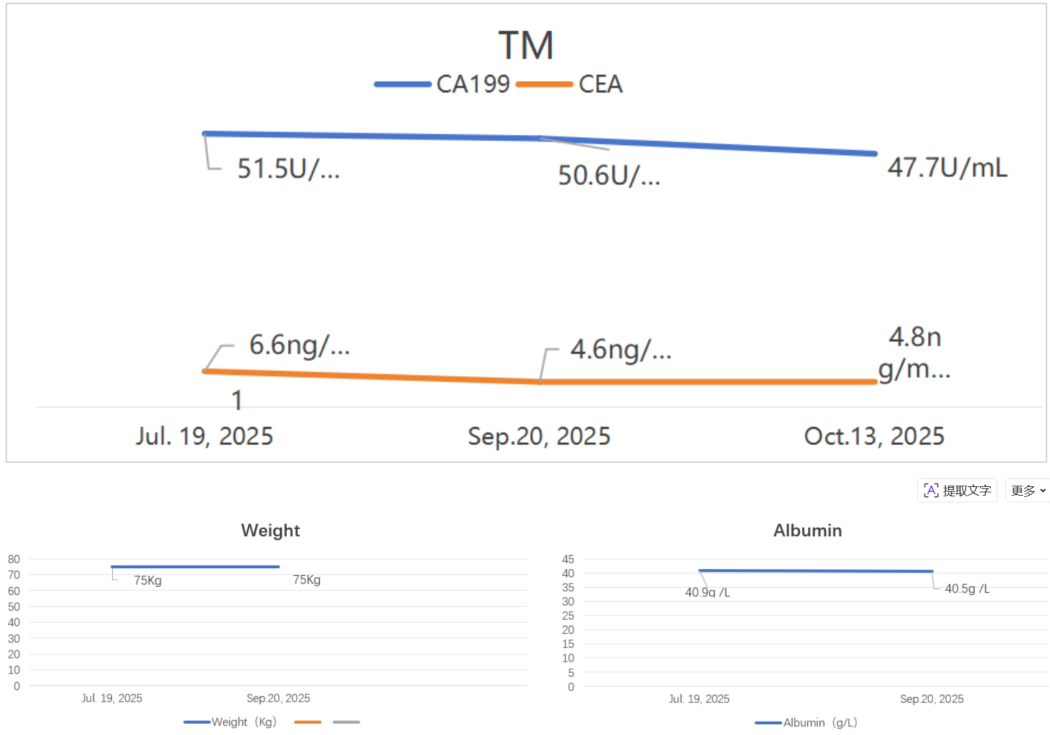
实验室检查:CEA:6.6ng/mL,CA199: 51.5U/ml,CA724: 90U/ml。其余标志物阴性。KRAS基因检测野生型;MSI-H/L,PD-L1表达(等情况)
影像学检查:腰椎MR示(2022-06-14 铜川矿务局医院):1.腰1-骶1椎间盘变性:2.腰1-5椎间盘膨出:3.腰 4-5、腰 5-骶1椎间盘突出(中央偏左型):4.腰5、骶1椎体终板损伤:5.腰椎骨质增生:6.盆腔积液。
头颅MR示(2022-06-14 铜川矿务局医院):1.颅脑MRI扫描未见异常:2.副鼻窦炎,左侧上颌窦囊肿;3.右侧椎动脉细。
胸部CT(2022-06-15 铜川矿务局医院):1左侧胸膜局部钙化:2.纵膈内、左肺门多发淋巴结钙化:3.肝脏多发占位性病变:
上腹增强CT(2022-06-15 铜川矿务局医院):1.胰尾部占位性病变,考虑胰腺Ca:2.肝脏多发低密度影,考虑转移瘤;3.胃壁局部略增厚,建议胃镜检查:4.门静脉右支充盈缺损,考虑癌栓形成:5.脾脏钙化灶;6.左肾低密度影,考虑囊肿;7.腹膜后稍大淋巴结:8.少量腹水。
术后病检2022-06-21 (西安交通大学第一附属医院):“?叶肝穿刺活检”小块肝组织内有中-低分化腺癌,免组染色:CK(+),EMA(+),CEA(+),CK7(+),CK20(-),CDX2(-)CA199(+),MUCI(+).MUC2(-).CK5/6(+).P40(小灶+)Hep-1(±),GPC3(-),AFP(-),Her-2(-),MLH1(+)、MSH2(+)、MSH6(+)、PMS2(+)、Ki67(+60%),PD-L1(CPS小于1)。
基因检测:KRAS野生型。
临床诊断
1.胰腺恶性肿瘤(胰尾段,中分化腺癌,cT3NxM1, IVA期)2. 肝转移瘤 3.门静脉癌栓形成
基线营养状况评估(2022年6月18日):患者存在明显的营养不良。NRS 2002评分为4分,提示有营养不良风险;PG-SGA评分为10分,属于重度营养不良。体重60kg,血红蛋白126 g/L,白蛋白为35.3 g/L。
诊疗经过与疗效评估
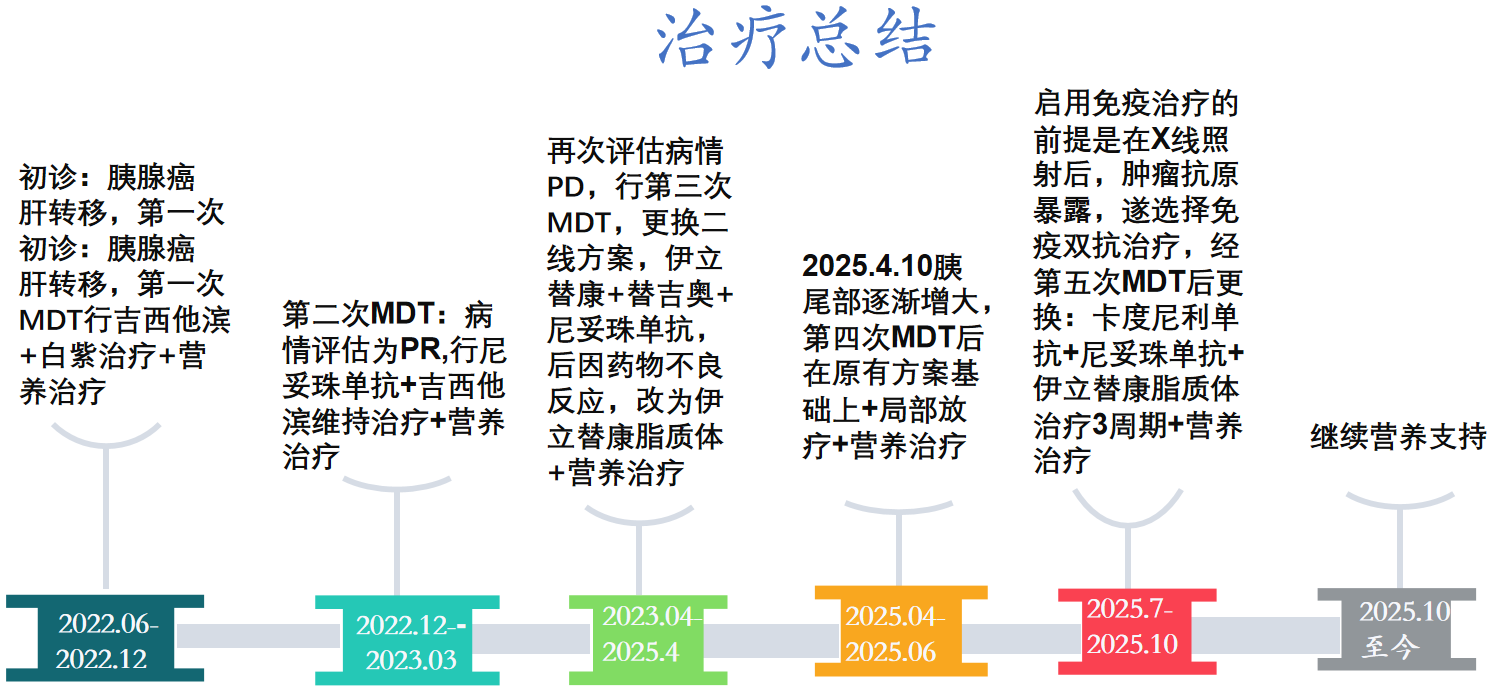
一线治疗与营养干预(2022年6月—2022年12月)
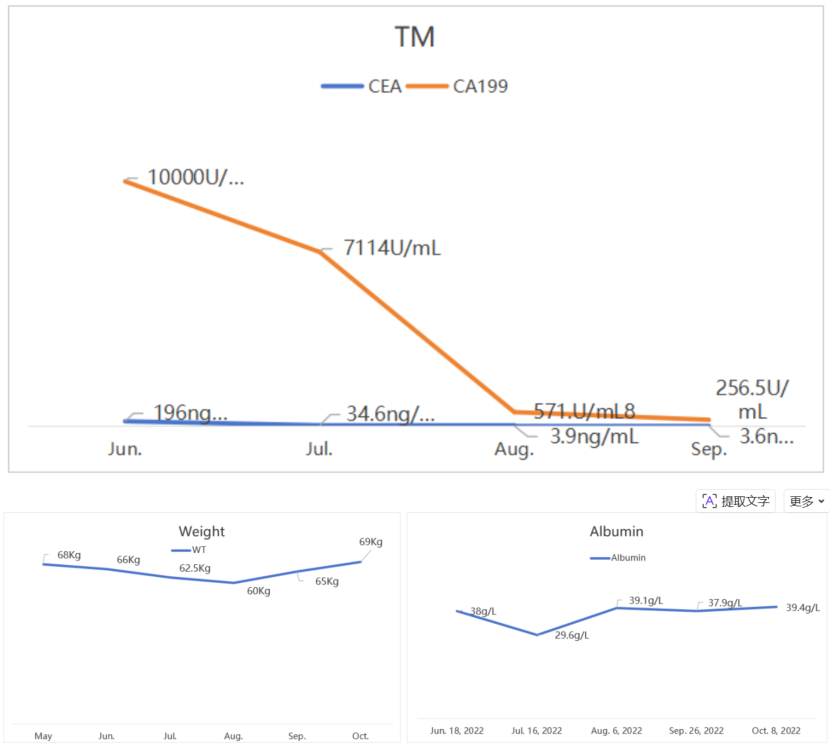
患者于2022年6月开始接受一线吉西他滨+白蛋白紫杉醇疗。然而,在首轮化疗后,患者的营养状况急剧恶化,呈现持续分解代谢状态,体重由66kg降至60kg,白蛋白降至29.6 g/L,血红蛋白更是跌至77 g/L的中度贫血水平。
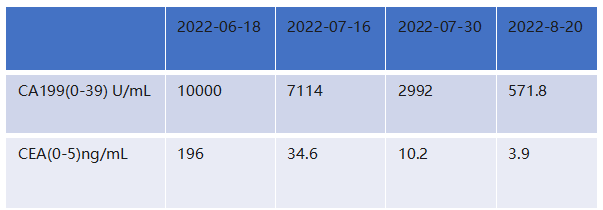
鉴于此,于2022年8月在MDT讨论下,营养科建议:用含特定成分的肿瘤特医营养品,初始日708Kcal分多次服用(基于患者目前中等体力劳动,每日热量需求1800Kcal,108g蛋白质,患者目前饮食摄入量在1100Kcal,65g蛋白质;基于能量和蛋白的缺口,可补充肿瘤特医营养500ml,可提供708Kcal,43g蛋白质)。耐受后 9 月增至日 3 瓶,补优质蛋白60kg 日需 90-120g及易消化饮食,低强度散步,定期监测指标,告知营养重要性并每周随访,目标纠正贫血、升白蛋白至>35g/L、恢复体重),结合患者状态给予了综合干预措施:在常规饮食基础上,每日口服补充富含精氨酸、n-3脂肪酸和核苷酸的肿瘤特医食品708Kcal,并鼓励患者进行力所能及的低强度运动(如散步)。经过积极干预,患者的营养状况得到显著逆转。9月开始肿瘤特医食品用量增加为每天3瓶,热量1062Kcal,蛋白64.5g。至2022年10月,其体重恢复至69kg,白蛋白回升至40.9 g/L,血红蛋白达到了142 g/L。良好的营养状况为后续治疗奠定了坚实基础,疗效评估为部分缓解(PR)。
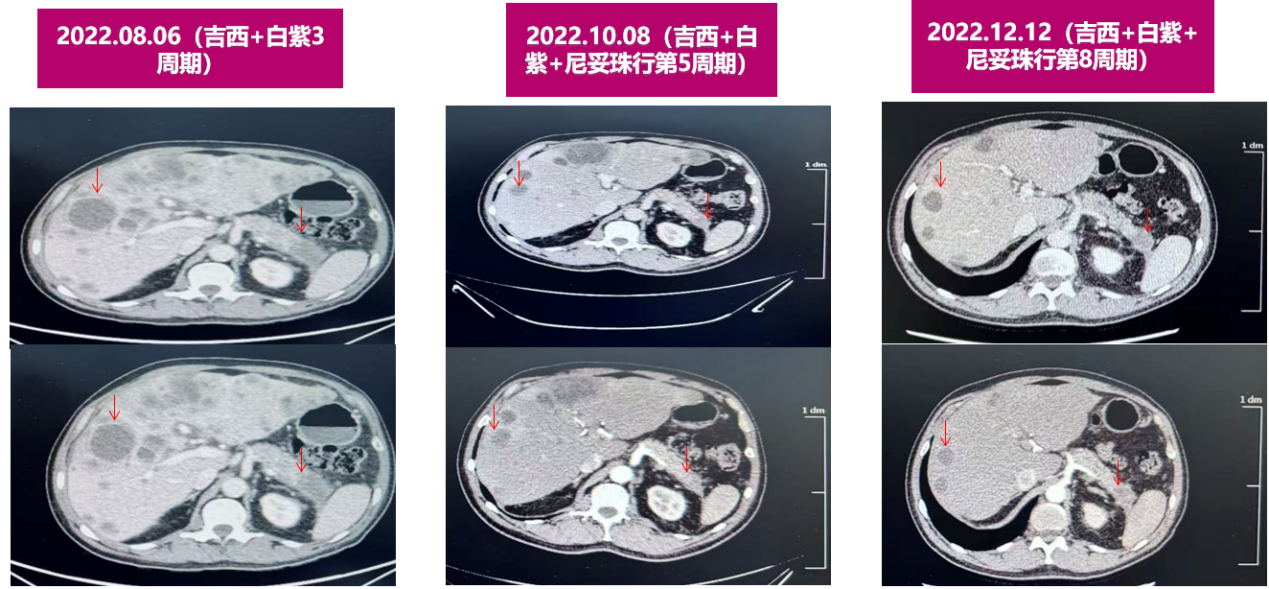
腹部增强CT示(2022.08.06):1.胰腺体尾部增大并弱强化区(32mm),肝实质内多发大小不等环形强化病灶,考虑胰腺恶性肿瘤并肝内多发转移。2.腹盆腔积液。
腹部增强CT示(2022.10.08):与2022-08-06日图像对比示:1.胰腺体尾部增大并弱强化区,肿块较前缩小(29mm);肝内多发转移瘤,部分病灶较前缩小:2.盆腔少量积液,积液较前明显减少。(PR)
腹部增强CT示(2022.12.12):与2022.10.08图像对比:1.胰腺体尾部增大并弱强化区,肿块较前略减小(27mm);2.肝实质内多发大小不等环形强化病灶,考虑转移瘤,3.左肾囊肿。(PR)胸部CT(2022.08.06-10.08-12.12):1.两肺上叶肺气肿,左肺下叶肺大疱,同前2.左肺多发钙化灶,左肺门、纵隔多发钙化淋巴结影;同前3.左胸膜增厚、粘连;上腔静脉置管状态。
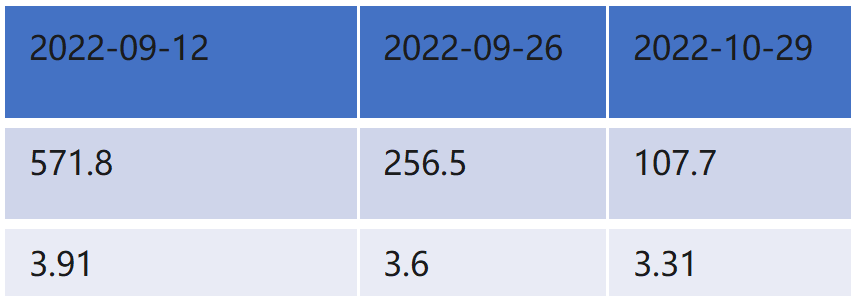
肿瘤标志物示:
一线维持治疗与营养巩固(2022年12月—2023年3月)
营养状况治疗后评估(2022.12.21),NRS2002评分:1分(<3分提示无营养不良风险),PG-SGA:4分(属于中度营养不良)。
吉西他滨+白紫方案治疗8周期后,经过影像评估,患者病情稳定,病灶持续缩小。患者进入维持治疗阶段,方案调整为“吉西他滨+尼妥珠单抗”。同时,营养支持力度进一步加强,肿瘤免疫营养用量维持1062kcal/天,蛋白64.5g,并继续坚持运动锻炼。在此阶段,患者疗效评估为PR,体重稳定在66kg,白蛋白维持在42 g/L水平。
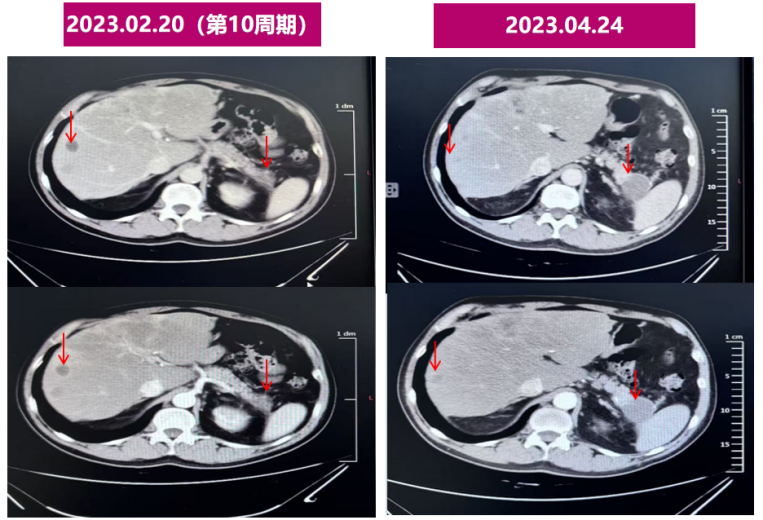
腹部增强CT(2023.2.20) 与2022.12.12图像对比:1.胰腺体尾部增大并弱强化区,肿块大小无明显变化(27mm),强化程度略下降;2.原肝实质内多发大小不等环形强化病灶,考虑转移瘤,较前缩小。(SD)。
腹部增强CT(2023.04.24):与2023-02-20图像对比示:1.胰尾部弱强化肿块,较前略增大(29mm),2.肝实质内多发大小不等环形强化病灶,考虑转移瘤,较前缩小。(PD)
二线治疗及维持治疗(2023年4月—2025年4月)
营养状况治疗后评估(2023.04.23),NRS2002评分:3分(<3分提示无营养不良风险),PG-SGA:4分(属于中度营养不良)。
2023年4月,全身综合评估为PD,胰尾病灶较前进展,肿瘤活性成分较前增加,肝脏病灶较前缩小,且肿瘤标志物升高(CEA 10.6(0-5)ng/ml;CA199 87.3(0-39)U/mL。建议更换为二线方案联合胰尾部放疗,家属考虑患者身体耐受性,要求继续吉西他滨(4+7 药品)(#B),1.40gd1、8iv.drip q3w+尼妥珠单抗400mg iv.drip q1w治疗。2024.04.22行腹部增强CT示:胰尾部弱强化肿块略增大;2.肝多发转移瘤较前略缩小,行MDT会诊后综合评估病情进展,遂更改二线方案联合胰尾部放疗,由于患者消化道不良反应较重,家属考虑患者身体耐受性,暂不考虑放射治疗,行UGT1 A1检测示:野生纯合型,行UGT1 A1野生纯合型,遂更改为二线治疗方案“伊立替康150mg,i v.drip,d1,8+替吉奥(集采),50mg,PO,bid,d1-14+尼妥珠单抗400mg iv.drip d1,8,15 q1w”。期间病情评估为SD ,后因药物不良反应及患者身体耐受性,后将伊立替康调整为伊立替康脂质体,继续治疗2周期。在此长达近两年的治疗周期里,每日708Kcal,蛋白43g的肿瘤特医食品营养支持从未间断,但患者的营养状况始终保持稳定,体重维持在66kg,白蛋白为39 g/L。
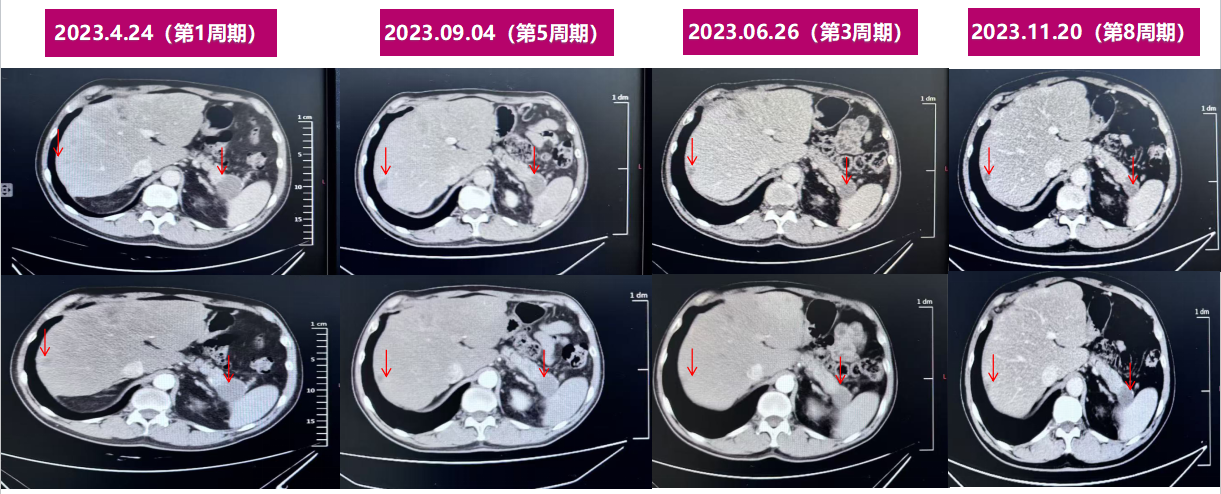
2023.04.24腹部CT:与2023-02-20图像对比示:1.胰尾部弱强化肿块,较前稍缩小(25mm),实性部分稍减少,2.肝实质内多发大小不等环形强化病灶,考虑转移瘤,较前缩小。(PR)
2023.06.26腹部CT:与2023-04-24图像对比示:1.胰尾部弱强化肿块,较前稍缩小(23mm);2.肝多发转移瘤,同前。(PR)
2023.09.04腹部CT:与2023-06-26图像对比示:1.胰尾部弱强化肿块(23mm),同前:2.肝多发转移瘤,同前。(SD)
2023.11.20 腹部CT:与2023-09-04图像对比示:1.胰尾部弱强化肿块(23mm),大小形态较前变化不著;2.肝多发转移瘤,基本同前。(SD)
2023.11.20-2025.01患者于外院行同方案治疗,病情评估为SD。
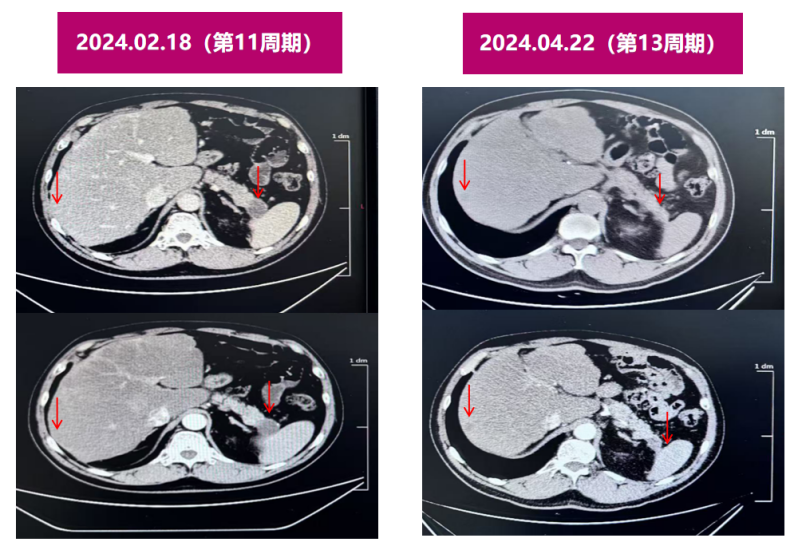
2024.02.18腹部CT:与2023-11-20图像对比示:1.胰尾部弱强化肿块(22mm),大小形态较前变化不著;2.肝多发转移瘤,部分较前稍缩小。(PR)
2024.04.22腹部CT:与2024-2-18图像对比示:1.胰尾部弱强化肿块(22mm),大小形态较前变化不著;2.肝多发转移瘤,同前。(SD)
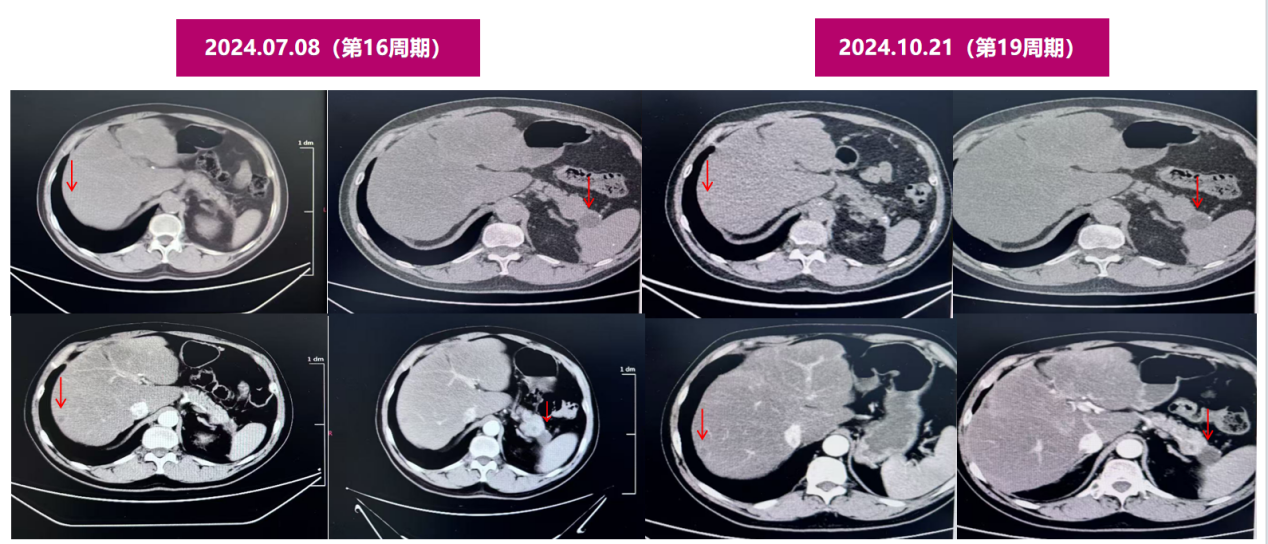
2024.7.8腹部增强CT示:1.胰尾部弱强化肿块(22mm),大小形态较前变化不著;2.肝多发转移瘤,同前。(SD)
2024.10.21腹部增强CT示:与2024-07-08图像对比示:1.胰尾部弱强化肿块(22mm),大小同前;2.肝多发转移瘤,数目和大小同前。
2024.07.08-2025.02.21患者因消化道不良反应III级,给予更换为伊立替康脂质体,期间患者于外院治疗,期间综合评估病情为SD。
2025.02.21腹部增强CT:胰尾部弱强化肿块,体积较前变化不著(测量大小约(22mm);胰尾部性病变,变化不大;2.肝多发转移瘤,数目和大小同前:3.左肾囊肿,同前。(SD)
胸部CT同前。
肿瘤标志物:
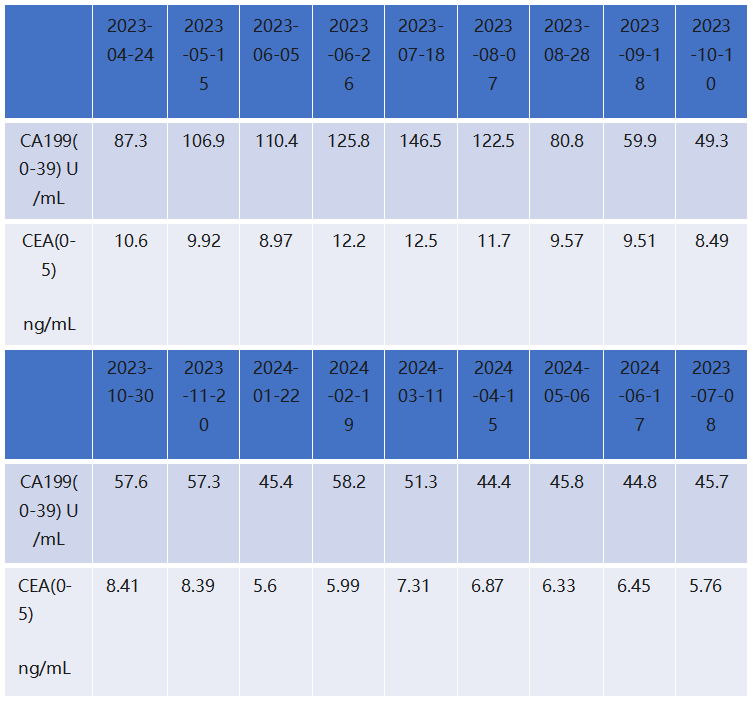
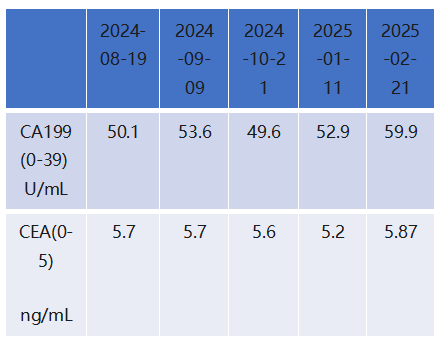
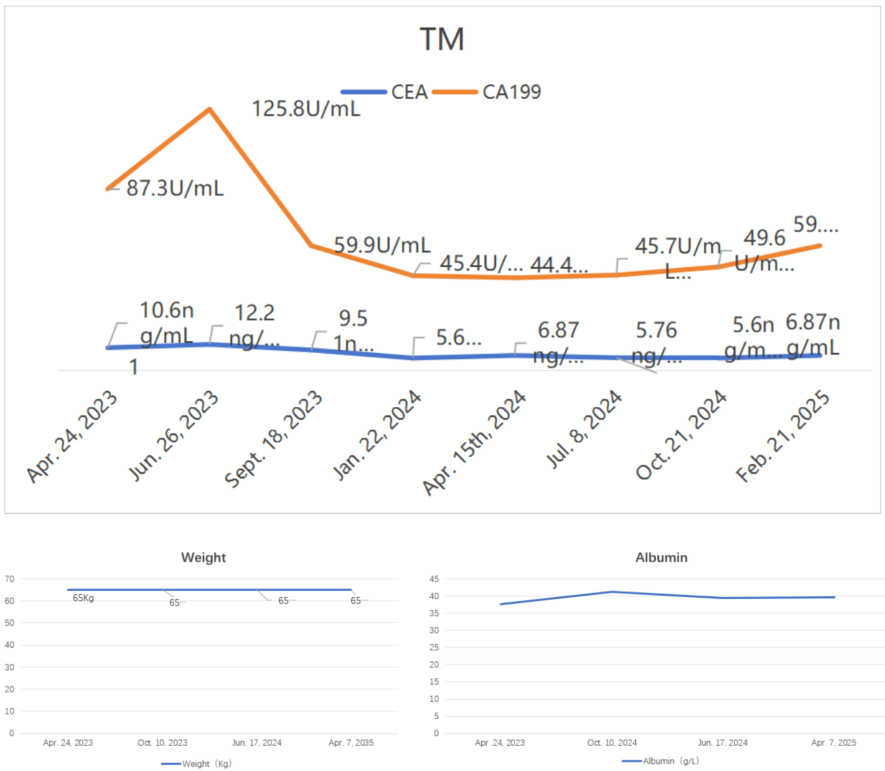
二线治疗维持治疗与营养强化(2025年2月—2025年6月)
营养状况治疗后评估(2025.02.21),NRS2002评分:3分(<3分提示无营养不良风险),PG-SGA:3分(属于轻度营养不良)。
2025-4-10患者于外院行CT评估胰尾部强化肿块,体积较前稍增大,肝多发转移瘤,数目和大小同前,结合评估胰腺局部病灶较前增大,MDT会诊意见:建议局部行放射治疗。于2025-04-14行局部放疗,具体放疗计划为: IMRT,6MVX线,靶区范围包括胰腺原发灶DT45Gy/15f,末次放疗时间:2025-06-01。放疗期间,继续予以肿瘤特医食品每日708Kcal,蛋白43g,进行营养支持。放疗结束后,患者复查腹部CT示:胰尾部弱强化肿块,体积较前稍增大;胰尾部性病变,变化不大;腹膜后多发淋巴结同前;2.肝多发转移瘤,数目和大小同前。体重增至75kg,白蛋白维持在41 g/L的良好水平,顺利耐受了放疗过程。
肿瘤标志物:
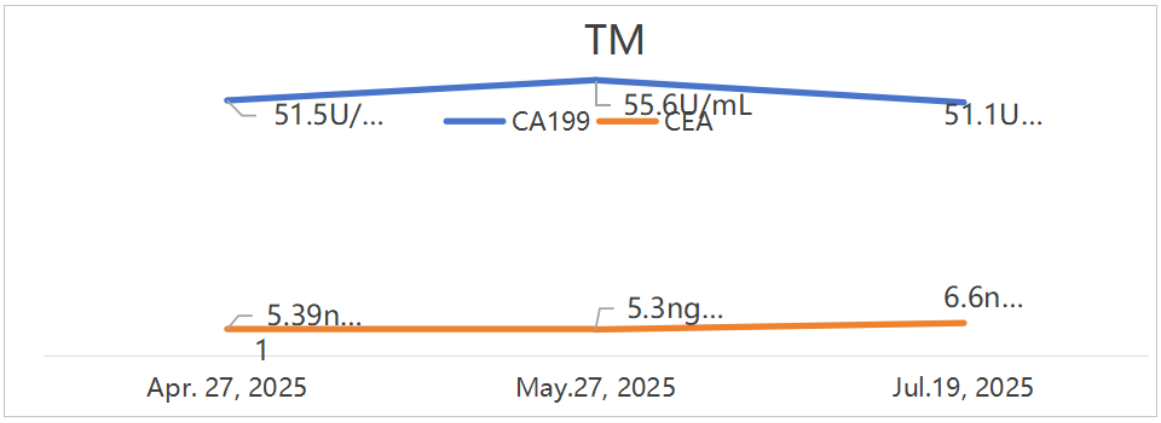
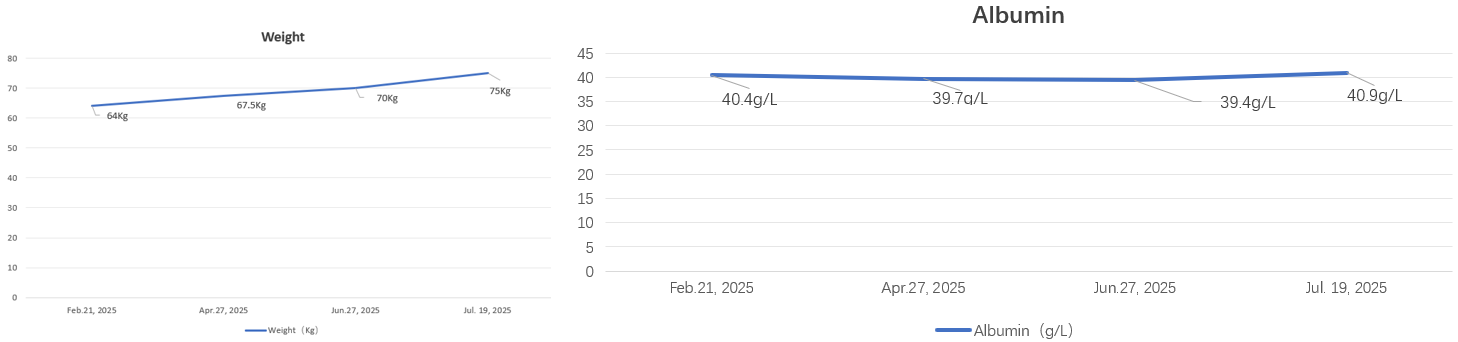
患者25年2月-7月体重稳步上升。
三线治疗
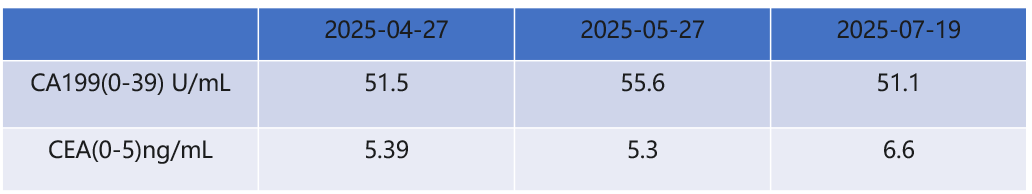
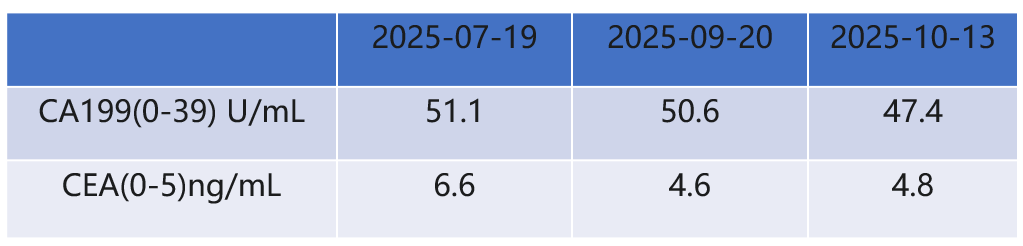
2025-07-19行CT示胰尾部病灶较前略增大,CA199、CEA较前升高,综合评估为PD。
营养状况治疗后评估(2025.07.20),NRS2002评分:3分(<3分提示无营养不良风险),PG-SGA:6分(属于中度营养不良)。
营养治疗:考虑患者消化道不良反应II级,继续补充肿瘤免疫营养708kcal,蛋白43g口服,每天营养支持;
MDT会诊后,建议:患者胰腺癌后线治疗,抗原释放增加,提示肿瘤细胞抗原暴露增加,免疫激活潜在窗口出现。结合前期治疗疗效不佳,评估后考虑换用卡度尼利单抗(PD-1/CTLA-4 双抗),以双靶点协同机制增强抗原提呈及效应 T 细胞功能,充分利用抗原释放契机,改善抗肿瘤免疫应答,遂于2025-07-21行卡度尼利单抗375mg d1+尼妥珠单抗400mg d1+伊立替康脂质体43mg d1,d8+替吉奥50 bid d1-14 q3w治疗3周期,2025-10-13再次复查CT提示病情稳定。
治疗持续时间:2025.7.21-2025.10.13
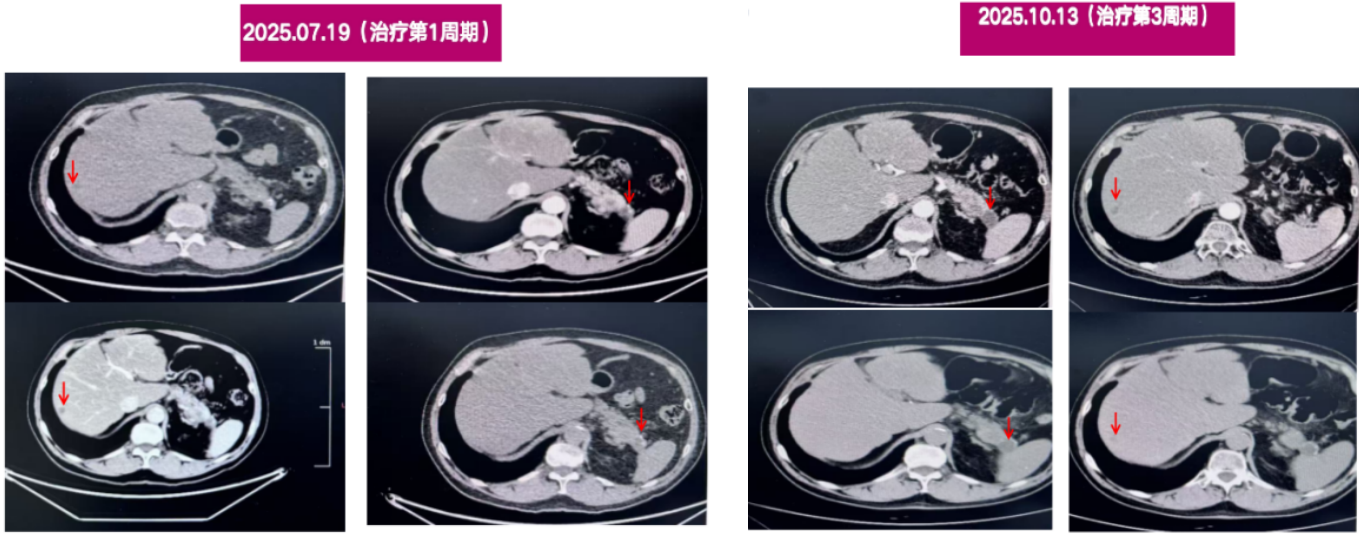
2025.07.19腹部增强CT:1.胰尾部弱强化肿块,体积较前增大(30mm),坏死趋于增大;胰尾部囊性病变,变化不大;2.肝多发转移瘤,数目和大小同前。
2025.10.13腹部增强CT:1.胰尾部弱强化肿块,体积本同前(30mm),强化程度较前减低;胰尾部囊性病变,变化不大。2.肝多发转移瘤,数目和大小基本同前。
胸部CT未见明显异常。
本病例为一名62岁男性晚期胰腺癌(IVA期)伴肝转移患者,初诊时即伴有中度营养不良。通过采用多线化疗、靶向治疗、局部放疗等综合抗肿瘤手段,并始终贯穿以肿瘤特医食品为核心的全程、主动营养干预及适当的运动康复,患者成功实现了超过三年的高质量长生存。整个治疗过程中,患者的营养指标得到显著改善并长期维持稳定,有效保障了各项抗肿瘤治疗的顺利实施。
 治疗过程总结
治疗过程总结
病例点评
本例患者的成功诊疗,充分彰显了在晚期胰腺癌治疗中,将营养治疗提升至与抗肿瘤治疗同等重要地位的临床价值。
胰腺癌肝转移患者中位生存不到6个月,且营养状态普遍较差,难以支持患者接受高强度的治疗方案。该病例完美诠释了《CSCO恶性肿瘤患者营养治疗指南》所倡导的肿瘤营养“早筛查、早治疗”原则[2]。患者在初次化疗后营养状况的急剧恶化,警示我们在临床实践中必须对高风险患者进行动态监测和主动干预。本例中,正是由于在营养耗竭出现后及时启动了强有力的营养支持,才成功逆转了颓势,为后续所有治疗的实施提供了可能。
其次,营养制剂的选择是成功的关键之一。该病例全程选用了富含精氨酸、n-3脂肪酸和核苷酸的肿瘤专用免疫营养配方。这些免疫营养素能够调节机体炎症反应、增强免疫功能,对于接受放化疗的肿瘤患者具有改善食欲、维持体重和提高生活质量的益处。本例患者长期稳定的白蛋白水平和良好的治疗耐受性,直观地反映了免疫营养支持的临床优势。
最后,本病例强调了“营养+运动”的协同作用。通过将低强度的日常锻炼融入康复计划,有助于维持患者的肌肉量和体力,减少疲劳感,从而形成“良好营养—更好体力—更强治疗耐受性—更优生活质量”的良性循环。
综上所述,这例晚期胰腺癌患者的长生存并非偶然。它是在精准的抗肿瘤治疗基础上,通过贯穿始终的、以免疫营养为核心的、联合运动康复的全程管理策略共同作用的结果。这一成功案例为胰腺癌肝转移患者的治疗提供了宝贵的经验和新的思路。未来,可以进一步开展相关研究,探索更优化的营养配方和运动康复方案,以提高胰腺癌肝转移患者的治疗效果和生活质量,为更多患者带来长生存的希望。
[1]刘悦泽, 张太平, 赵玉沛. 胰腺癌诊治的进展与思考[J]. 临床肝胆病杂志, 2025, 41(4): 601-604
[2]《CSCO恶性肿瘤患者营养治疗指南》
责任编辑:肿瘤资讯-Skye
排版编辑:肿瘤资讯-Sally











 苏公网安备32059002004080号
苏公网安备32059002004080号


