本病例报道了一例临床上极为罕见的“三重罕见”病例:一种“罕见”的乳腺癌亚型(三阴性浸润性小叶癌,Triple-negative invasive lobular carcinoma, TN-ILC),且该病例以一种“罕见”的模式发生转移(初诊时同步性胃转移),并伴有一种“罕见”的临床表现(完全无消化道症状)。这一独特的组合构成了巨大的临床诊断挑战,其胃部病变极易被误诊为原发性胃癌,从而导致治疗有误。本报告通过详尽的影像学及病理组织学分析(证实为雌激素受体阴性、孕激素受体阴性、HER-2 1+),特别是借助GATA-3、Villin及CK7/20等关键免疫组化标志物的鉴别诊断,最终明确了乳腺来源的诊断。
由于本病例患者初诊时无任何消化道症状,极易导致漏诊。本病例凸显了对转移性乳腺癌患者进行全面评估的重要性。
前言
根据2022年全球癌症统计报告,乳腺癌已成为全球第二大常见恶性肿瘤,也是女性中发病率最高的癌症,对女性健康构成严重威胁[1]。浸润性小叶癌(Invasive lobular carcinoma, ILC)是乳腺癌中第二大常见的组织学类型,约占所有病例的15%[2]。其中,三阴性浸润性小叶癌(TN-ILC)仅占ILC的2-9%,且多数病例表现为雄激素受体(AR)阳性[3]。与浸润性导管癌相比,ILC更倾向于转移至胃肠道、腹膜、软脑膜和卵巢[4,5]。然而,胃转移的发生率极低,文献报道仅为0.06-0.6%[6,7]。关于TN-ILC在初诊时即伴有胃转移的报道尤为罕见,且其表现与原发性胃癌极为相似[5,8],构成了诊断上的巨大挑战。
本病例报告旨在描述一例罕见的、初诊即伴有同步性胃转移的TN-ILC患者,并结合其影像学与病理组织学证据,为深入理解这一非典型转移模式提供新的临床见解。
病例报告[9]
临床表现与初诊
患者为一名68岁绝经后女性,因“胸闷一周”于2024年2月就诊于南京市高淳人民医院。入院初步CT检查提示:左乳可见一大小约4.0厘米的不规则肿块,符合乳腺影像报告和数据系统(BI-RADS)5级标准(9),伴有同侧腋窝淋巴结肿大、双侧胸腔积液及心包积液(图1A)。为明确分期,后续进行了系统性影像学评估,结果显示存在广泛转移,包括胃壁弥漫性增厚(图1B)、左侧肾上腺结节(图1C)、脑内强化灶(图1D)以及溶骨性骨破坏(图1E)。
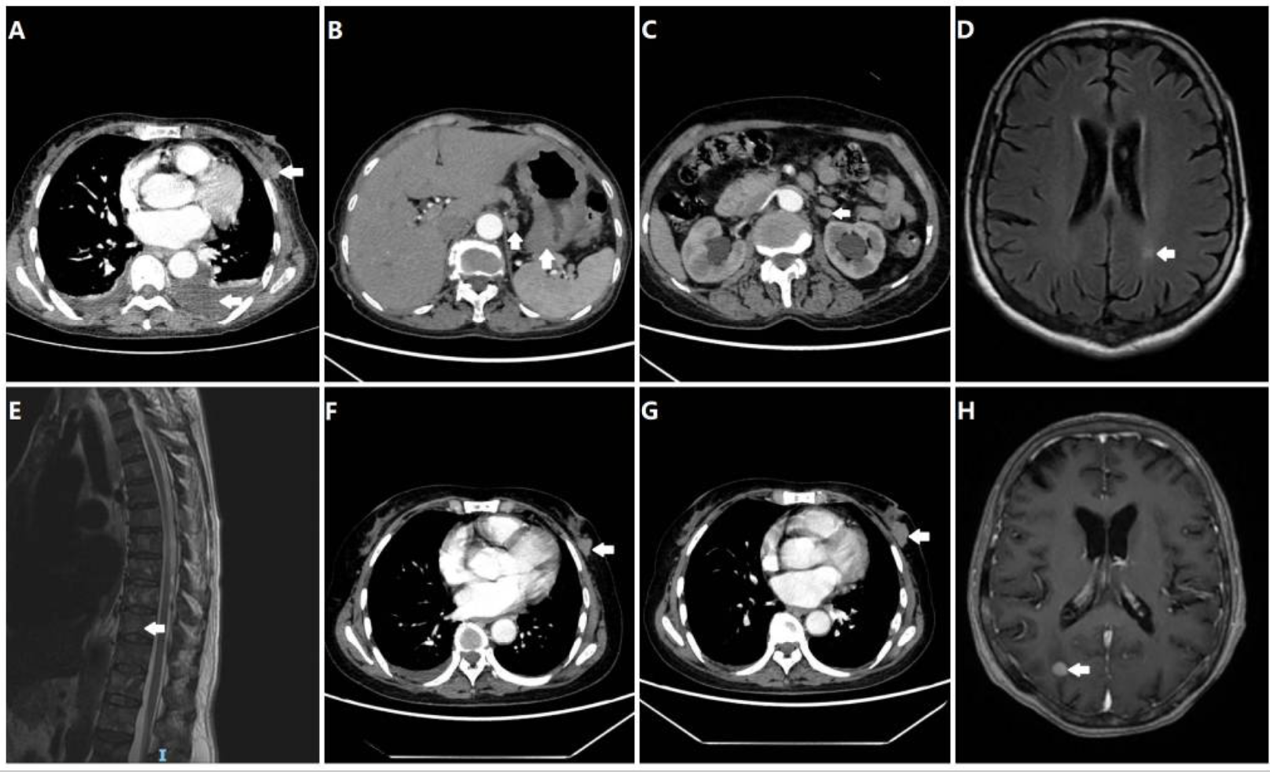
A) 胸部CT显示左侧乳房肿块(箭头所示),伴有局部皮肤增厚和左侧胸腔积液。(B) 胃壁增厚,伴胃周淋巴结肿大。(C) 肾上腺转移性结节。(D) 左侧枕叶脑转移灶。(E) 脊柱和椎体附件多发性转移灶。(F) 经过两个周期的一线化疗后,乳腺癌病情稳定。(G) 乳腺癌疾病进展。(H) 右侧大脑出现新发颅内转移灶。所有图像中的白色箭头均指示肿瘤位置。
外周血肿瘤标志物检测显示多项指标显著升高:癌胚抗原(CEA)30.12 ng/ml(正常值≤5 ng/ml),糖类抗原125(CA125)321.1 U/ml(正常值<35 U/ml),细胞角蛋白19片段(CYFRA 21-1)117.5 ng/ml(正常值<3.3 ng/ml)。胃镜检查可见浅表萎缩性胃炎、胃底息肉,并在胃体部观察到浸润性病变(图2A)。
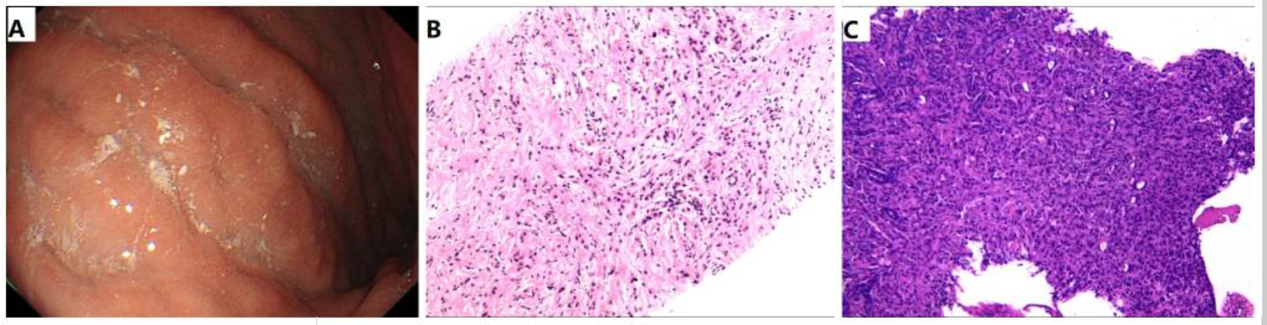
(A) 内镜视图显示胃黏膜充血、水肿,伴有浸润性病变,特征为黏膜皱襞僵硬和表面糜烂。(B) 乳腺活检组织HE染色显示出典型的浸润性小叶癌形态(放大倍数, ×10)。(C) 胃活检组织HE染色显示为腺癌(放大倍数, ×10)。HE,苏木精和伊红。
病理诊断与鉴别诊断
为明确诊断,对左乳肿块及胃部病变分别进行了活检。
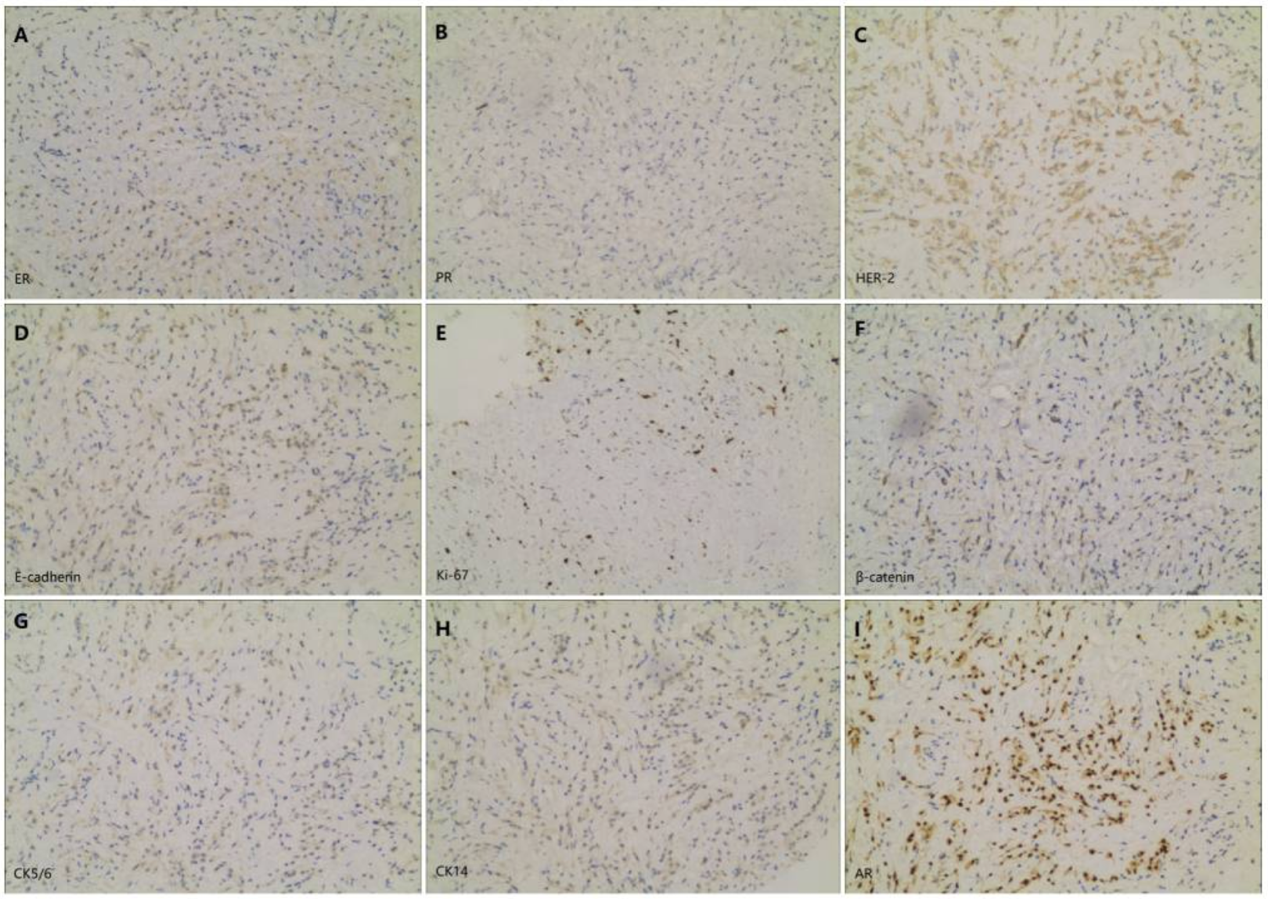
左乳肿块病理(图3):苏木精-伊红(HE)染色显示出典型的浸润性小叶癌形态学特征(图2B)。免疫组化(IHC)结果为:雌激素受体(ER)(-)、孕激素受体(PR)(-)、人表皮生长因子受体2(HER-2)(1+)、E-cadherin(-)、Ki-67(+,局部热点区达30%)、β-catenin(+)、细胞角蛋白(CK)5/6(-)、CK14(-)以及雄激素受体(AR)(++)。结合以上结果,明确诊断为经典型浸润性小叶癌,分子亚型为三阴性。
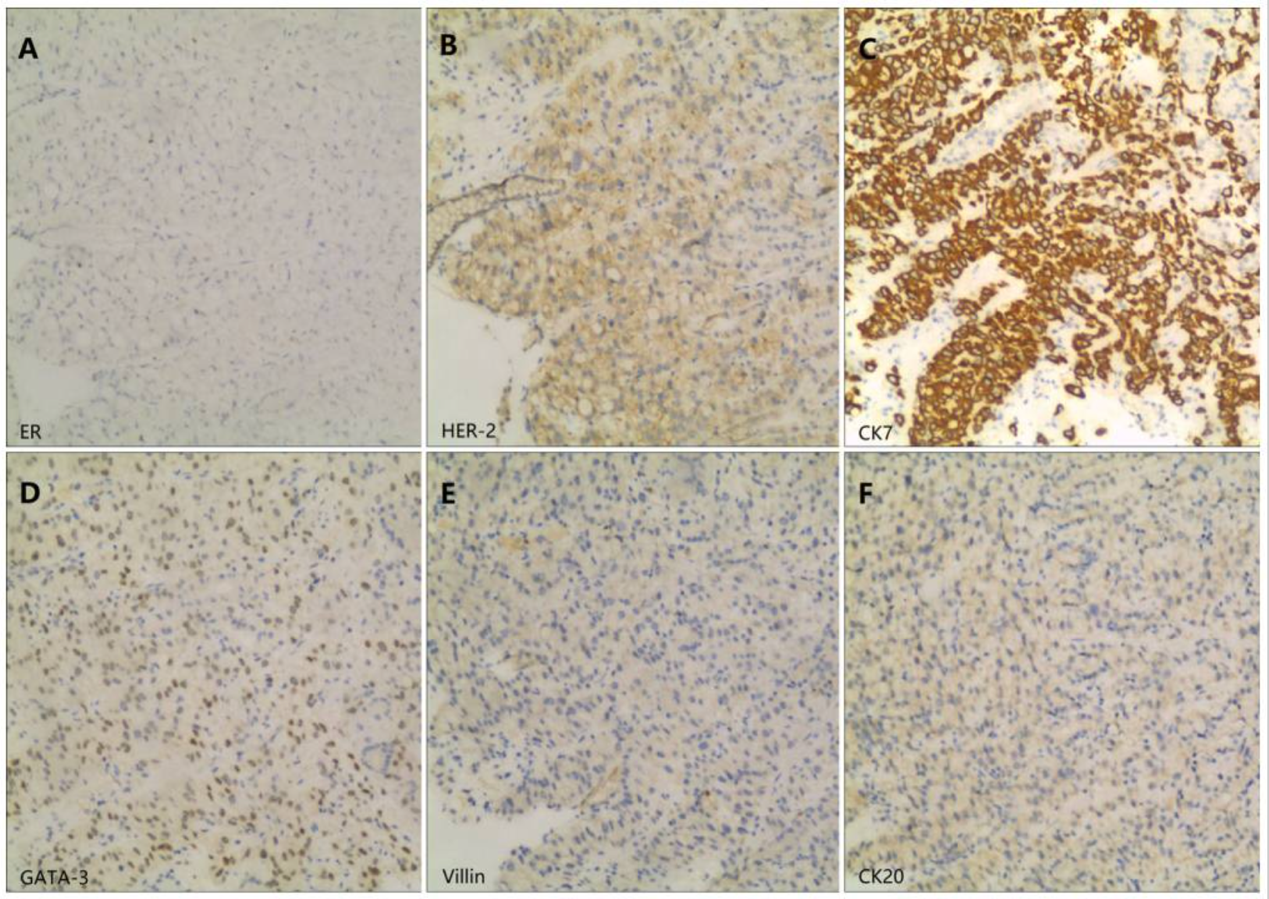
胃部病变病理(图4):HE染色提示为腺癌结构(图2C)。为鉴别其来源,进行了进一步的免疫组化检测,结果显示:ER(-)、HER-2(1+)、GATA结合蛋白3(GATA-3)(+)、CK7(++)、CK20(-)、Villin(-)。这一免疫表型组合(特别是GATA-3阳性及Villin阴性)有力地证实了胃部病变为乳腺来源的转移性腺癌。
最终诊断与治疗经过
综合所有检查结果,患者最终诊断为:IV期三阴性浸润性小叶癌(cT2N3M1;依据AJCC第八版分期系统)(10),伴有多系统转移(胃、脑、骨、肾上腺、胸膜及广泛淋巴结)。由于经济原因,患者未进行BRCA1/2、PD-L1及PALB2等基因检测。
确诊后,患者于2024年2月开始接受一线化疗,方案为“紫杉醇(175 mg/m²,第1天)联合卡培他滨(1000 mg/m²,每日两次,第1-14天),每21天一周期”(TX方案)。治疗2周期后复查,疗效评价为疾病稳定(SD)(图1F)。完成6周期化疗后,患者进入卡培他滨单药(剂量同前)维持治疗阶段,并定期进行影像学监测。
2025年2月,复查提示疾病进展(PD)(图1G),遂更换为二线优替德隆单药(30 mg/m²,第1-5天,每21天一周期)治疗。然而,2025年5月再次复查发现,患者出现新的颅内转移灶(图1H),并伴有头晕症状,临床判断为再次进展。
此后,患者开始接受三线“特瑞普利单抗(240 mg,第1天,每3周一次)联合艾立布林(1.4 mg/m²,第1、8天,每21天一次)”的全身治疗,并同步对脑部转移灶予以局部立体定向放疗(27 Gy/3次)。截至2025年7月,患者仍在接受该方案治疗。
讨论
浸润性小叶癌是乳腺癌中转移至胃肠道最主要的组织学类型。文献报道乳腺癌胃转移的发生率约为0.06%,但部分研究认为实际比例可能更高,约为6%。值得注意的是,胃转移通常在原发肿瘤诊断数年后才出现,且超过90%的病例为ER阳性。本例患者的特殊之处在于,其为罕见的TN-ILC,并且在初诊时即为同步性胃转移,这在临床上极为少见。
乳腺癌胃转移的临床症状通常不具特异性,包括腹痛(最常见)、恶心、消化不良、厌食及出血等。约20-30%的患者甚至无任何症状,仅在分期评估中偶然发现,这极大地增加了诊断的难度。其内镜下表现也缺乏特异性,最经典的为“皮革胃”(linitis plastica)样改变,其他还可表现为局限性溃疡、息肉样病变、黏膜下结节或肿块等。由于其浸润方式常以黏膜下层和肌层为主,表浅的活检阳性率不高,约30%的病例可能在初次内镜检查中因取样深度不够而被漏诊。尸检研究显示,乳腺癌患者中胃转移的实际发生率高达11.6%,这进一步印证了临床上对此种转移模式的检出率严重偏低。本例患者完全没有消化道症状,影像学也仅提示非特异性的胃壁增厚,内镜下所见也酷似原发性胃癌,最终依靠全面的病理及免疫组化分析才得以确诊。
免疫组化是鉴别原发性胃癌与乳腺癌胃转移最关键的手段。尽管约80%的乳腺癌胃转移灶保留ER/PR表达,但部分原发性胃癌也可表达ER(32%)和PR(12%),限制了其单独使用的特异性。HER-2在ILC中通常为阴性,在胃癌中则表现出显著异质性,因此其鉴别诊断价值有限。CK7/CK20的表达模式则提供了更有力的线索:CK7(+)/CK20(-)的模式强烈提示肿瘤来源于乳腺、肺、甲状腺或妇科,而原发性胃癌常表现为CK7(+)/CK20(+)共表达。最具诊断价值的标志物是GATA-3,作为在乳腺上皮分化中起关键作用的转录因子,GATA-3在所有ILC中均为阳性表达,而在原发性胃腺癌中的表达率低于5%。此外,在胃肠道上皮中持续表达但在乳腺组织中缺失的Villin,进一步提升了诊断的特异性。本例为三阴性乳腺癌,其免疫组化谱CK7(+)/CK20(-)/GATA-3(+)/Villin(-)为最终确诊乳腺来源转移癌提供了决定性证据。
一旦发现胃转移,通常意味着疾病已进入晚期。90-94%的乳腺癌胃转移患者同时伴有其他部位的远处转移[10],预后极差,中位生存期仅约10个月[11]。目前证据表明,对于这类患者,治疗应以全身系统性治疗为主,根据肿瘤负荷、分子标志物及患者一般状况制定个体化方案。外科手术等局部干预仅在少数经筛选的孤立转移灶患者中可能带来生存获益,或用于缓解梗阻、出血等严重局部症状)。
本病例报道了一例极为罕见的、初诊即伴同步性胃转移的三阴性浸rayed性小叶癌。这一案例警示临床医生,即使在初诊的TN-ILC患者中,也应警惕非典型部位转移的可能性。面对可疑的胃部病变,应通过多次、深部活检并结合免疫组化(特别是GATA-3、CK7/20和Villin)进行精准的鉴别诊断,以避免误诊、漏诊,为患者制定正确的治疗策略。
病例核心价值及诊疗复盘
本病例的核心价值在于,它以一个极端案例的形式,为临床医生提供了三个重要警示:1)TN-ILC作为一种高度侵袭性肿瘤,其转移行为可能远超传统认知;2)对于乳腺癌患者,即使无消化道症状,也应警惕胃转移的可能性;3)面对来源不明的胃部恶性肿瘤,包含GATA-3在内的免疫组化组合是不可或缺的鉴别诊断工具。本病例凸显了对转移性乳腺癌患者进行全面、高警惕性评估的极端重要性。
1.Bray F, Laversanne M, Sung H, Ferlay J, Siegel RL, Soerjomataram I, Jemal A. Global cancer statistics 2022: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries. CA Cancer J Clin. 2024;74:229–263. doi: 10.3322/caac.21834. [DOI] [PubMed] [Google Scholar]
2.Leon-Ferre RA, Goetz MP. Advances in systemic therapies for triple negative breast cancer. BMJ. 2023;381:e071674. doi: 10.1136/bmj-2022-071674. [DOI] [PubMed] [Google Scholar]
3.Lin NU, Claus E, Sohl J, Razzak AR, Arnaout A, Winer EP. Sites of distant recurrence and clinical outcomes in patients with metastatic triple-negative breast cancer: High incidence of central nervous system metastases. Cancer. 2008;113:2638–2645. doi: 10.1002/cncr.23930. [DOI] [PMC free article] [PubMed] [Google Scholar]
4.Caparica R, Lambertini M, de Azambuja E. How I treat metastatic triple-negative breast cancer. ESMO Open. 2019;4((Suppl 2)):e000504. doi: 10.1136/esmoopen-2019-000504. [DOI] [PMC free article] [PubMed] [Google Scholar]
5.Kioleoglou Z, Georgaki E, Koufopoulos N, Kostek O, Volakakis N, Dimitriadou A, Kokkali S. Gastrointestinal metastases from lobular breast carcinoma: A literature review. Cureus. 2024;16:e65852. doi: 10.7759/cureus.65852. [DOI] [PMC free article] [PubMed] [Google Scholar]
6.Hong J, Kim Y, Cho J, Lim SW, Park SE, Kim HK, Lee H, Cho SY, Kim JY, Ahn JS, et al. Clinical features and prognosis of breast cancer with gastric metastasis. Oncol Lett. 2019;17:1833–1841. doi: 10.3892/ol.2018.9754. [DOI] [PMC free article] [PubMed] [Google Scholar]
7.Ito A, Nakatsubo M, Yoshino R, Yoshida N, Kitada M. Two cases of breast cancer with gastric metastasis. Cureus. 2023;15:e43434. doi: 10.7759/cureus.43434. [DOI] [PMC free article] [PubMed] [Google Scholar]
8.Dilawar H, Ahmed A, Habib S, Iqbal J, Abdul Rehman T, Hadi I, Nisa N, Fatima S. Gastric metastasis from invasive lobular breast cancer, resembling primary gastric cancer. J Nucl Med Technol. 2024;52:68–70. doi: 10.2967/jnmt.123.266035.
9.Liangxue Zhu, Yajun Xing, Mingyun Wang, et al. Triple-negative invasive lobular carcinoma presenting with synchronous gastric metastasis: A case report. Oncol Lett. 2025 Aug 25;30(5):496. doi: 10.3892/ol.2025.15242.
10.Yoo KC, Kim DH, Park S, Yun H, Ryu DH, Lee J, Son SM. Gastric Metastasis mimicking early gastric cancer from invasive ductal carcinoma of the breast: Case report and literature review. Medicina (Kaunas) 2024;60:980. doi: 10.3390/medicina60060980.
11.Taal BG, Peterse H, Boot H. Clinical presentation, endoscopic features, and treatment of gastric metastases from breast carcinoma. Cancer. 2000;89:2214–2221. doi: 10.1002/1097-0142(20001201)89:11<2214::AID-CNCR9>3.0.CO;2-D.
排版编辑:肿瘤资讯-zxy











 苏公网安备32059002004080号
苏公网安备32059002004080号


