2025年9月6日至9日,国际肺癌研究协会(IASLC)举办的2025年世界肺癌大会(WCLC)在西班牙巴塞罗那盛大召开。会上,II期IDeate-Lung01研究的主要研究结果以口头报告形式亮相OA06. Novel ADCs in SCLC专场,这是该研究自2024年WCLC大会后,再度登陆这项国际顶尖肺癌学术会议,显示了全球学界对其临床价值的高度认可。
本次报告数据显示[1],I-DXd治疗既往经治的广泛期小细胞肺癌(ES-SCLC)患者具有良好的缓解率、持久的疗效以及强效的颅内活性,安全性可控,显示了广阔的应用前景。
【肿瘤资讯】特邀复旦大学附属肿瘤医院王佳蕾教授对研究最新数据进行深入解读,分析ES-SCLC的治疗困境与I-DXd带来的突破意义。
复旦大学胸部肿瘤研究所 副所长
上海市女医师协会肺癌专业委员会 主任委员
中国抗癌协会肿瘤内科专委会 常委
中国临床肿瘤学会(CSCO)非小细胞肺癌专委会、小细胞专委会、血管靶向专委会、老年肿瘤防治专委会 委员
中国医疗保健促进会肿瘤内科分会、胸部肿瘤分会 常委
中国医药教育协会肺部肿瘤专业委员会 常委
上海市抗癌协会肺癌专委会常委,内科学组组长
上海市抗癌协会肿瘤呼吸病学专委会、脑转移瘤专委会、癌症康复与姑息治疗专委会(CRPC)、肿瘤药物临床研究专委会、转化医学专委会 常委
美国M.D. Anderson肿瘤中心访问学者
《中华医学杂志》英文版 编委
《中华转移性肿瘤杂志》 编委
ES-SCLC后线治疗手段有限,B7-H3有望成为潜在突破口
SCLC是肺癌中侵袭性最强的亚型之一,约占肺癌总数的13%–15%[2]。该类肿瘤具有增殖迅速、早期转移和复发率高的特点,患者预后普遍不佳[3]。约70%的患者在初诊时已处于广泛期,对于ES-SCLC,基于免疫检查点抑制剂的一线联合治疗已经成为标准治疗模式。然而,一旦出现复发或耐药,后线治疗的选择依然局限于传统化疗,如拓扑替康、伊立替康及铂类方案,ORR仅约20%,中位生存期不足半年[4-6],临床亟需更有效的治疗策略。
近年来,ADC成为ES-SCLC后线治疗的新希望,作为备受关注的“魔法子弹”,ADC可通过单克隆抗体识别肿瘤特异性抗原,达成对肿瘤细胞的“精准打击”,而选择合适的治疗靶点,是ADC精准、高效杀灭肿瘤细胞的前提。B7-H3便是SCLC研究中的热门潜在靶点。B7-H3是B7家族中的一类免疫调节蛋白,约65%的SCLC 患者存在中高强度的B7-H3表达,并且与更大的肿瘤体积与更高的肿瘤转移倾向及较差的患者预后有关[7,8]。
I-DXd是一种靶向B7-H3的新型ADC,采用GGFG四肽连接子,携带拓扑异构酶I抑制剂(DXd)作为有效载荷。此前在临床研究中,I-DXd在经治ES-SCLC中显示出积极的临床疗效和可控的安全性[9],本次更新数据进一步验证了这一结论。
I-DXd在经治ES-SCLC中疗效显著,亚组获益一致,脑转移患者亦具颅内活性
IDeate-Lung01研究是一项多中心、随机、开放标签、II期临床试验,旨在评估不同剂量水平的I-DXd治疗既往经治的ES-SCLC患者的疗效和安全性。第一阶段确定推荐剂量为12 mg/kg Q3W,第二阶段扩展队列在推荐剂量下进一步验证疗效和安全性。主要研究终点是盲态独立中心评估(BICR)的ORR,次要研究终点为BICR和研究者评估(INV)的持续缓解时间(DoR)、疾病控制率(DCR)、PFS、至缓解时间(TTR)、OS及安全性等。
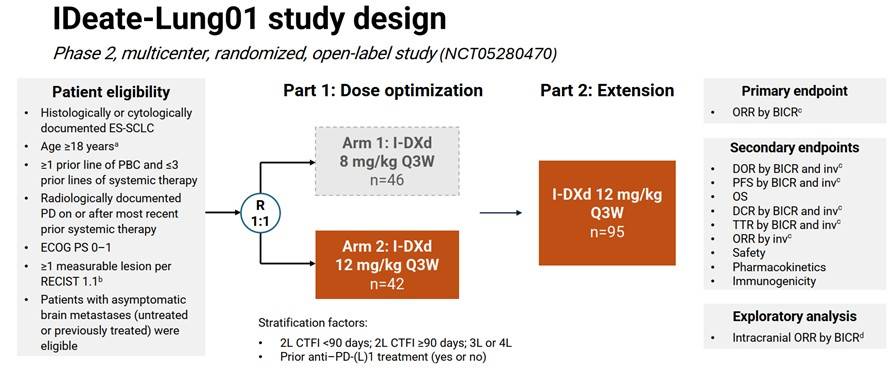
本研究共纳入137例接受12 mg/kg I-DXd治疗的患者,中位年龄为63岁(范围34–79岁),亚洲人群占比高达48.9%。基线时,38.0%的患者伴有脑转移,40.1%伴有肝转移。
在既往治疗方面,超过四分之三(76.6%)的患者接受过至少两线系统治疗,其中54.7%为二线、21.9%为三线。既往治疗史进一步凸显了入组人群的复杂性和临床真实世界的代表性:32.1%的患者接受过拓扑异构酶I抑制剂,21.2%接受过芦比替定,8.8%接受过氨柔比星,8.0%的患者曾接受过DLL3靶向T细胞衔接器(TCE)治疗。此外,81.0%的患者接受过免疫检查点抑制剂。
截至2025年3月3日,中位随访时间为12.8个月。研究结果显示,I-DXd在整体人群中展现出积极且持久的抗肿瘤活性。经BICR确认的ORR为48.2%,其中3例患者实现完全缓解;DCR达到87.6%,中位DoR为5.3个月。分层分析显示,I-DXd作为二线治疗ORR高达56.3%,DCR为96.9%;在三线及以上人群中,ORR和DCR分别为45.7%和84.8%。
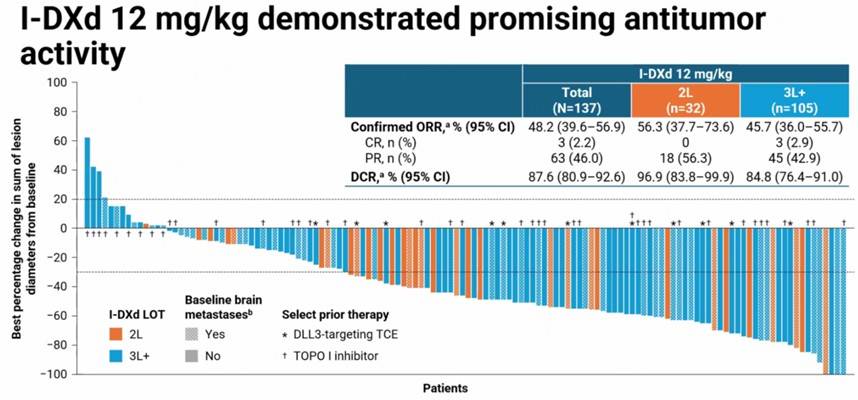
在生存数据方面,I-DXd治疗的中位PFS为4.9个月,中位OS为10.3个月。值得注意的是,在二线治疗中,中位PFS和OS分别达到5.6个月和12.0个月。
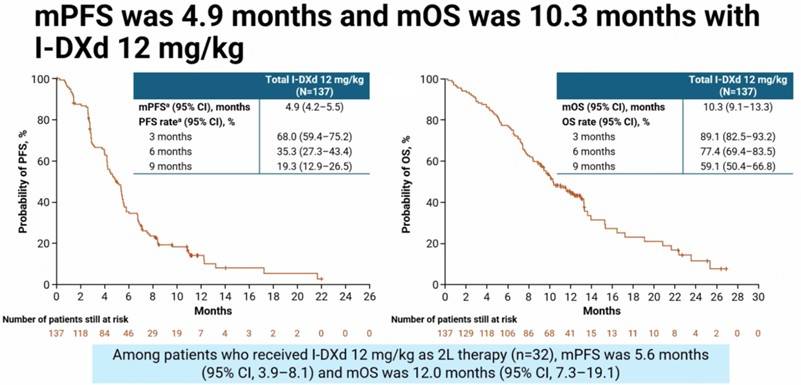
亚组分析显示,无论患者的铂类敏感性、治疗线数、是否存在脑/肝转移,或既往是否接受过免疫检查点抑制剂、拓扑异构酶I抑制剂、芦比替定或DLL3靶向TCE等,I-DXd均展现出一致的临床获益。
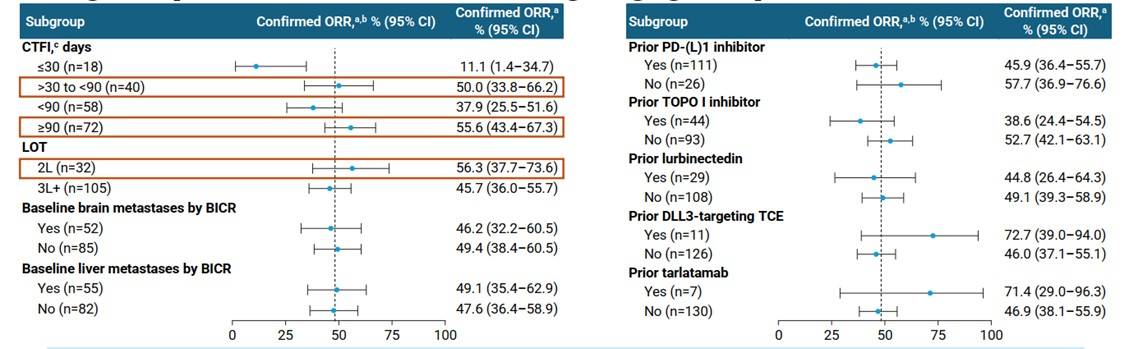
IDeate-Lung01研究允许纳入经治和未经治的无症状脑转移患者,在65例基线伴有脑转移的患者中,经确认的CNS ORR达到46.2%。
安全性方面,≥3级治疗相关不良事件(TRAEs)发生率为36.5%。常见不良事件包括恶心、中性粒细胞减少、贫血和食欲下降等,且大多为1–2级。与治疗相关的间质性肺病(ILD)/肺炎发生率为12.4%(n=17),其中多数为1–2级(n=11)。
总体上,I-DXd 12 mg/kg 在既往治疗的ES-SCLC中展现出显著疗效,在不同亚组均保持一致的疗效,并对脑转移患者展现颅内活性[11]。目前 I-DXd 的 III 期 IDeate-Lung02 研究已经启动,旨在评估 I-DXd 对比研究者选择的化疗方案(拓扑替康、氨柔比星或芦比替定)在仅接受过一线治疗 ES-SCLC 患者中的有效性及安全性。
新研究探索I-DXd联合DLL3靶向T细胞衔接器在ES-SCLC中的潜力
除单药应用外,关于I-DXd的更多临床探索也在积极推进。其中,MK6070-002研究(NCT06780137)作为TIP(Trials in Progress)在本次WCLC大会上公布[10]。该研究旨在评估I-DXd联合DLL3靶向T细胞衔接器Gocatamig(MK-6070;HPN328)在既往含铂化疗经治ES-SCLC患者中的疗效与安全性。
DLL3与B7-H3均在SCLC细胞表面高表达。既往研究显示,Gocatamig单药在复发/难治性SCLC中具有可管理的安全性和可观的抗肿瘤活性[11]。由于I-DXd与Gocatamig作用机制互补,且毒性谱重叠较少,因此二者联合有望在可接受的耐受性前提下进一步增强疗效。
I-DXd展现积极疗效,有望改写ES-SCLC后线格局
王佳蕾教授点评:ES-SCLC后线治疗长期以来选择有限,疗效不足,是临床亟待解决的难题。IDeate-Lung01研究最新结果显示,I-DXd在这一高难度人群中取得了积极且具有临床意义的疗效。
IDeate-Lung01 研究最新更新基于 137 例既往经治患者,结论更具稳健性。在二线人群中,I-DXd 的 ORR 达 56.3%,DCR 高达 96.9%;在三线及以上患者中,ORR 亦为 45.7%,DCR 达84.8%。二线患者的中位 PFS 和 OS 分别达 5.6 个月和 12.0 个月,在进展迅速、预后较差的 ES-SCLC 人群中具有重要临床意义。
亚组分析显示,无论铂不同敏感状态、伴脑或肝转移,以及既往接受免疫治疗、拓扑异构酶I抑制剂、芦比替定或DLL3靶向TCE治疗的患者,I-DXd均展示出一致疗效,凸显出I-DXd在复杂真实世界人群中的应用潜力。
另外值得关注的是I-DXd在脑转移患者中的疗效。在 ES-SCLC 的疾病进展过程中,有超过 50% 的患者会发生脑转移,这类人群预后较差[12-13],因此临床亟需具备颅内活性的治疗手段。脑转移可导致BBB 受损形成血肿瘤屏障(BTB),部分药物可因此透过并蓄积[14],I-DXd 的均一偶联设计、高效拓扑异构酶 I 抑制剂载药及旁观者效应,有助于其在脑转移灶中获得更好的渗透和抗肿瘤活性[15,16]。临床数据层面,本次研究结果显示出I-DXd的卓越颅内疗效,I-DXd在65 例基线脑转移患者中 CNS-ORR 高达46.2%。更完整的数据将在2025 年 ESMO 大会上公布。结合现有证据,I-DXd 的颅内活性表现令人惊艳。
作为 B7-H3 靶向 ADC 的代表,I-DXd 已在既往经治 ES-SCLC 患者中展现出积极且临床意义明确的疗效,显示出较高的缓解率、持久的生存获益以及不同亚组的一致疗效,成为当前后线治疗探索中的重要突破。相信随着 III 期 IDeate-Lung02 研究的推进,I-DXd 有望真正推动 ES-SCLC后线治疗模式的重塑。与此同时,I-DXd 的开发并不局限于单药探索,联合 DLL3 靶向TCE的研究亦在同步推进。两者在机制上的互补性,或将带来协同增效,为复发难治SCLC患者提供全新的治疗策略。
[1] M-J. Ahn, et al. Ifinatamab Deruxtecan (I-DXd) in Extensive-Stage Small Cell Lung Cancer: Primary Analysis of the Phase 2 IDeate-Lung01 Study. 2025 WCLC. OA06.03.
[2] Rudin CM, et al. Small-cell lung cancer. Nat Rev Dis Primers. 2021;7:3.
[3] Dómine M, et al. SEOM clinical guidelines for the treatment of small-cell lung cancer (SCLC) (2019). Clin Transl Oncol. 2020;22:245–55.
[4] HURWITZ JL, et al. New advances in the second-line treatment ofsmall cell lung cancerOncologist, 2009,14(10):986-994.
[5] SCHNEIDER BJ. Management of recurrent small cell lung cancer, J Natl Compr Cane Netw, 2008, 6 (3): 323-331.
[6] HUBER RM, RECK M, GOSSE H, et al. Eficacy of a toxicity-adjusted topotecan therapy in recurrent small cell19lung cancer. Eur Respir J,2006,27(6):1183-1189.
[7] Qiu M, et al. The expression of three negative co-stimulatory B7 family molecules in small cell lung cancer and their effect on prognosis. Front Oncol. 2021;11:600238.
[8] Carvajal-Hausdorf D, et al. Expression and clinical significance of PD-L1, B7–H3, B7–H4 and TILs in human small cell lung Cancer (SCLC). J Immunother Cancer. 2019;7:65.
[9] Rudin C M, et al. OA04. 03 ifinatamab deruxtecan (I-DXd) in extensive-stage small cell lung cancer (ES-SCLC): interim analysis of ideate-lung01[J]. Journal of Thoracic Oncology, 2024, 19(10): S15-S16.
[10] M. Johnson, et al. A Phase 1b/2 Study of Gocatamig and Ifinatamab Deruxtecan for Relapsed or Refractory Extensive-Stage Small Cell Lung Cancer. 2025 WCLC. P3.18.73.
[11]Molloy ME, et al. HPN328, a Trispecific T Cell-Activating Protein Construct Targeting DLL3-Expressing Solid Tumors. Mol Cancer Ther. 2024 Sep 4;23(9):1294-1304.
[12]Kalemkerian GP. Small Cell Lung Cancer. Semin Respir Crit Care Med. 2016 Oct;37(5):783-796. doi: 10.1055/s-0036-1592116. Epub 2016 Oct 12. PMID: 27732999.
[13]van Meerbeeck JP, Fennell DA, De Ruysscher DK. Small-cell lung cancer. Lancet. 2011 Nov 12;378(9804):1741-55. doi: 10.1016/S0140-6736(11)60165-7. Epub 2011 May 10. PMID: 21565397.
[14] Mair IJ, et al. Nat Rev Clin Oncol. 2023 Jun:20(6).372-389.
[15] AnamiY,et al Cell Rep. 2022 May 24,39(8)110839.
[16] Kabraji S, et al Clin Cancer Res.2023 Jan 4;29(1):174-182.
排版编辑:肿瘤资讯-Crystal











 苏公网安备32059002004080号
苏公网安备32059002004080号


