结直肠癌是全球第三大常见恶性肿瘤,2020年新发病例超过190万例,约占全球癌症相关死亡的9.4%1(93.5万例/年)。在中国,其发病率正在逐年攀升2。低位直肠癌(肿瘤距肛缘<5cm)因解剖位置特殊,传统治疗常需行腹会阴联合切除术(APR),导致永久性造口及肛门功能丧失,患者5年生活质量评分较保肛手术下降37%。新辅助放化疗(nCRT)作为局部晚期直肠癌的标准治疗,虽可提高手术切除率,但传统方案治疗后病理完全缓解(pCR)率仅11%~15% 3-4,患者疗效提升有限。
近年来,免疫治疗在dMMR/MSI-H人群中取得突破性进展,免疫检查点抑制剂(抗PD-1/PD-L1抗体)显著提高此类患者pCR率5-6(>60%),已被NCCN/CSCO指南推荐为新辅助标准治疗;然而,此类患者仅占5%~20%7,针对占比更高的pMMR(错配修复功能完整)患者,如何提高此类肿瘤对免疫治疗的敏感性,仍是当前临床实践的关键瓶颈。
本期分享一例由姚宏伟教授点评的pMMR超低位直肠癌新辅助治疗病例:通过“替雷利珠单抗联合新辅助放化疗”实现肿瘤退缩(接近临床完全缓解,near cCR),并成功实施经肛局部切除术,术后病理证实ypT0,术后随访已超12个月,未见复发迹象,为广泛pMMR低位直肠癌人群提供了器官保留及预后获益新策略。
患者基本情况及入院检查
基本情况:
男,60岁,因“排便习惯改变1年,发现直肠占位2周”于2024年03月19日就诊。
直肠指诊:
距离肛门3cm,可触及直肠后壁肿物,直径约3.5cm,指套未带血。
肠镜:
紧邻肛门口可见一隆起肿物,表面肿胀粗糙,局部凹陷,触之易出血,肠镜活检病理为“直肠腺癌”。
免疫组化(MMR检测):
MLH1(+),MSH2(+),MSH6(+),PMS2(+)
胸腹盆CT:
未见肝肺转移征象。
直肠MRI:
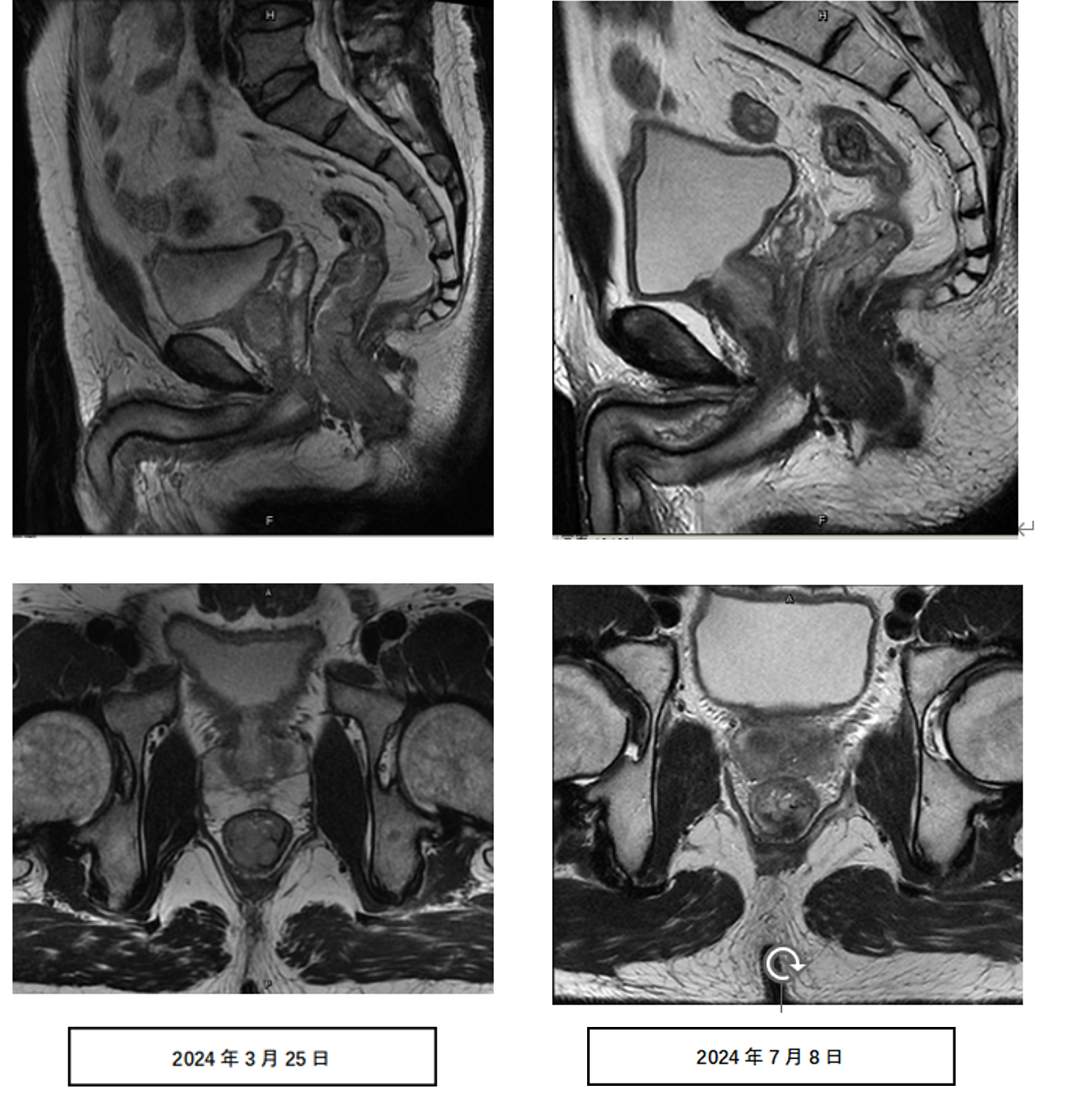
检查所见:病变部位:直肠下段,距肛管直肠环约1.1cm;距肛缘约3.2cm;范围受累肠管长度约4.3cm,肠壁最厚处约2.1cm,累及直肠环周3/4,主要累及后壁;T分期:T3,后壁部分可疑突破直肠外膜;N分期:直肠系膜筋膜内可见多发小淋巴结,较大者短径约0.5cm。MRF(-)。
基线肿瘤分期诊断:
超低位直肠下段癌,cT3N1M0。
治疗过程及相应疗效评估
患者2024年4月8日至2024年5月13日接受长程放疗(50Gy),同步口服卡培他滨;分别于2025年4月21日、2025年5月10日、2025年5月30日行3周期替雷利珠单抗治疗(200mg,iv,q3w);于2024年5月30日、2025年6月20日行2周期capeOX化疗(奥沙利铂 130mg/m2 iv D1+卡培他滨1000mg/m2 po bid D1-D14,q3w)。
新辅助治疗后评估情况如下
直肠指诊:距离肛门3.5cm,可触及直肠后壁浅溃疡,直径约0.5cm,局部黏膜皱缩,指套未带血。
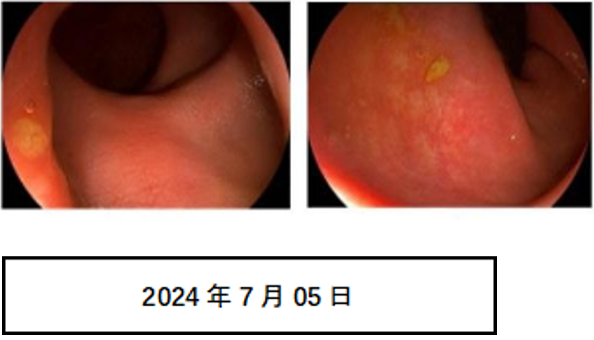
肠镜:直肠距肛缘3~4cm可见部分黏膜粗糙,质硬,余所见黏膜光滑。诊断:直肠癌放疗后改变。
直肠MRI:病变部位:直肠下段,距肛管直肠环约1.2cm;距肛缘约3.2cm;范围受累肠管长度约0.7cm,肠壁最厚处约1.4cm,累及直肠环周1/4,主要累及后壁;T分期:T2,后壁部分可疑侵及肌层;N分期:直肠系膜筋膜内可见多发小淋巴结,较大者短径约0.4cm。MRF(-)。
检查诊断:超低位直肠癌治疗后改变,病灶部分较前黏液化、纤维化,范围较前缩小,请结合临床及相关检查。
治疗相关的不良反应(TRAE):用药期间出现骨髓抑制2级,对症治疗后好转。未出现免疫相关不良事件。精神、饮食可,体重无明显变化。
治疗前后肠镜: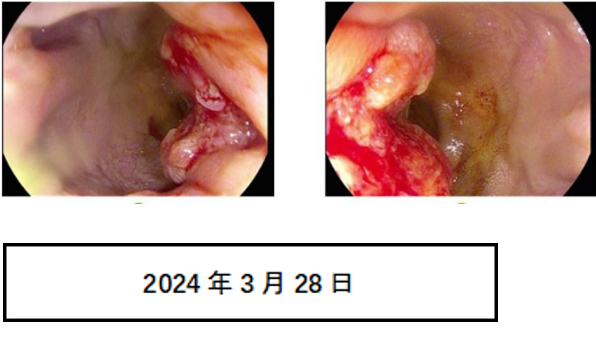
治疗前后直肠MRI:
新辅助治疗后肿瘤分期:
ycT2N0M0
新辅助治疗后疗效评估:
接近临床完全缓解(near cCR)
手术及随访
手术治疗:
患者于2024-07-15行经肛腔镜直肠肿物微创切除术,术中全层切除直肠肿瘤治疗后的退缩病灶。
术后病理:
肠壁局灶黏膜糜烂,伴慢性炎细胞浸润,局灶纤维组织增生伴小灶钙化,局灶腺体腺瘤样增生,未见癌。两侧断端均未见癌。(ypT0)
手术后TNM分期:
ypT0 ycN0M0
术后方案:
术后辅助化疗 capeOX*2周期(2024年8月18日、2024年9月7日)
随访:
患者术后恢复良好,肛门功能满意。目前术后随访中,定期复查(包括肠镜、影像学、肿瘤标志物),截至当前,随访时间已超12个月,未见复发征象。不仅达到了器官功能保留,还实现了长期生存获益。
本期特邀专家——姚宏伟教授
主任医师、教授、博士生导师
现任首都医科大学附属北京友谊医院普外中心教授,胃肠外科主任
兼任首都医科大学结直肠癌免疫治疗基础-临床联合实验室主任,首都医科大学普通外科学系副主任,首都医科大学结直肠肿瘤临床诊疗及研究中心副主任
担任中华医学会外科学分会结直肠外科学组委员兼秘书,中华结直肠外科学院秘书长,中华消化外科教育学院院长,中国医师协会结直肠肿瘤分会常委,中国研究型医院学会结直肠肛门外科专委会副主任委员。美国结直肠外科医师学会荣誉会士(FASCRS), 欧洲结直肠病学会全球影响力委员会委员,《Diseases of the Colon&Rectum》杂志编委
致力于结直肠肿瘤的外科手术学、肿瘤学以及功能学研究,作为首要研究者(PI),目前牵头1项国际多中心随机对照研究,牵头8项国内多中心随机对照/前瞻队列研究
作为第一作者/通讯作者在Nature Medicine 2025(IF=58.5), Signal Transduction and Targeted Therapy 2024(IF=52.7), Gastroenterology 2023(IF=29.3), International Journal of Surgery 2023/2025(IF=15.3), Biomaterials 2022(IF=15.0), Trends in Cancer 2025(IF=14.3),Chemical Engineering Journal 2024(IF=13.3) Med 2024(IF=12.5), British Journal of Surgery 2020/2023/2024/2025(IF=11.2), Research 2024(IF=10.7)等国际知名期刊发表多篇原创性研究成果
曾被评为“北京市优秀人才”、“北京大学医学部优秀人才”,新疆维吾尔自治区党委和人民政府“优秀援疆干部”并荣立个人二等功
专家点评
中国是全球结直肠癌负担最重的国家之一,其中低位直肠癌的治疗尤为棘手。传统治疗模式下,肿瘤距离肛缘<5cm的低位直肠癌患者往往需要接受腹会阴联合切除术(APR),永久性造口不仅对患者生理功能造成显著影响,更带来巨大的心理和社会适应压力。如何在不牺牲肿瘤学安全性的前提下实现器官保留(保肛甚至保直肠),一直是直肠癌治疗领域的核心挑战。
新辅助放化疗(nCRT)的广泛应用为部分患者提供了降期和保肛机会,但传统方案对低位直肠癌患者的病理完全缓解率(pCR)仅11%~15%,保肛率不足30%。近年来,PD-1/PD-L1抑制剂为恶性肿瘤提供了新的治疗选择。Keynote-177研究5表明,dMMR/MSI-H晚期结直肠癌患者可从PD-1单抗治疗中获益(有效且安全)。NICHE试验6进一步证实,新辅助免疫治疗对dMMR/MSI-H结直肠癌患者安全有效。然而,此类患者仅占5%~20%7,绝大多数为pMMR/MSS型患者,如何提高这部分人群的免疫治疗敏感性,仍是临床面临的重大挑战。
由本中心前期发起的一项研究[PD-1抑制剂联合长程同步放化疗联合治疗局部晚期直肠癌(NECTAR)的疗效和安全性:一项多中心II期研究],46例接受新辅助长程放疗联合替雷利珠单抗治疗并接受后续直肠癌根治手术的pMMR/MSS型中低位直肠癌患者,手术后病理结果显示,病理完全缓解率(pCR率)为43.5%,3级以上治疗相关不良事件(irAEs)发生率4.3%,其显示此治疗策略具有较好的疗效及安全性8-9。目前本中心正在开展pMMR/MSS型局部进展期直肠癌的新辅助放化疗联合免疫治疗的全国多中心III期随机对照研究(RCT),来进一步验证新辅助免疫治疗联合放化疗的疗效和安全性。
针对该名局部进展期pMMR超低位直肠癌患者,本病例采用替雷利珠单抗联合新辅助放化疗治疗策略,术前新辅助治疗阶段就实现肿瘤显著退缩,由cT3N1M0降期为ycT2N0M0,并评估为“接近临床完全缓解(near cCR)”,并经过经肛局部切除肿瘤退缩病灶以及病理证实局部无肿瘤残留(ypT0),成功保留肛门直肠功能,并获长期无瘤生存(术后随访已超12个月,未见复发迹象)。
同时,患者治疗全程安全性良好,在保证了肿瘤学安全的前提下,短期及长期的生活质量也都得到了保障,为直肠癌器官功能保全与生存获益提供了关键实践依据。展望未来,以替雷利珠单抗为核心的新辅助免疫治疗联合放化疗方案,有望助力更多直肠癌患者实现功能与生存的双重改善。
中国的研究者在过去的3~5年内开展了诸多高水平的针对pMMR/MSS型局部进展期直肠癌的新辅助放化疗联合免疫治疗的多中心前瞻性研究[10-15],取得了平均高达40%的CR率(包括pCR率或者cCR率),为直肠癌的新辅助和保器官治疗提供了新思路,以及新的高水平循证医学证据支持,为中低位直肠癌患者提高保肛手术率、甚至免根治手术(保直肠)提供更多的机会,并可能进一步降低肿瘤局部复发率、提高总生存率。
针对pMMR/MSS型局部进展期直肠癌的新辅助放化疗联合PD-1免疫治疗方案,也首次写入2025年版《CSCO结直肠癌诊疗指南》。随着越来越多的研究证据呈现,直肠癌新辅助治疗的模式正在逐渐转变,诊断分型和综合治疗更精准,也必将带来更多的患者获益。
1.Sung H, Ferlay J, Siegel RL, et al. Global Cancer Statistics 2020: GLOBOCAN Estimates of Incidence and Mortality Worldwide for 36 Cancers in 185 Countries. CA Cancer J Clin. 2021;71(3):209-249. doi:10.3322/caac.21660.
2.W. Chen, R. Zheng, P.D. Baade, S,et al. Cancer statistics in China, 2015, CA Cancer J Clin 66(2) (2016) 115-32.
3.Gérard J, Conroy T, Bonnetain F, et al. Preoperative radiotherapy with or without concurrent fluorouracil and leucovorin in t3-4 rectal cancers: results of ffcd 9203. J Clin Oncol. 2006;24(28):4620-5.
4.Bosset J, Calais G, Mineur L, et al. Enhanced tumorocidal effect of chemotherapy with preoperative radiotherapy for rectal cancer: preliminary results-EORTC 22921. J Clin Oncol. 2005;23(24):5620-7.
5.Andre T, Shiu KK, Kim TW, et al. Pembrolizumab in microsatellite-instability-high advanced colorectal cancer. N Engl J Med. 2020;383(23):2207–18.
6.Verschoor YL, van den Berg J, Beets G, et al: Neoadjuvant nivolumab, ipilimumab, and celecoxib in MMR-proficient and MMR-deficient colon cancers: Final clinical analysis of the NICHE Study. Am Soc Clin Oncol 2022.
7.Sahin IH, Zhang J, Saridogan T, et al. Neoadjuvant immune checkpoint inhibitor therapy for patients with microsatellite instability-high colorectal cancer: shedding light on the future. JCO Oncol Pract. 2023;19(5):251-259.
8.Yao H, Yang Z, Gao J, et al. Safety and efficacy evaluation of long course neoadjuvant chemoradiotherapy plus tislelizumab followed by total mesorectal excision for locally advanced rectal cancer: Short-term results of a multicenter, phase II study. J Clin Oncol, 2022 (suppl 16): e15599.
9.Yang Z, Gao J, Zhang X, et al. Safety and efficacy evaluation of long-course neoadjuvant chemoradiotherapy plus tislelizumab followed by total mesorectal excision for locally advanced rectal cancer: Intermediate results of a multicenter, phase II study. Ann Oncol, 2022, 33 (suppl_9): S1445.
10.Xia F, Wang Y, Wang H, et al. Randomized Phase Ⅱ Trial of Immunotherapy - Based Total Neoadjuvant Therapy for Proficient Mis match Repair or Microsatellite Stable Locally Advanced Rectal Cancer (TORCH). J Clin Oncol. 2024; 42 (28): 3308 - 3318.
11.Lin ZY, Zhang P, Chi P, et al. Neoadjuvant short - course radiotherapy followed by camrelizumab and chemotherapy in locally advanced rectal cancer (UNION): early outcomes of a multicenter randomized phase Ⅲ trial. Ann Oncol. 2024; 35 (10): 882 - 891.
12.Xiao WW, Chen G, Gao YH, et al. Effect of neoadjuvant chemoradiotherapy with or without PD - 1 antibody sintilimab in pMMR locally advanced rectal cancer: A randomized clinical trial. Cancer Cell. 2024; 42 (9): 1570 1581. e4.
13.Li Y, Pan C, Gao Y, et al. Total Neoadjuvant Therapy With PD - 1 Blockade for High - Risk Proficient Mismatch Repair Rectal Cancer. JAMA Surg. 2024; 159 (5): 529 - 537.
14.Yang Z, Gao J, Zheng J, et al. Efficacy and safety of PD - 1 blockade plus long - course chemoradiotherapy in locally advanced rectal cancer (NECTAR): a multi - center phase 2 study. Signal Transduct Target Ther. 2024; 9 (1): 56.
15.Yang Y, Pang K, Lin G, et al. Neoadjuvant chemoradiation with or without PD-1 blockade in locally advanced rectal cancer: a randomized phase 2 trial. Nat Med. 2025,31(2):449-456.
排版编辑:肿瘤资讯-邓文普
往期回顾:
【结直肠癌】晚期后线肠癌患者接受替雷利珠单抗联合西妥昔单抗和化疗,PFS长达11个月











 苏公网安备32059002004080号
苏公网安备32059002004080号


