弥漫性大B细胞淋巴瘤(DLBCL)中存在一个特殊亚群,其特征为明显的结外侵犯倾向,好发于中枢神经系统(CNS)、玻璃体和睾丸等免疫豁免部位。此外,该类淋巴瘤复发时病灶常仍局限于这些特殊解剖位置,提示其发生发展可能受到独特的遗传背景或微环境选择压力驱动。
基于这些特性,原发于免疫豁免部位的大B细胞淋巴瘤(IP-LBCL)被归类为一组相对罕见且具有高度侵袭性的B细胞淋巴瘤。尽管目前已有多种治疗策略,但IP-LBCL患者仍面临着高复发率与高死亡率的严峻挑战,实现长期生存极为困难 。近期,山西白求恩医院侯淑玲教授团队发表的一篇综述,系统性地阐述了IP-LBCL的流行病学、发病机制、诊断方法、治疗策略及预后因素,并对美国国家综合癌症网络(NCCN)与欧洲肿瘤内科学会(ESMO)的相关指南治疗推荐进行了深度比较 。为进一步解析该领域的前沿进展,【肿瘤资讯】将梳理该篇综述的核心内容,并呈献侯淑玲教授的专业点评与见解。
走进IP-LBCL
揭秘疾病的分子起源与治疗挑战
IP-LBCL作为2022年第五版世界卫生组织淋巴肿瘤分类中新确立的疾病单元,涵盖了一组发生于CNS、玻璃体视网膜及睾丸等特殊部位的罕见侵袭性B细胞淋巴瘤。该分类主要包括原发性中枢神经系统淋巴瘤(PCNSL)、原发性睾丸大B细胞淋巴瘤(PTL)和原发性玻璃体视网膜大B细胞淋巴瘤(PVRL),并因生物学特征相似性,将血管内大B细胞淋巴瘤(IVLBCL)及原发性皮肤DLBCL腿型等也纳入此范畴。这些部位存在的血脑屏障(BBB)、血视网膜屏障和血睾屏障等生理性壁垒,导致了IP-LBCL治疗反应差、复发率高及预后不良等问题。
IP-LBCL的发病率相对较低,如PCNSL的年发病率约为十万分之零点四,且随患者的年龄增长而升高;PTL则占所有非霍奇金淋巴瘤的1%~2%,好发于老年男性人群。IP-LBCL的发病机制极为复杂,宏观层面,硬脑膜中的脑膜淋巴管(mLVs)及星形胶质细胞构成的血管周围通道系统的功能障碍,可能影响了脑内废物的清除,从而促进了PCNSL的发生。
微观层面,基因组不稳定性是IP-LBCL核心特征,其中MYD88L265P和CD79B基因的协同突变尤为关键,此特征使其被称为MCD/C5亚型淋巴瘤。这些突变通过持续激活Toll样受体(TLR)和B细胞受体(BCR)信号,进而激活下游的核因子-κB(NF-κB)通路,促进肿瘤细胞的生存与增殖。此外,CDKN2A基因的缺失以及人类白细胞抗原(HLA)位点的丢失,构成了肿瘤细胞周期失调和免疫逃逸的重要分子基础,尤其在PCNSL和PTL中表现显著。
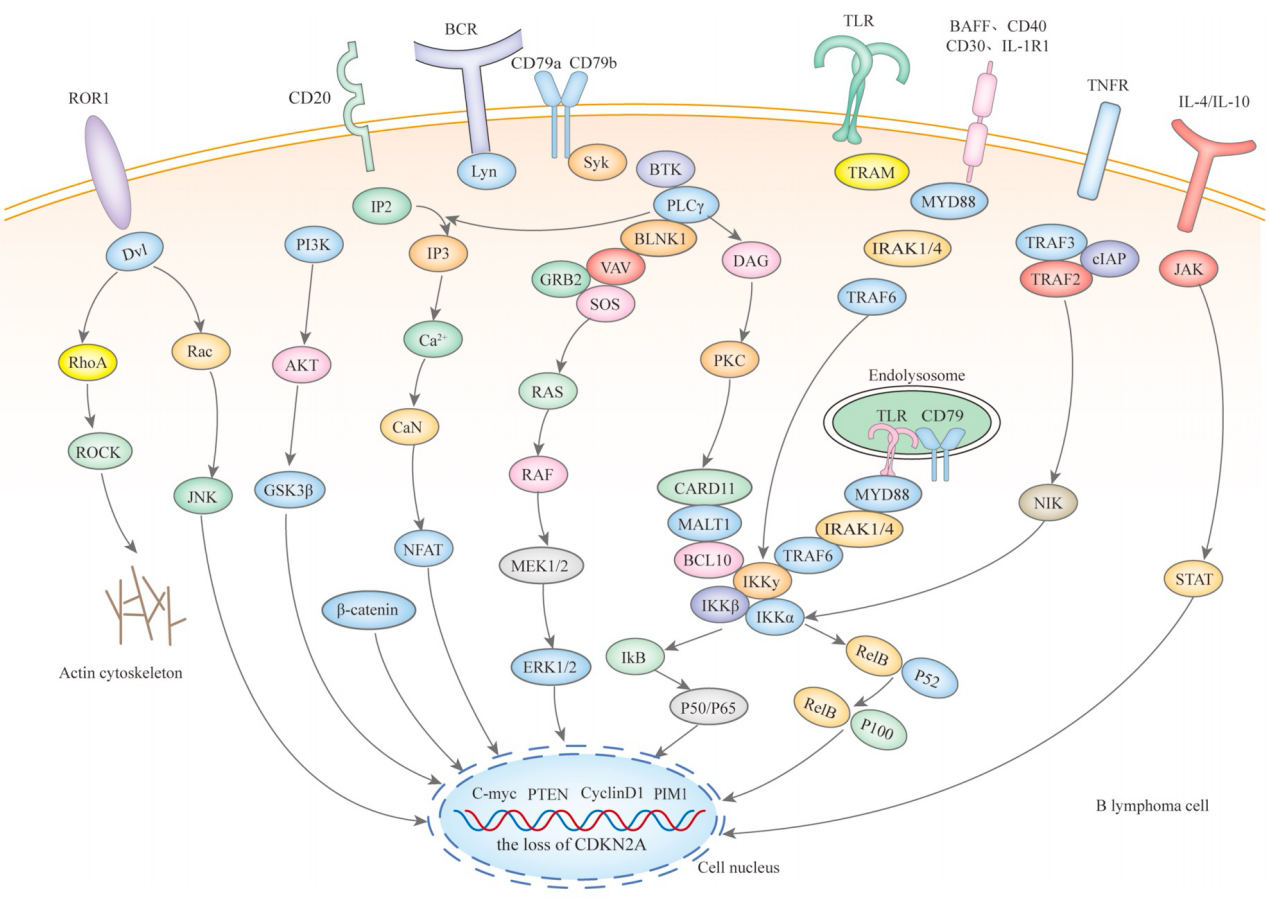
揭开IP-LBCL的神秘面纱
疾病诊断进阶图鉴
在诊断方面,病理学检查始终是确立IP-LBCL诊断的基石。而针对不同部位,IP-LBCL优选的诊断方法各异。其中,对于PCNSL患者,推荐采用立体定向活检;对于PTL患者,首选睾丸切除术以获取完整组织,而PVRL患者则依赖玻璃体活检。
除传统的组织病理学,一系列辅助诊断技术极大地提升了IP-LBCL诊断的精确性。实验室检查中,患者脑脊液或房水/玻璃体液中的细胞因子水平,特别是白细胞介素-10(IL-10)与白细胞介素-6(IL-6)的比值以及C-X-C基序趋化因子配体13(CXCL13)的检测,已成为诊断PCNSL和PVRL的重要生物标志物。
影像学技术同样至关重要,对比增强磁共振成像是PCNSL的首选检查方法,而光学相干断层扫描(OCT)等眼科影像技术则对PVRL的诊断具有独特价值。18F-FDGPET/CT在评估IP-LBCL病变范围和治疗反应中显示出较高的价值,但需警惕其假阳性与假阴性的局限性。近年来,液体活检技术,如检测循环肿瘤DNA(ctDNA)和微小RNA(miRNAs),因其无创和可实时监测的优势,在IP-LBCL诊断、疗效评估及微小残留病监测中展现出巨大潜力。同时,基于多组学数据的分析,已将PCNSL划分为4个具有不同预后意义的分子亚型(CS1-CS4),为未来的个体化治疗奠定了基础。
点亮IP-LBCL治疗新希望
靶向、免疫与细胞疗法谱写疾病治疗新篇章
IP-LBCL的治疗极具挑战性,目前临床实践主要参照NCCN和ESMO的指南。对于PCNSL,大剂量甲氨蝶呤(HD-MTX)为基础的诱导化疗是标准一线方案,而完全缓解后的巩固治疗可选择全脑放疗(WBRT)或自体干细胞移植(ASCT)。对于PTL,标准治疗为睾丸切除术后联合R-CHOP方案化疗,并需进行中枢神经系统预防。PVRL的治疗则通常参照PCNSL方案。
尽管标准化疗在IP-LBCL中取得了一定进展,但疗效仍不尽人意。靶向治疗的出现为IP-LBCL带来了生存新曙光,特别是能够穿透生理屏障的新型药物。以泽布替尼为代表的新一代布鲁顿酪氨酸激酶抑制剂(BTKi),通过抑制BCR信号通路,在PCNSL和PVRL中展现出显著的疗效。
免疫检查点抑制剂通过阻断PD-1/PD-L1通路,能够逆转肿瘤微环境中的T细胞耗竭状态,在PCNSL和PTL中观察到良好的临床反应。而来那度胺和泊马度胺等免疫调节剂在IP-LBCL中亦表现出单药活性。
值得一提的是,靶向CD19的嵌合抗原受体T细胞(CAR-T)疗法,作为一种革命性的治疗手段,已被证实能够穿过患者的BBB。尽管CAR-T细胞疗法相关的细胞因子释放综合征(CRS)和免疫效应细胞相关神经毒性综合征(ICANS)等不良反应仍需密切管理,但其在复发/难治性IP-LBCL患者中取得了高缓解率和持久应答仍令人鼓舞。
表1. 不同药物的血脑屏障透过率
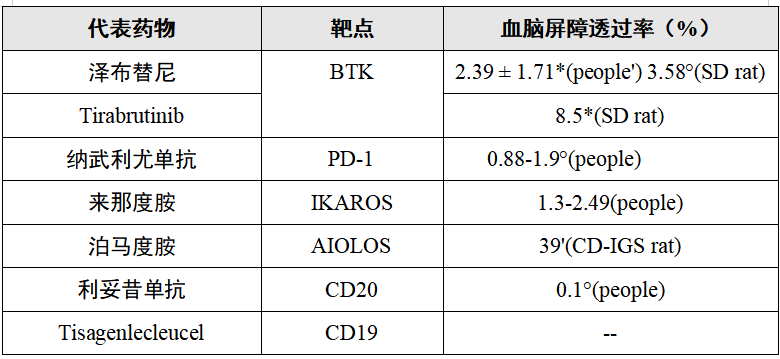
尽管针对IP-LBCL的一系列潜在新药尚未应用于临床实践,但其已展现出广泛的治疗前景。其中,ROR1小分子抑制剂可通过靶向ROR1酪氨酸激酶(TK)结构域内的ATP结合位点,下调包括非经典Wnt通路(PKC和PI3Kδ/AKT/mTOR)及经典Wnt/β-catenin通路在内的ROR1信号通路,从而诱导ROR1阳性的DLBCL细胞系凋亡。鉴于IP-LBCL中ROR1的高表达特性,ROR1小分子抑制剂有望成为该疾病的一个新型治疗靶点。
双特异性抗体则提供了另一种创新治疗策略,其能够一端连接T细胞表面的CD3,另一端结合肿瘤抗原,从而在肿瘤局部形成免疫突触,不依赖主要组织相容性复合体(MHC)与T细胞的相互作用,便可触发穿孔素、颗粒酶及细胞因子的级联释放以裂解肿瘤细胞。对于常常因MHC缺失而导致免疫逃逸的IP-LBCL而言,这一机制具有独特的细胞毒性潜力。
抗体药物偶联物(ADCs)作为一种前沿疗法,其将单克隆抗体的靶向性与小分子药物的强效细胞毒性相结合,通过靶向结合、内化、毒素释放和细胞杀伤四个步骤诱导肿瘤细胞凋亡。
此外,攻克BBB等生理壁垒是开发IP-LBCL免疫疗法的核心挑战,利用转铁蛋白受体(TfR)、CD98hc以及金纳米颗粒(AuNPs)等载体有望为大分子药物进入免疫豁免区开辟新途径。动物实验已证明,脑血管内皮表达的TfR和CD98hc能促进大分子物质的跨细胞转运;而AuNPs则可通过与激光脉冲的相互作用,产生局部生物物理效应以暂时性增加BBB的通透性。
总体而言,将单克隆抗体、双特异性抗体乃至ADCs与这些载体技术相结合,为解决IP-LBCL治疗药物渗透难题提供了潜在的解决方案。
拨开预后迷雾,超越传统评分
多维生物标志物描绘IP-LBCL个体化预后新版图
在预后评估方面,传统的国际预后指数(IPI)或针对PCNSL的IELSG和MSKCC评分模型存在一定局限性。为此,研究者们开发了多种新型预后模型,其整合了更多维度的预后因素,如18个月内疾病进展(POD18)、肿瘤相关巨噬细胞标志物、乳酸脱氢酶与淋巴细胞比值(LLR)、特定基因突变以及全身炎症反应指数等,从而实现了更精准的风险分层。对于PTL患者,研究发现B症状、BTG2或TP53突变、HLA缺失及肿瘤微环境中T淋巴细胞含量低等均与其不良预后相关。对PVRL患者预后的研究虽有限,但已有证据表明血清IgA水平可能与其复发和生存相关。
总结
综上所述,临床对IP-LBCL这一特殊类型淋巴瘤的认识正在不断深化。未来,整合多组学数据与人工智能技术开发新型生物标志物和预后模型,探索以ROR1为代表的新治疗靶点,利用TfR等载体技术突破BBB以递送大分子药物,和优化CAR-T细胞疗法的设计以增强疗效并降低毒性,将是该领域的研究重点。通过合理联合靶向治疗、免疫治疗及细胞治疗等多种手段,制定个体化的治疗策略,有望最终攻克IP-LBCL的治疗壁垒,显著改善患者的生存结局。
Wang L, Guo M and Hou S (2025) Advances in primary large B-cell lymphoma of immune-privileged sites. Front. Immunol. 16:1533444. doi: 10.3389/fimmu.2025.1533444
排版编辑:肿瘤资讯-zly











 苏公网安备32059002004080号
苏公网安备32059002004080号


