拓培非格司亭注射液是一种新型Y型支链聚乙二醇修饰的长效重组人粒细胞集落刺激因子,是我国1类创新药。临床研究证实拓培非格司亭注射液能显著缩短非髓系恶性肿瘤患者化疗相关中性粒细胞减少症的持续时间、降低发热性中性粒细胞减少症的发生风险。2023年6月拓培非格司亭注射液在我国获批上市。鉴于国内大部分临床医师对拓培非格司亭注射液的用药经验有限,专家组成员参考国内外相关研究、指南共识及临床实践,制定了拓培非格司亭注射液临床用药指导原则,旨在为我国临床医师相关用药提供参考。
拓培非格司亭注射液是一种新型长效聚乙二醇化重组人粒细胞集落刺激因子(PEG-rhG-CSF),其特点是采用了第3代相对分子质量约40×10 3的Y型支链聚乙二醇(PEG)进行修饰。2023年6月,拓培非格司亭注射液获中国国家药品监督管理局(NMPA)批准用于接受易引起发热性中性粒细胞减少症(FN)的骨髓抑制性抗癌药物治疗的非髓系恶性肿瘤患者。本指导原则的制定参照国内外权威指南、临床研究和临床实践,并结合目前拓培非格司亭注射液在我国的应用现状,供临床医师参考。
1 拓培非格司亭注射液概述
1.1 拓培非格司亭注射液的作用机制
目前,第3代支链PEG衍生物被证明相比线型结构的PEG衍生物表现出更优越的药理学特性,如支链PEG能使修饰后的蛋白药物具有更高的稳定性、更长的半衰期、更低的免疫原性和更高的生物利用度 [ 2 , 3 , 4 ]。拓培非格司亭注射液采用全球创新的新型Y型支链PEG(相对分子质量约40×10 3)修饰,其结构和制备工艺专利已覆盖中国、美国、澳大利亚、加拿大等多个国家,其化学结构式见 图1 。拓培非格司亭注射液的作用机制是重组人粒细胞集落刺激因子(rhG-CSF)与造血细胞表面特定的受体结合后作用于造血细胞,从而刺激中性粒细胞的增殖、分化、定型与成熟细胞功能活化。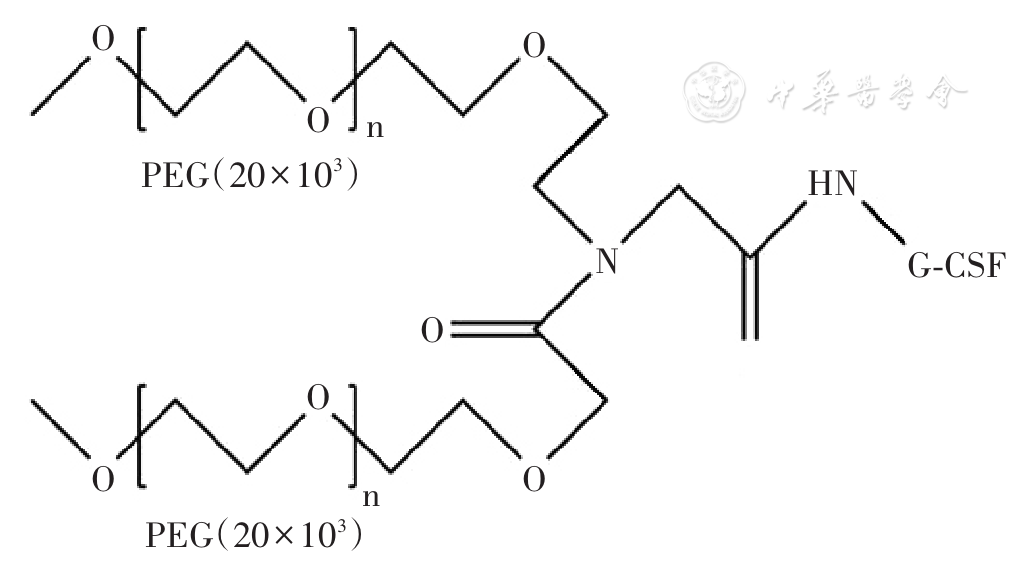
1.2 拓培非格司亭注射液的药代动力学和药效学特征
在拓培非格司亭注射液的Ⅰ期药代动力学研究中,30例未经放化疗的非小细胞肺癌和乳腺癌患者接受了不同剂量拓培非格司亭注射液(20、30、45、60 μg/kg)单次皮下注射。结果显示,在20~45 μg/kg剂量下,拓培非格司亭注射液在人体内呈线性药代动力学特征,而在60 μg/kg剂量下,药代动力学特征为非线性。Ⅱ期研究进一步评估了拓培非格司亭注射液与对照药PEG-rhG-CSF的药代动力学特征。结果显示,拓培非格司亭注射液3个剂量组(20、30、45 μg/kg)共注射2个周期,达峰时间(T max)为2.05~4.35 d;对照药物剂量为100 μg/kg,共注射2个周期,T max为2.35~2.50 d。拓培非格司亭注射液30 μg/kg剂量组的达峰浓度(C max)为11.85~14.95 ng/ml,约为对照药物C max(112.71~122.27 ng/ml)的1/10,药物的骨髓刺激峰值更低,可能降低中性粒细胞过度增殖所致的骨痛与血象波动。两项研究表明,拓培非格司亭注射液的清除半衰期(T 1/2)为56.9~90 h。
在拓培非格司亭注射液Ⅰ期药效学研究中,30例受试者的中性粒细胞绝对计数(ANC)均值在化疗第1个周期(筛选期)的第11天达到最低值(1.25×10 9/L),在化疗第2个周期(试验期:拓培非格司亭注射液给药期)的第8天达到最低值(3.21×10 9/L),在化疗第3个周期(短效rhG-CSF对照期)的第18天达到最低值(2.53×10 9/L)。与筛选期和对照期比较,试验期ANC均值达到最低的发生时间明显提前,数值明显提高,拓培非格司亭注射液展现出了很好的预期疗效。试验期ANC在化疗周期的第13天达到第2个峰值,均值为6.87×10 9/L,而对照药物短效rhG-CSF组的ANC于化疗周期第11天达到第2个峰值,均值为11.26×10 9/L。与对照药物相比,拓培非格司亭注射液的第2个ANC峰值较低,作用更为平稳。
拓培非格司亭注射液的血药浓度与ANC具有相关性。以拓培非格司亭注射液20 μg/kg组为例,ANC从化疗第3天起开始下降,到第7天降至最低点,其间拓培非格司亭注射液血药浓度于第3天达到峰值,随后开始缓慢下降,在第8天至第10天间ANC持续上升,第10天达第2个峰值,此后ANC维持在较高水平,此时拓培非格司亭注射液的血药浓度开始迅速下降。
2 拓培非格司亭注射液的临床研究
2.1 拓培非格司亭注射液的有效性
一项针对未经放化疗的非小细胞肺癌和乳腺癌患者的拓培非格司亭注射液Ⅰ期研究采用自身对照设计。研究分为两个周期:第1个周期为单纯化疗(空白对照周期),第2个周期在化疗结束后48 h给予患者单次注射拓培非格司亭注射液(试验周期)。结果显示,与空白对照周期相比,试验周期中2、3、4级ANC减少的发生率显著降低,其中4级ANC减少的发生率从空白对照期的43.33%降至试验周期的3.33%。
拓培非格司亭注射液的Ⅲ期研究是一项多中心、随机、开放、阳性对照的非劣效性试验,纳入接受化疗的乳腺癌和非小细胞肺癌患者。患者按1∶1∶1随机分配至拓培非格司亭注射液固定剂量2 mg组、拓培非格司亭注射液按体质量给药33 μg/kg组或阳性对照组。阳性对照组患者第1个化疗周期每日皮下注射短效rhG-CSF 5 μg/kg,在第2个至第4个化疗周期自愿选择注射其他长效PEG-rhG-CSF 6 mg或继续注射短效rhG-CSF 5 μg/kg。主要疗效指标为第1个化疗周期4级ANC减少持续时间,非劣效界值Δ=±1 d。研究结果显示,拓培非格司亭注射液2 mg组或33 μg/kg组的主要疗效指标均非劣于阳性对照组,在265例乳腺癌患者中,在第个1化疗周期,拓培非格司亭注射液2 mg组、拓培非格司亭注射液33 μg/kg组和阳性对照组中,4级ANC减少的平均持续时间分别为0.58、0.74、0.48 d,拓培非格司亭注射液(2 mg和33 μg/kg)组与阳性对照组的最小二乘均值(LSMEAN)分别为0.10 d(95% CI:-0.19~0.38 d, P=0.51)和0.22 d(95% CI:-0.09~0.52 d, P=0.17);在132例非小细胞肺癌中,拓培非格司亭注射液2 mg组、拓培非格司亭注射液33 μg/kg组和阳性对照组中,4级ANC减少的平均持续时间分别为0.02、0.09、0.16 d。拓培非格司亭注射液组(2 mg和33 μg/kg)与阳性对照组的LSMEAN分别为-0.14 d(95% CI:-0.35~-0.06 d, P=0.175)和-0.06 d(95% CI:-0.26~-0.15 d, P=0.571)。
此外,拓培非格司亭注射液还能有效降低FN发生率,在乳腺癌患者中,化疗第1个周期拓培非格司亭注射液组FN的发生率为2.8%,阳性对照组为3.4%;在非小细胞肺癌患者中,化疗第1个周期拓培非格司亭注射液组FN的发生率为1.1%,阳性对照组为2.3%。这些结果表明,拓培非格司亭注射液两个剂量组均能有效预防化疗相关中性粒细胞减少症,降低FN发生率,疗效非劣于短效rhG-CSF。
在第2至第4个化疗周期的研究中,仅5例乳腺癌患者使用了12个周期的短效rhG-CSF,而非小细胞肺癌患者对照组均使用其他长效PEG-rhG-CSF。基于此,Ⅲ期研究的第2至第4个化疗周期比较了拓培非格司亭注射液与其他长效PEG-rhG-CSF的疗效。结果显示,拓培非格司亭注射液与对照药物PEG-rhG-CSF在FN发生率、≥3级ANC减少的发生率和持续时间、ANC恢复至2.0×10 9/L以上的时间和抗生素使用率等疗效评价指标方面,差异均无统计学意义(均 P>0.05)。
2.2 拓培非格司亭注射液的免疫原性
拓培非格司亭注射液的Ⅰ~Ⅲ期临床试验中评估了其免疫原性。研究显示,基线时拓培非格司亭注射液组和对照组的抗药物抗体(ADA)阳性率分别为7.6%和9.3%,中和抗体(NAb)阳性率分别为0.8%和1.3%,组间差异均无统计学意义;在基线ADA阴性的患者中,拓培非格司亭注射液组新增ADA阳性率为0.7%,对照组为6.6%,两组间差异有统计学意义( P=0.001 1)。试验期间未发现新增NAb阳性患者,且基线ADA阳性或新增ADA阳性均未对疗效和安全性产生影响。
3 拓培非格司亭注射液的临床应用推荐
3.1 拓培非格司亭注射液的适应证
拓培非格司亭注射液适用于非髓系恶性肿瘤患者在接受易引起FN的骨髓抑制性抗癌药物治疗时,降低以FN为表现的感染发生率。
拓培非格司亭注射液已被纳入《国家基本医疗保险、工伤保险和生育保险药品目录(2023年)》,属乙类医保,医保支付范围为限前次化疗曾发生重度中性粒细胞减少的患者。
3.2 拓培非格司亭注射液用法、用量推荐
拓培非格司亭注射液应在每个化疗周期抗肿瘤药物给药结束后(48±12)h进行单次皮下注射。多个指南共识均推荐在每个周期化疗结束后24~72 h单次皮下注射PEG-rhG-CSF 。一项研究评估了拓培非格司亭注射液在化疗结束后24~48 h给药的有效性和安全性。结果显示,24 h给药亚组在预防3~4级中性粒细胞减少的效果与总体人群一致,不良反应仅限于轻度骨痛,发生率为3.2% 。鉴于拓培非格司亭注射液属于PEG-rhG-CSF类药物,因此推荐在每个周期化疗结束后的24~72 h使用。
拓培非格司亭注射液使用剂量如下:对于体质量≥45 kg的患者,推荐首选按固定剂量2 mg进行皮下注射;对于体质量<45 kg的患者,按体质量给药,推荐剂量为33 μg/kg。拓培非格司亭注射液有效剂量较其他长效G-CSF剂量低。传统PEG-rhG-CSF推荐剂量为6 mg或100 μg/kg,硫培非格司亭推荐剂量为6 mg,艾贝格司亭α推荐剂量为20 mg。
拓培非格司亭注射液有两种包装形式,拓培非格司亭注射液(预充注射器)和拓培非格司亭注射液(预充式注射笔)。拓培非格司亭注射液(预充式注射笔)是一次性使用的固定剂量注射笔,为国内首个注射笔型的长效G-CSF。拓培非格司亭注射液(预充式注射笔)无需剂量设置,具有防刺伤和给药后自动锁死的特点,允许患者在完成化疗后自行注射,提高了给药便捷性和精密度。
3.3 拓培非格司亭注射液的临床应用推荐
中性粒细胞减少症和FN的发生增加了肿瘤患者感染风险,严重时可引发感染性休克和脓毒综合征等致命并发症。中国临床肿瘤学会(CSCO)肿瘤放化疗相关中性粒细胞减少症规范化管理指南(2021)中建议接受高风险化疗方案的患者预防性使用G-CSF;对于接受中风险化疗方案且存在自身风险因素(如既往化疗或放疗)的患者,也建议预防性使用G-CSF。Ⅲ期研究已证实拓培非格司亭注射液可有效缩短ANC减少的持续时间并降低FN发生风险,因此推荐满足指南条件的患者预防性使用拓培非格司亭注射液。
既往研究证实了PEG-rhG-CSF在同步放化疗中的应用价值。在一项针对60例接受同步放化疗子宫颈癌患者的随机对照研究中,放疗后2 h给予6 mg PEG-rhG-CSF组3级以上ANC减少发生率显著低于对照组(10%比77.78%, P<0.001)。多个指南共识推荐PEG-rhG-CSF用于恶性肿瘤患者同步放化疗期间中性粒细胞减少症的一、二级预防。Ⅲ期研究结果证实了拓培非格司亭注射液的临床疗效和安全性非劣于PEG-rhG-CSF,因此各指南共识中推荐的PEG-rhG-CSF适应证同样适用于拓培非格司亭注射液。
4 拓培非格司亭注射液的主要不良反应及注意事项
拓培非格司亭注射液按体质量33 μg/kg给药和2 mg固定剂量给药的总体耐受性良好,药物相关不良反应的发生率均低于10%。拓培非格司亭注射液不良反应的类型和发生率与短效rhG-CSF及其他长效PEG-rhG-CSF基本一致。常见不良反应(发生率≥1%)包括血小板减少、乏力、恶心、头痛、头晕、食欲减退、骨骼肌肉痛等。不良反应多为轻至中度,通常不需要治疗或在给予适当对症药物治疗后缓解,不影响患者治疗。
骨痛是G-CSF类药物常见的不良反应,其发生与癌种相关,乳腺癌中发生率高于肺癌。在拓培非格司亭注射液Ⅲ期试验中,乳腺癌患者使用拓培非格司亭注射液的骨痛发生率2 mg组为3.4%,33 μg/kg组为2.3%,对照组为5.7%;非小细胞肺癌患者三组骨痛发生率依次为2.3%、0、6.8%。研究报道其他PEG-rhG-CSF的骨骼肌肉痛发生率在乳腺癌患者中3 mg组为40%,6 mg组为38.3%,在肺癌患者中3 mg组为15.7%;艾贝格司亭α 20 mg用于乳腺癌患者的骨痛发生率为25%;硫培非格司亭用于非小细胞肺癌患者的骨痛发生率6 mg组为4.17%,100 μg/kg组为2.13%。拓培非格司亭注射液在多项研究中表现出更低的骨痛发生率,提示其具有较优的耐受性特征。
对于发生骨痛的患者,可采用非甾体抗感染药物进行对症治疗,对于不适合非甾体抗感染药物或非甾体抗感染药物治疗无效的患者,可考虑使用抗组胺类药物如氯雷他定等。目前不推荐通过降低拓培非格司亭注射液剂量来治疗其药物相关性骨痛。
对于在培非格司亭等其他同类药物中观察到的脾破裂、急性呼吸窘迫综合征、肾小球肾炎、主动脉炎等不良反应,在拓培非格司亭注射液的研究中目前尚鲜见报道,但临床仍需关注。
有研究纳入356例非髓系恶性肿瘤患者,其中17.1%(61例)为≥65岁,1.1%(4例)为≥75岁,均接受了至少1次拓培非格司亭注射液注射。老年患者与年轻患者(<65岁)在安全性和有效性方面差异均无统计学意义,因此无需调整剂量。但鉴于临床研究样本量有限,不能完全排除临床使用中的差异性。
目前尚无拓培非格司亭注射液在妊娠期和哺乳期女性及儿童中的研究数据,相关人群用药安全性尚不明确。
5 总结
拓培非格司亭注射液作为我国1类创新药物,其第3代新型Y型支链PEG修饰技术赋予了它独特优势,包括更低的免疫原性、更长的半衰期、更平稳的药效作用以及更好的安全性。临床研究证实拓培非格司亭注射液能有效缩短化疗相关中性粒细胞减少症持续时间,降低FN风险。拓培非格司亭注射液的给药剂量仅为传统PEG-rhG-CSF的1/3,在实现相似疗效的同时,降低了药物对骨髓的过度刺激和骨痛发生率。本指导原则推荐拓培非格司亭注射液用于化疗或同步放化疗引起的中性粒细胞减少的预防,建议在每个化疗周期结束后的24~72 h进行单次皮下注射。此外,拓培非格司亭注射液(预充式注射笔)为国内首个注射笔型的长效G-CSF,允许患者自行注射。总之,拓培非格司亭注射液的上市不仅丰富了临床治疗手段,更为医生和患者带来了一种安全、有效的治疗新选择,有望改善患者的治疗体验和临床结局。
排版编辑:Cherry












 苏公网安备32059002004080号
苏公网安备32059002004080号


