急性髓系白血病(AML)是一种侵袭性强、预后差的血液系统恶性肿瘤,尽管治疗手段不断进步,但患者生存率仍有待提高。传统的新药审批依赖于大型随机对照试验(RCT)中以“总生存期”(OS)为主要终点,这类研究耗时长、成本高,往往延缓了有效药物上市的步伐。
近年来,可测量残留病灶(MRD)作为评估疾病负担和预测治疗反应的重要指标,逐渐受到关注。然而,尽管MRD已用于指导临床决策,但因其检测方法、阈值、时间点不统一,以及缺乏在试验水平上与OS获益的严格验证,它尚未被全球监管机构正式接受作为AML临床试验的主要终点用于新药批准。
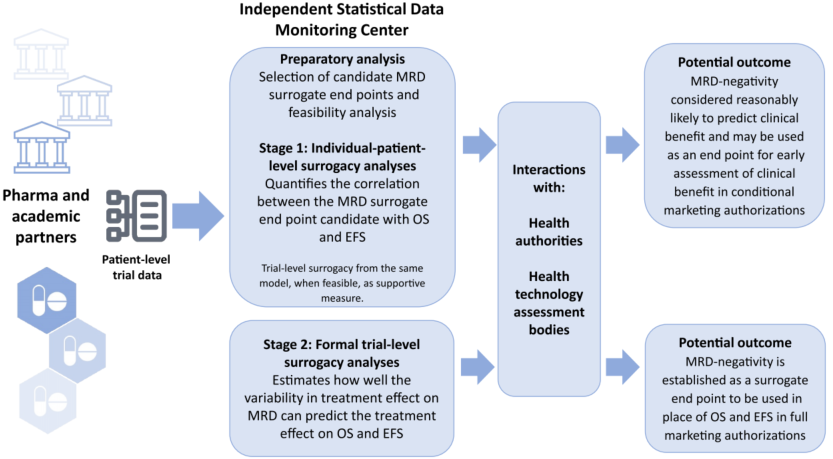
为此,MRD Partnership and Alliance in AML Clinical Treatment(MPAACT)联盟发起了一项旨在验证MRD作为AML临床药物审批替代终点的研究。近期,该研究结果已发表于Cancer杂志中,【肿瘤资讯】现将该研究主要内容整理如下,以飨读者。

MRD指的是通过流式细胞术(MFC)、定量PCR(qPCR)、下一代测序(NGS)等高灵敏度技术,在患者达到形态学完全缓解(CR)后,仍能检测到的微量白血病细胞。它代表了更深层次的缓解状态。大量研究表明,达到MRD阴性的患者,其无病生存期(DFS)和OS均显著优于MRD阳性者,具备成为替代终点的潜力。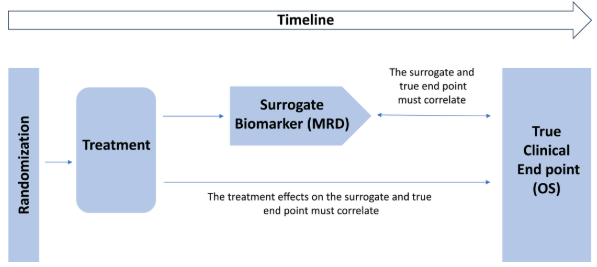
然而,MRD要正式纳入AML临床试验监管框架,仍需解决三大核心问题:一是检测方法缺乏标准化,不同技术灵敏度与适用性差异大;二是缺乏统一的MRD阈值与评估时间点;三是需在试验层面验证MRD与OS的关联性,而非仅停留在患者个体层面的相关性。为此,2018年成立的MPAACT联盟联合药企、学术机构、监管部门等多方力量,致力于构建MRD作为替代终点的验证路径。
研究团队通过系统综述与数据分析,从MRD检测技术、临床应用证据、监管指导原则、统计验证方法及患者可及性五大维度展开研究,具体如下:
MRD检测技术对比:系统评估多参数流式细胞术(MFC)、实时定量聚合酶链反应(RT-qPCR)、数字 droplet PCR(ddPCR)、下一代测序(NGS)四种主流技术的优势、劣势及适用场景,重点分析各技术的检测灵敏度、患者覆盖率与标准化难度。
临床证据梳理:分别汇总成人与儿童AML临床试验中MRD的应用数据,包括不同治疗方案(强化化疗、低强度治疗、维持治疗等)下MRD状态与预后的关联,以及MRD转化(从阳性转为阴性)对治疗效果的预测价值。
监管与统计验证:整理美国食品药品监督管理局(FDA)、欧洲药品管理局(EMA)等机构的相关指导原则,设计“两步法”统计验证框架——先验证患者个体层面MRD与OS的相关性,再通过荟萃分析验证试验层面MRD治疗效应与OS治疗效应的关联性。
患者可及性分析:调研健康技术评估(HTA)机构与医保支付方对MRD作为替代终点的接受度,分析MRD检测普及面临的经济与技术障碍。
MRD检测技术各有优劣,标准化是关键
四种主流MRD检测技术在灵敏度、覆盖率与实用性上呈现显著差异,具体如下表所示:

研究同时指出,当前MRD检测存在两大共性问题:一是样本质量影响结果解读,监管机构常将不合格样本或缺失数据默认视为MRD阳性;二是检测方法验证不充分,2014~2021年美国 FDA收到的196项血液肿瘤药物申请中,仅28%包含MRD数据,且AML相关申请无一项将MRD数据纳入最终说明书,核心原因是检测验证不足(65%)与检测性能不稳定(24%)。
成人与儿童AML中,MRD均展现强预后价值
成人AML:MRD指导治疗决策显成效
2020年一项纳入11151例患者的荟萃分析显示,MRD阴性患者5年DFS率(64% vs 25%)与 OS率(68% vs 34%)显著优于MRD阳性患者,且这一关联在强化化疗、低强度治疗、移植后维持治疗等不同场景中均成立。
在靶向治疗领域,MRD的价值更为突出:例如在FLT3突变AML中,移植后使用FLT3抑制剂维持治疗,仅MRD阳性患者的复发风险显著降低(HR=0.52,95%CI:0.32-0.84,P=0.0065),而MRD阴性患者无明显获益;在IDH1/2突变AML中,使用艾伏尼布联合阿扎胞苷治疗后,MRD阴性患者的CR率与生存期均显著高于MRD阳性患者。此外,低强度治疗方案(如维奈克拉联合低剂量阿糖胞苷)中,MRD阴性患者的6个月OS率达8.4个月,远高于MRD阳性患者的4.1个月。
儿童AML:MRD是独立不良预后因素
与成人数据一致,儿童AML中MRD阳性同样是无事件生存期(EFS)、无复发生存期(RFS)、累积复发率(CIR)与OS的独立危险因素。一项纳入13项前瞻性与回顾性研究的系统综述显示,诱导治疗结束时(EOI1或EOI2)MRD阴性的儿童患者,3年OS率可达75%~100%,而 MRD阳性患者仅为56%左右。
不过,儿童与成人AML的MRD应用存在两点差异:一是儿童试验中MFC(阈值多为≥0.1%)是最主要的检测方法,NGS等分子技术应用较少;二是儿童试验中对照组设置较少,MRD对治疗效果的预测价值尚未充分验证。
监管指导原则逐步明确,统计验证路径清晰
各国监管机构已针对 MRD 制定初步指导原则,为其作为替代终点提供方向:
FDA:在2022年指南中认可骨髓MRD<0.01%可作为疗效支持证据,并指出“MRD阴性CR”(即 CR同时达到预设MRD阈值)可作为加速审批的早期终点。2024年4月,FDA肿瘤药物咨询委员会(ODAC)进一步支持,在多发性骨髓瘤中,基于患者个体层面MRD与OS的强关联,MRD阴性CR可用于加速审批,这一逻辑或可推广至AML。
EMA:强调MRD需同时具备预后与预测价值,要求MRD分析需结合EFS/OS趋势,且药物需显著降低MRD水平;建议在荟萃分析中按检测方法(MFC/PCR/NGS)分层,区分移植与非移植患者,并探索不同治疗方案(强化/低强度)下的MRD价值。
英国药品和医疗产品监管局(MHRA):建议先验证年龄对MRD的影响,再决定是否合并成人与儿童数据,同时需关注MRD动态变化(如基线至治疗后的对数降低)的意义。
在统计验证方面,研究提出“两步法”框架:
第一步(患者个体层面):采用Plackett copula模型计算全局比值比,评估MRD阴性与OS的关联强度,95%置信区间排除1.0即视为有统计学意义;同时通过landmark生存分析验证 MRD 的预后价值。
第二步(试验层面):通过加权最小二乘法与双变量Plackett copula模型计算决定系数(R²),R²越接近1,表明MRD治疗效应对OS治疗效应的预测能力越强。截至2025年4月,MPAACT已收集10项RCT数据,另有4项正在推进,预计可满足统计验证的样本量需求。
患者可及性:需平衡疗效与经济价值
尽管MRD作为替代终点可加速新药审批,但要实现患者广泛获益,还需解决HTA机构与医保支付方的顾虑:一是MRD获益能否转化为长期健康相关生活质量提升;二是基于MRD批准的药物是否具备成本效益;三是不同检测技术的普及度与支付能力差异可能加剧医疗不平等。
目前,仅7/73个国际HTA机构发布了替代终点的详细方法学指南,且各机构关注重点不一。对此,MPAACT正与欧洲卫生技术评估网络(EUnetHTA)等机构合作,推动MRD验证标准与医保政策的衔接,建议采用“共同主要终点”设计(如MRD+OS),在加速审批的同时,通过长期随访验证药物真实世界价值。
结论
该研究证实,MRD凭借其对AML患者预后的强预测价值,以及在缩短新药研发周期中的潜力,已成为AML新药审批替代终点的核心候选指标。但要实现这一目标,仍需三方协同推进:
技术层面:加快MFC与NGS检测的标准化,统一灵敏度标准(如MFC最低检测限 0.1%、NGS 针对特定突变检测限 5×10-5)与操作流程;
监管层面:基于MPAACT的荟萃分析数据,推动FDA、EMA等机构出台MRD作为替代终点的正式指南,明确阈值设定与评估时间点(如诱导治疗结束时、移植前);
临床层面:在儿童AML与复发/难治性AML中补充MRD验证数据,同时探索MRD指导的个体化治疗策略(如MRD阳性患者强化维持治疗)。
MPAACT联盟表示,未来将持续推进数据共享与跨领域合作,预计3~5年内完成MRD作为替代终点的全面验证。若这一目标达成,AML新药研发周期或缩短30%~50%,更多靶向疗法、免疫疗法将更快惠及患者,为AML治疗带来革命性变革。
Boyiadzis M, Wei A H, Paiva B, et al. Measurable residual disease (MRD) as a surrogate end point for clinical drug approval in acute myeloid leukemia (AML): Perspectives from the MRD Partnership and Alliance in AML Clinical Treatment Consortium[J]. Cancer, 2025, 131(13): e3596
排版编辑:Mathilda











 苏公网安备32059002004080号
苏公网安备32059002004080号


