近日,国际知名肿瘤学期刊《肿瘤学年鉴》(Annals of Oncology,IF 65.4)发表了一项由德国AIO和意大利GONO两大肿瘤研究协作组主导的研究。该研究通过对11项大型随机临床试验中近3000例患者数据的汇总分析,旨在探索转移性结直肠癌(mCRC)一线治疗期间疾病进展(PD)的风险规律。研究发现,疾病进展风险并非随时间线性增长,而是在治疗开始后的6~8个月内出现高峰。BRAF突变、右半结肠、体能状态不佳等是早期进展的关键风险因素,而早期肿瘤缩小(ETS)则是强有力的良好预后指标。这一发现为制定更精准、个体化的影像学评估策略提供了高级别证据,有望优化患者管理、减少不必要的医疗负担。

为何需要重新审视mCRC一线治疗的影像学监测策略?
对于不可手术切除的转移性结直肠癌(mCRC)患者,一线标准化疗联合靶向药物是基石治疗(中位PFS 9~12个月)。国际指南通常推荐每2~3个月进行一次影像学检查(如CT检查)以评估疗效和监测疾病进展。
然而,这一固定周期的监测方案证据等级不高,且未考虑患者的个体化差异,如肿瘤的生物学行为或随时间变化的进展风险。同时,频繁的CT检查不仅给患者带来辐射暴露、心理焦虑等问题,也增加了医疗系统的经济负担。因此,探索一种更合理、更具生物学依据的个体化监测策略至关重要。
汇集11项临床研究数据(近3000例患者)
为解决这一临床问题,研究人员进行了一项汇总分析,纳入了来自AIO和GONO两大欧洲知名研究机构的11项重要临床试验(包括TRIBE、MOMA、TRIBE2、 VALENTINO、ATEZOTRIBE、TRIPLETE、FIRE-3、XELAVIRI、PANAMA、FIRE-4和FIRE-4.5)的数据。
经过严格筛选,最终共有2939例接受一线治疗的不可切除mCRC患者被纳入分析。研究团队详细评估了疾病进展(PD)事件在治疗过程中的频率分布,并结合了关键的临床及分子生物学特征,如RAS/BRAF基因状态、肿瘤原发部位(左/右半结肠)、体能状态(ECOG PS)以及首次影像评估时的早期肿瘤缩小(ETS)情况,以构建疾病进展的预测模型。
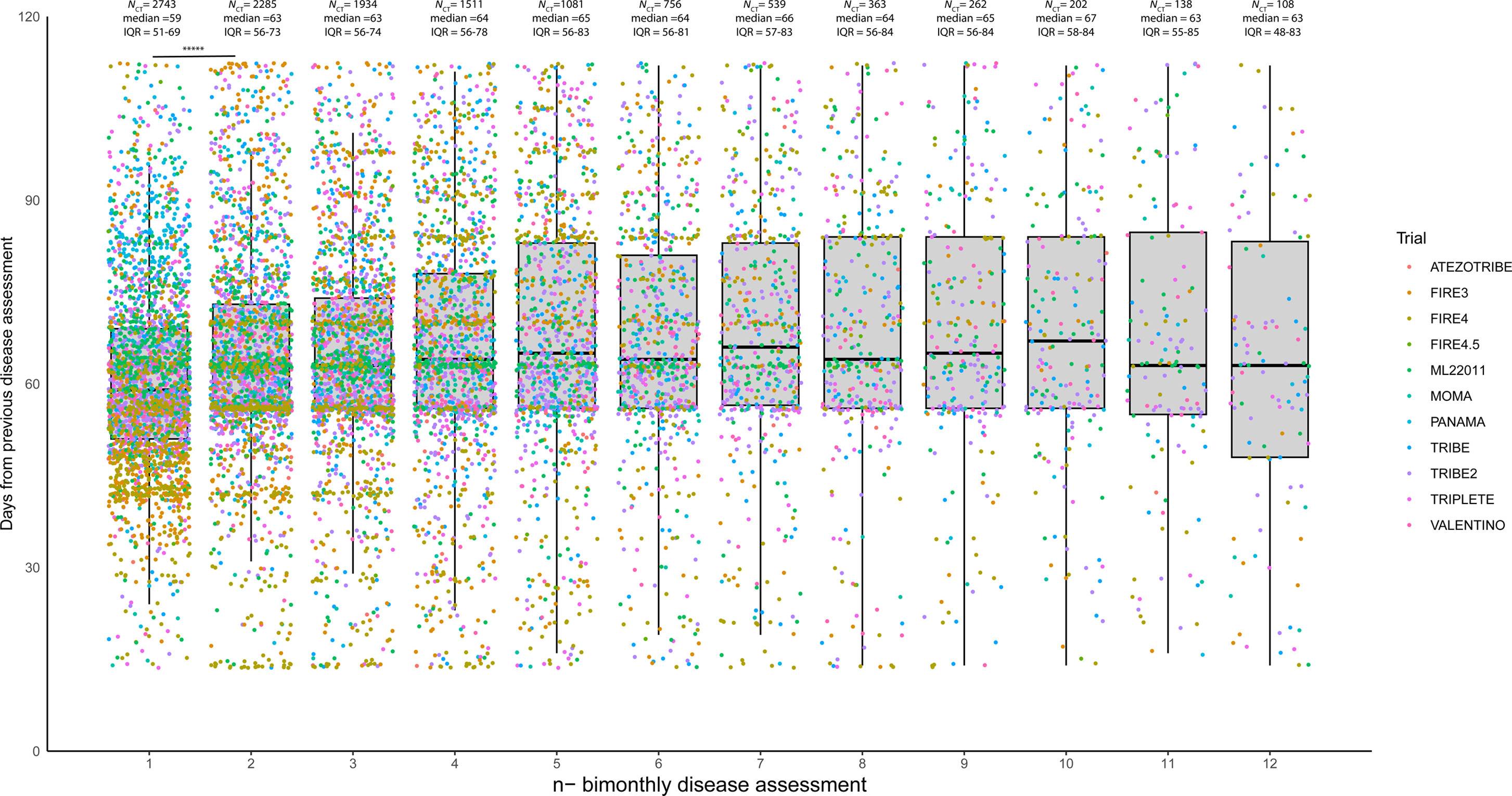
11项研究(AIO和GONO)
总体人群:疾病进展风险呈非线性,存在“高危窗口期”
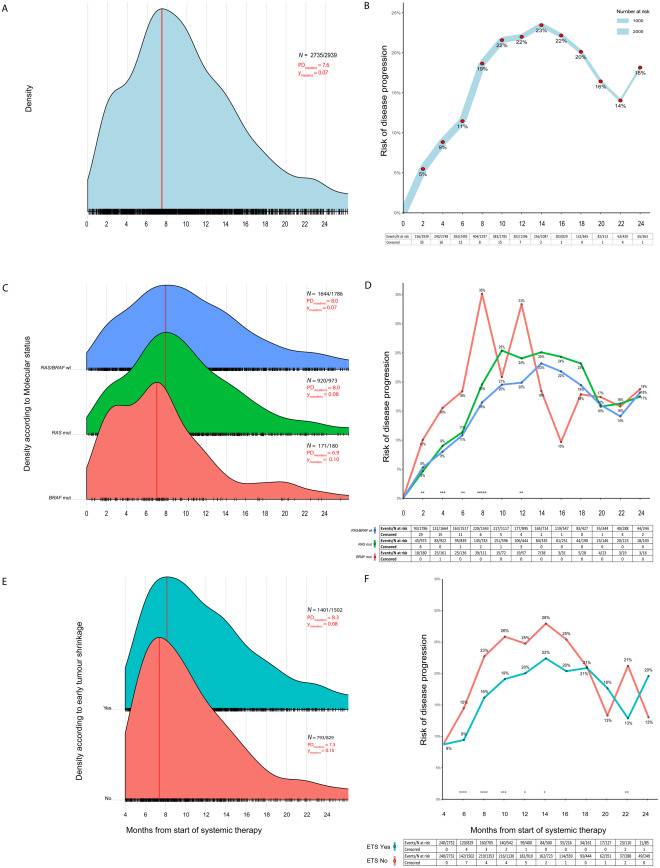
共检测到2735例疾病进展(PD)事件,其中2123例(78%)发生在治疗期间,612例(22%)发生在治疗间歇期。PD事件的发生并非均匀分布。PD事件的最高频率出现在治疗开始后的7.6个月。PD风险从2个月时的5%缓慢攀升至6个月时的11%,随后在两个月后迅速增至19%,之后在10~16个月间趋于平缓,维持在22%~23%,并在14个月时达到风险峰值(23%)。此后,PD风险在18~24个月间降至14%~20%。在pMMR/MSS肠癌患者(n=800例)中也观察到类似的模式。
分子分型影响疾病进展节奏,BRAF突变型进展最早
不同分子亚型的患者,其疾病进展模式存在差异,清晰地揭示了肿瘤的内在生物学行为:
BRAF突变型(n=180例):进展风险最高且出现最早(6.9个月),在治疗后8个月即达到35%的风险顶峰(8个月时RAS突变型、RAS/BRAF野生型分别为20%和16%)。
RAS突变型(n=973例):风险峰值紧随其后,在10个月时达到25%。
RAS/BRAF野生型(n=1786例):该亚组的风险增长最为平缓,进展高峰出现最晚,在14个月时达到23%的峰值。
在pMMR/MSS肠癌患者中,研究结果保持一致。
早期肿瘤缩小(ETS)是强有力的动态预后指标
研究进一步分析了治疗早期的疗效反应对后续病程的影响。在治疗4个月后仍未进展的2492例患者中,94%(2331例)拥有可评估的影像数据,其中64%(1475例)实现了ETS(肿瘤缩小≥20%)。
ETS阳性患者的后续PD事件分布更为分散,而ETS阴性患者的PD事件则高度集中在7.3个月左右。风险图显示,在6~14个月的监测期内,ETS阳性患者的PD绝对风险比阴性患者持续降低了5%~7%。
在多变量预测模型中,ETS作为一个动态疗效指标,其强预测能力(HR 0.78,P<0.001)甚至削弱了部分基线预后因素(如肿瘤原发部位)的统计学显著性,凸显了其在动态风险评估中的重要价值。
治疗策略影响早期进展风险
为将这些发现应用于当前临床实践,研究者根据患者接受的治疗、RAS/BRAF分型和肿瘤原发部位进行了分层。
在1058例接受基于抗EGFR方案治疗的RAS/BRAF野生型左半结肠癌患者中,PD风险逐渐增加,在14~16个月时达到22%的风险峰值。在接受5-FU/LV +抗EGFR作为维持治疗方案的患者(n=416例)中,结果一致,风险峰值为22%,但推迟至18个月出现。
451例RAS/BRAF野生型右半结肠癌患者和560例RAS突变型肠癌患者分别接受了三联方案或双药/单药化疗方案联合贝伐珠单抗治疗。三联方案和双药/单药化疗方案的PD风险峰值分别为14个月时27%和16个月时30%。
97例和83例BRAF突变型肠癌患者分别接受了三联方案或双药/单药化疗方案联合贝伐珠单抗治疗。与双药/单药化疗方案相比,三联方案在4~6个月内的PD事件频率更低,6个月时PD风险也更低(12% vs 26%,P=0.04)。
多因素模型精准识别高风险人群
研究构建了一个包含所有基线特征(除MSI/MMR状态外,因其缺失数据量大)的Cox回归模型,以整合多维信息来预测PFS。该模型精准地识别出多个与一线治疗PFS缩短独立相关的基线风险因素:
ECOG PS评分> 0(HR 1.31,P<0.001);原发肿瘤位于右半结肠(HR 1.11,P=0.04);转移器官数量较多(HR 1.14,P<0.001)均与较差的PFS独立相关。
独立的保护性因素(protective factors)包括原发肿瘤切除(HR 0.81,P<0.001)和无BRAF突变(RAS突变 vs BRAF突变 HR 0.79,P=0.005;RAS/BRAF野生型 vs BRAF突变 HR 0.66,P<0.001)。
接受三联方案+贝伐珠单抗治疗的患者也与较低的PD风险独立相关(vs 抗EGFR方案 HR 0.84,P<0.001)。
M.M. Germani, V. Heinemann, D. Rossini, et al. Risk of disease progression in the first-line therapy of metastatic colorectal cancer to guide disease re-assessments - analysis of eleven trials by AIO and GONO. Published online August 19, 2025.
排版编辑:肿瘤资讯-Marie











 苏公网安备32059002004080号
苏公网安备32059002004080号


