在IA期肺腺癌患者中,肺段切除术和楔形切除术的疗效对比确实尚未有定论。目前的研究表明,这两种术式在肿瘤学结果上大致相当,但具体到总生存率等关键指标,还需要更多高质量的临床研究来明确。在临床实践中,医生会综合考虑患者的具体情况,如肿瘤大小、位置、患者肺功能及合并症等因素,来选择最合适的手术方式。对于这两种术式的深入比较和研究,将有助于为临床决策提供更坚实的循证依据,以期为患者带来更好的治疗效果1。
本研究聚焦IA期肺腺癌患者,共纳入6598例患者。依据预定的纳入和排除标准进行筛选,运用倾向评分匹配方法平衡混杂因素,匹配变量涵盖年龄、肿瘤大小及病理分期等,以1:1比例匹配。借助Kaplan-Meier曲线与Log-rank检验评估术后总生存率差异,同时利用Cox比例风险模型计算风险比,旨在精准探究肺段切术与楔形切除术这两种手术方式的生存预后差异。
肺段切术在IA期肺腺癌患者中的生存优势
本研究纳入6598例IA期肺腺癌患者,女性占比66.2%,从不吸烟者比例81.5%。肿瘤大小分布为:47.2%小于1cm,39.7%介于1-2cm,13.1%大于2cm,其中48.0%为贴壁生长主型。淋巴血管侵犯和脏层胸膜侵犯发生率分别为0.8%和8.3%,1.3%患者存在淋巴结转移。
肺段切术组的肿瘤体积平均为1.3±0.8cm,显著大于楔形切除术组的1.1±0.7cm(P<0.001)。此外,肺段切术组的淋巴结转移率高达2%,是楔形切除术组1%的两倍(P<0.001),且肿瘤分化程度较低,高分化肿瘤比例为42.8%,低于楔形切除术组的39.6%(P<0.001)。同时,肺段切术组贴壁生长为主型肿瘤的比例为43.1%,低于楔形切除术组的50.3%(P<0.001)。在手术相关指标中,楔形切除术组检查的淋巴结数量较少,平均为6.3±7.0个,显著少于肺段切术组的12.8±9.2个(P<0.001)。
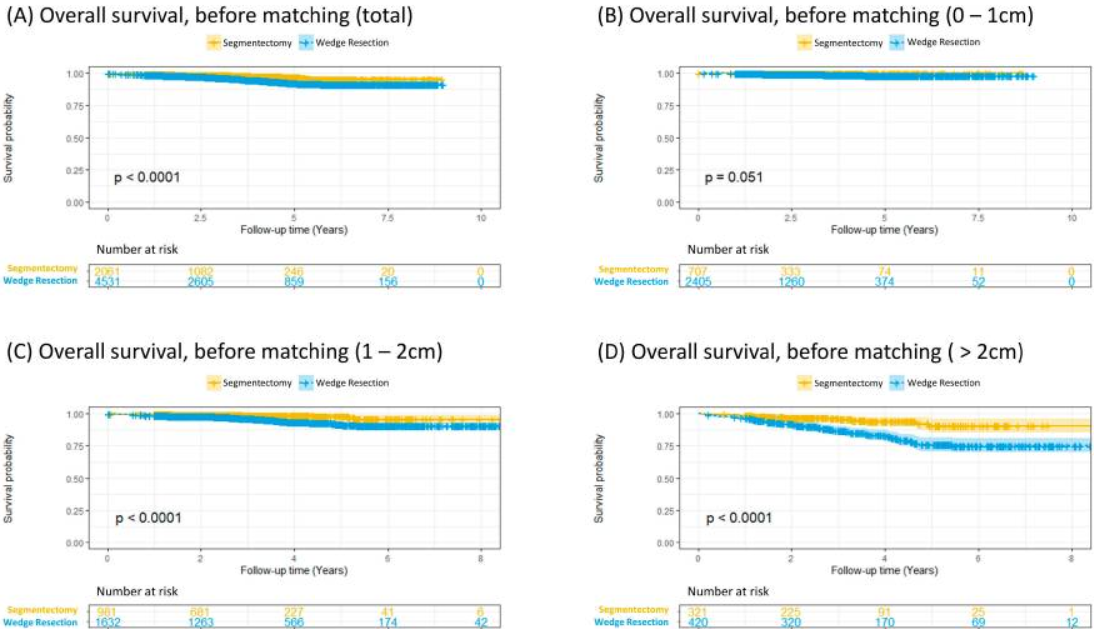
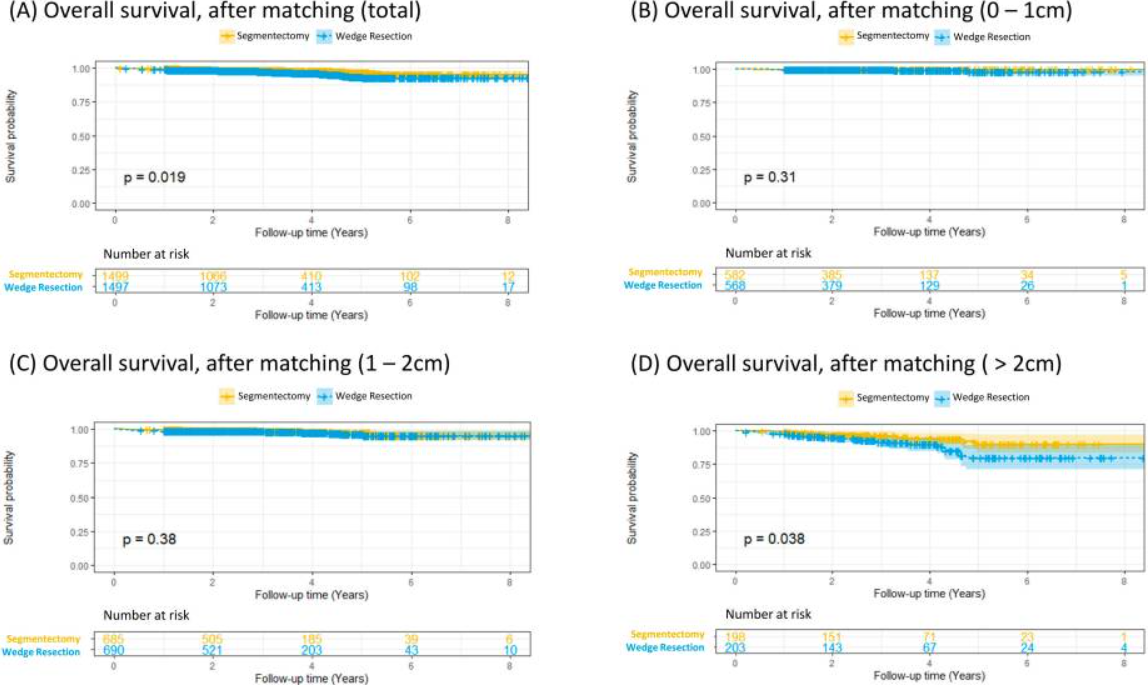
肺段切术组的总生存率显著高于楔形切除术组(P<0.001)。对于肿瘤直径小于1cm的患者,两组生存率相近(P=0.051);而肿瘤直径在1-2cm和大于2cm的患者中,肺段切术组生存优势明显(P<0.001)。倾向评分匹配后,两组基线特征均衡。此时段切术组生存率依然显著优于楔形切除术组(P=0.019)。进一步分析发现,肿瘤直径小于2cm的患者,两种手术方式生存结果无差异;但对于肿瘤直径大于2cm的患者,段切术组生存优势依然显著(P=0.038)。Cox回归分析表明,手术方式、吸烟史、年龄、肿瘤大小、分化程度及病理N2分期均为总生存率的独立影响因素。
肺腺癌亚肺叶切除术的疗效对比与局限性分析
相关研究表明,在IA期肺腺癌中,对于小于1cm的肿瘤,肺段切除术与楔形切除术的疗效相当;而对于1-2cm的肿瘤,肺段切除术的疗效优于楔形切除术2。本研究结果与这些发现高度一致,进一步验证了肺段切除术在特定肿瘤大小中的优越性。最近的随机对照试验表明,对于≤2cm的IA期肺腺癌,亚肺叶切除术(如肺段切除术和楔形切除术)的患者生存率与肺叶切除术相比无显著差异,这为亚肺叶切除术在特定肿瘤大小中的应用提供了有力支持3、4。
然而,两项先前研究指出,解剖切除与更高的长期生存率相关,但并未对肿瘤大小进行分层分析5、6。这一限制可能削弱了结论的普适性,提示在临床实践中需结合具体肿瘤特征进行个体化决策。CALBG 140503试验的再分析显示,楔形切除术与肺段切除术的生存概率相当,但事后分析的统计局限性可能对结果的可靠性产生一定影响7、8。这提示未来研究需进一步完善分析方法,以提高结论的稳健性。尽管上述研究为肺腺癌的手术方法选择提供了重要见解,但其局限性仍不容忽视。例如,研究中缺乏系统的影像学数据、肿瘤深度测量及切除边缘评估,这可能影响研究结论的全面性以及对临床实践的指导意义。
1. Chiang XH, Wei CF, Lin CC, et al. Segmentectomy Versus Wedge Resection for Stage IA Lung Adenocarcinoma-A Population-Based Study. Cancers (Basel). 2025 Mar 10;17(6):936.
2. Cao J, Yuan P, Wang Y, et al. Survival Rates After Lobectomy, Segmentectomy, and Wedge Resection for Non-Small Cell Lung Cancer. Ann Thorac Surg. 2018 May;105(5):1483-1491.
3. Saji H, Okada M, Tsuboi M, et al. Segmentectomy versus lobectomy in small-sized peripheral non-small-cell lung cancer (JCOG0802/WJOG4607L): a multicentre, open-label, phase 3, randomised, controlled, non-inferiority trial. Lancet. 2022 Apr 23;399(10335):1607-1617.
4. Altorki N, Wang X, Kozono D, et al. Lobar or Sublobar Resection for Peripheral Stage IA Non-Small-Cell Lung Cancer. N Engl J Med. 2023 Feb 9;388(6):489-498.
5. Akamine T, Yotsukura M, Yoshida Y, et al. Feasibility and effectiveness of segmentectomy versus wedge resection for clinical stage I non-small-cell lung cancer. Eur J Cardiothorac Surg. 2023 Mar 1;63(3):ezad018.
6. Thomas PA, Seguin-Givelet A, Pages PB, et al. Real-world outcomes of lobectomy, segmentectomy and wedge resection for the treatment of stage c-IA lung carcinoma. Eur J Cardiothorac Surg. 2024 Jul 1;66(1):ezae251.
7. Altorki N, Wang X, Damman B, et al. Lobectomy, segmentectomy, or wedge resection for peripheral clinical T1aN0 non-small cell lung cancer: A post hoc analysis of CALGB 140503 (Alliance). J Thorac Cardiovasc Surg. 2024 Jan;167(1):338-347.e1. doi: 10.1016/j.jtcvs.2023.07.008. Epub 2023 Jul 18. Erratum in: J Thorac Cardiovasc Surg. 2025 Apr;169(4):1181.
8. Karch A, Krumkamp R, Kreuels B. Randomized, placebo-controlled trial or post hoc subgroup analysis: the importance of standardized and comprehensive reporting. J Infect Dis. 2014 Jul 1;210(1):158-9.
排版编辑:肿瘤资讯-Bear











 苏公网安备32059002004080号
苏公网安备32059002004080号


