结直肠癌(Colorectal cancer, CRC)是最常见的消化道恶性肿瘤之一。近年来,随着精准治疗理念的深入以及抗HER2药物的迭代,HER2阳性结直肠癌的诊断和治疗逐步引起关注。泽尼达妥单抗作为我国首个获批上市的抗HER2双表位抗体,在晚期HER2阳性结直肠癌的治疗中亦颇具前景。我们总结了国内外指南推荐的结直肠癌HER2检测标准、抗HER2治疗种类及泽尼达妥单抗用于HER2阳性结直肠癌的相关临床研究,以期为广大临床医生提供治疗选择参考。
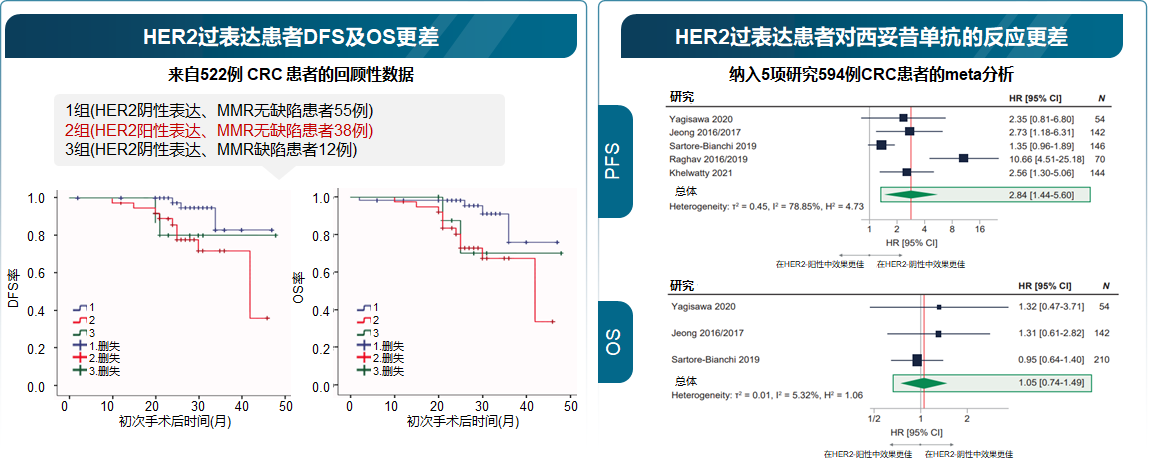
研究显示,HER2在约3-5%的结直肠癌病例中扩增和/或过表达。HER2阳性患者通常表现出更高的肿瘤侵袭性和更差的预后:HER2的过表达与肿瘤的深度浸润、淋巴结转移及远处转移等临床特征相关。此外,HER2阳性结直肠癌患者在接受标准化疗(如 FOLFOX方案)时通常反应较差,并显示出对抗EGFR疗法的耐药性[1,2]。
HER2阳性结直肠癌的检测标准
2025.V4版NCCN 结肠癌指南、2025 V2 NCCN 直肠癌指南推荐:对于疑似或已证实转移的CRC患者检测HER2,检测的方法有免疫组织化学法(immunohistochemistry,IHC)、荧光原位杂交(fluorescence in-situ hybridisation ,FISH)和二代基因测序(next-generation sequencing,NGS);HER2阳性定义为50%以上肿瘤细胞呈现IHC 3+(细胞膜的基底和侧边或整个细胞膜呈强阳性着色);IHC评分为2+的患者应通过FISH检测进一步明确HER2状态,HER2基因扩增的阳性定义为大于50%的肿瘤细胞HER2/CEP17比值≥2.0;NGS显示的HER2扩增也代表阳性。
上述采用IHC法和FISH法判断HER2阳性的标准来源于HERACLES研究,此研究也是CRC抗HER2治疗领域最成功的研究之一。该研究对于HER2阳性定义的标准被称为HERACLES标准[3,4]。这个标准相对于胃癌[5]、乳腺癌[6]的HER2阳性标准更严格(胃癌指南对于HER2阳性的定义为>10%的肿瘤细胞呈现IHC 3+或IHC 2+且FISH阳性)。
2025版《CSCO结直肠癌诊疗指南》对于HER2检测的方法及HER2阳性的定义并没有明确推荐,且指出目前CRC HER2阳性的判断标准仅来自临床研究,尚未建立经过权威机构认证的伴随诊断的判读标准。
在我国临床实践中,各地区各医院的检测平台和判读标准也存在较大差异,无法完全统一。临床研究采用的判读标准也不尽相同,很多经典研究如DESTINY-CRC02[7]、DESTINYPanTumor02[8]、MOUNTAINEER[9]、MOUNTAINEER-03[10]研究依然采用胃癌HER2阳性判读标准,即>10%细胞呈现IHC 3+即可;HERACLES、HERACLES-B[11]研究中引用更严格的HERACLES标准;这些研究通常设有中心实验室。在更多研究如MyPathway研究中,阳性的判读并非来源于中心实验室,而是来源于当地医院病理科的判读结果。但不论采用何种标准,IHC 3+患者的客观缓解率(ORR)和中位无进展生存期(PFS)均高于IHC 2+患者。
HER2阳性结直肠癌的治疗
指南推荐
2025 V4版NCCN结肠癌指南推荐二线或以后、RAS/BRAF野生型的患者接受抗HER2治疗(IIA级推荐);推荐的方案为:曲妥珠单抗+帕妥珠单抗/拉帕替尼/图卡替尼(用于既往没有接受过抗HER2治疗的患者);推荐德曲妥珠单抗仅用于IHC 3+患者,并指出:德曲妥珠单抗在HER2经治患者中显示出初步疗效信号;不能用于由于肺毒性导致肺部问题的患者,且DESTINY-CRC01研究中报道3.5% 治疗相关死亡。2025版《CSCO结直肠癌诊疗指南》推荐已接受过奥沙利铂和伊利替康治疗的三线RAS/BRAF野生型晚期CRC患者使用抗HER2治疗(III级推荐);由于中国缺少临床研究数据,故无抗HER2的标准治疗推荐;借鉴NCCN指南推荐曲妥珠单抗+帕妥珠单抗或曲妥珠单抗+拉帕替尼;鼓励参加ADC药物相关研究。
对于一线治疗的患者,虽然缺乏数据,但2025 新版NCCN指南推荐不适合高强度治疗的HER2扩增且RAS/BRAF野生型晚期CRC患者一线治疗中仅使用抗HER2治疗,从而避免高强度化疗。这表明CRC的抗HER2治疗正在前移。目前已有III期临床研究正在探索抗HER2治疗用于CRC一线治疗的疗效。

曲妥珠单抗联合TKI类药物
HERACLES研究[4]是2012年开展的一项II期研究,是最早证实HER2阳性CRC后线患者可从抗HER2治疗中获益的研究。入组HER2阳性且KRAS外显子2野生型的晚期CRC患者。治疗方案为曲妥珠单抗联合拉帕替尼。研究共筛查914例KRAS野生型晚期CRC患者,48例(5%)HER2阳性。27例符合入组条件;中位既往治疗线数为5,3+患者占74%。中位随访时间为 94 周(范围: 51~127周),27 例患者中有 8 例(30%)获得客观缓解, 8例PR的患者中有7例为HER-2 IHC 3+;中位PFS为21周,HER2拷贝数更高的患者接受抗HER2治疗后的生存更好。
MOUNTAINEER研究[9]探索曲妥珠单抗+图卡替尼治疗HER2阳性晚期后线CRC,2021年中期数据中可评估的23例患者,ORR为52.2%,中位PFS为8.1个月,中位总生存期(OS)为18.7个月。但此研究并未纳入HER2经治的患者,且图卡替尼在中国尚不可及。
还有数项研究探索曲妥珠单抗联合吡咯替尼用于肠癌后线治疗的疗效,但均为单中心小样本研究,数据差异较大:ORR 33%~57%,中位PFS 4.3-8.6个月[12-14]。
妥妥组合
MyPathway[15]是一项ⅡA期篮子试验。该研究的其中一个臂分析了HER2扩增的转移性(mCRC)患者接受曲妥珠单抗联合帕妥珠单抗治疗的疗效。共纳入57例mCRC后线治疗的患者,中位治疗线数4 (IQR 2~5),43例(75%)患者为RAS野生型;总体ORR为32%,中位PFS为2.9个月,中位OS为11.5个月;RAS野生型患者ORR 40%,中位PFS 5.3个月,中位OS 14个月;13例KRAS突变的患者,仅1例对治疗有效,而43例KRAS野生型的患者,有17例治疗有效(ORR为40%)。该研究也是CRC抗HER2治疗最早和最经典的研究之一,确立了妥妥组合的地位。
其他研究如TRIUMPH[16]、TAPUR[17]、DRUP[18]、S1613[19]等研究均证实了妥妥组合的疗效,ORR在30%~40%,中位PFS约4~5个月。
ADC类药物
德曲妥珠单抗被批准用于治疗HER2阳性乳腺癌和胃癌。其用于CRC的DESTINY-CRC01[20]、DESTINY-CRC02研究[7]亦显示出较高的ORR和中位PFS,但同时治疗相关不良事件(AE)发生率不容忽视。DESTINY-CRC01[20]是一项II期、开放标签的多中心研究,入组标准为在≥2个既往治疗方案后进展的HER2阳性、RAS野生型晚期CRC患者。每3周在3个队列中给予德曲妥珠单抗6.4 mg/kg(A:HER2 IHC 3+或IHC 2+/ISH+,n=53;B:IHC2+/ISH-,n=15;C:IHC1+,n=158)。结果显示入组患者中位治疗线数4(范围:2~11);A队列HER2经治比例30.2%,B/C队列为0%;A/B/C队列ORR分别为45.3%、0%、0%;中位PFS分别为6.9个月、2.1个月和1.4个月;中位OS分别为15.5个月、7.3个月和7.7个月。HER2 IHC 3+或IHC 2+/ISH+队列的患者获益明显更好。所有患者≥3级治疗期间不良事件(TEAE)发生率65.1%;严重不良事件(SAE)发生率40%;10.5%(9/86)的患者发生死亡。发生率>20%的AE主要包括恶心、呕吐、腹泻等消化道AE;贫血、血小板计数降低、中性粒细胞计数降低等血液毒性和乏力;间质性肺病或肺炎的整体发生率为9.3%(8/86),其中3例患者死亡。
为降低毒性,DESTINY-CRC02研究[7]比较了两种剂量(5.4 mg/kg vs 6.4 mg/kg、每 3 周一次)的德曲妥珠单抗单药治疗在既往多线治疗失败的 HER2 阳性( HER2 IHC 3+或IHC 2+/ISH+ )mCRC患者中的疗效与安全性。共入组 122 例患者(Ⅰ期 1∶1 随机 5.4 mg/kg 组 40 例、6.4 mg/kg 组 40 例;Ⅱ期追加 5.4 mg/kg 组 42 例)。高、低剂量组3+患者占比分别为:64(78%) 和34(85%)例,既往治疗线数分别为3和4;RAS野生型占比为83%和85%。5.4 mg/kg合并队列(低剂量队列,n=82)ORR为37.8%; 6.4 mg/kg 组(高剂量队列 n=40)ORR为27.5%;中位PFS:分别为5.8个月和5.5个月。低剂量和高剂量和≥3级治疗相关不良事件(TRAE)分别为41%和48%;肺炎发生率分别为5%和10%。该研究显示低剂量组的疗效与高剂量组相当,AE发生率有所降低,但仍需关注安全性问题。
泽尼达妥单抗用于晚期结直肠癌的研究进展
泽尼达妥单抗是全新的双特异性抗体,其两个“手臂”(Fab和scFv段)分别结合来自两个不同HER2受体的ECD2(帕妥珠单抗结合域)和ECD4(曲妥珠单抗结合域),通过独特的双侧反式结合形成HER2受体“帽子”结构,诱导强力内吞和独有CDC效应,发挥强效抗HER2作用(详细机制点击查看)。泽尼达妥单抗已在中国获批HER2高表达的胆道肿瘤后线治疗适应症。
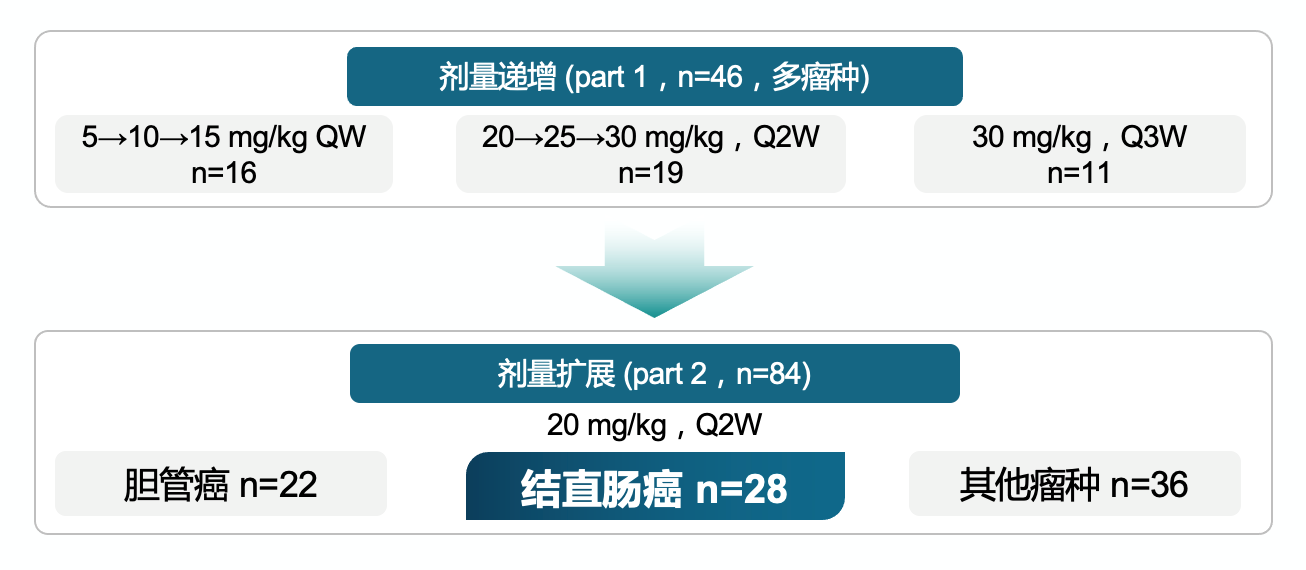
一项I期研究[21]的PART 2 CRC队列入组28例标准治疗失败、HER2阳性晚期CRC患者。所有患者接受泽尼达妥单抗单药20 mg/kg Q2W治疗。
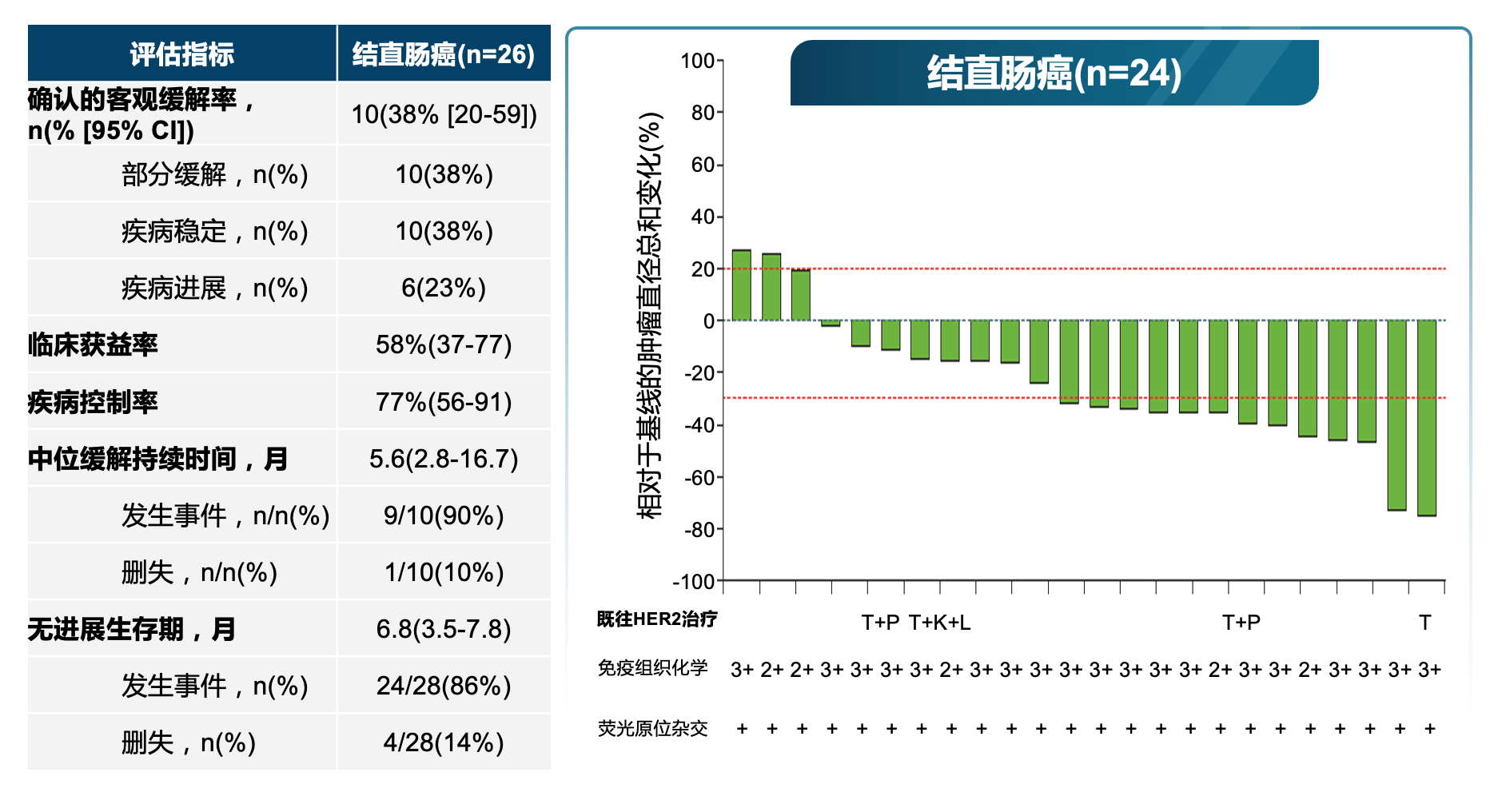
研究结果显示,患者均经历多线治疗,平均治疗线数3.5线(IQR 2~5.5);25%的患者既往接受过抗HER2治疗,包括曲妥珠单抗、帕妥珠单抗、拉帕替尼、德曲妥珠单抗、恩美曲妥珠单抗;IHC 3+占71%,IHC 2+占29%。ORR 38%,疾病控制率(DCR)77%,中位缓解持续时间(DOR)5.6个月,中位PFS 6.8个月。
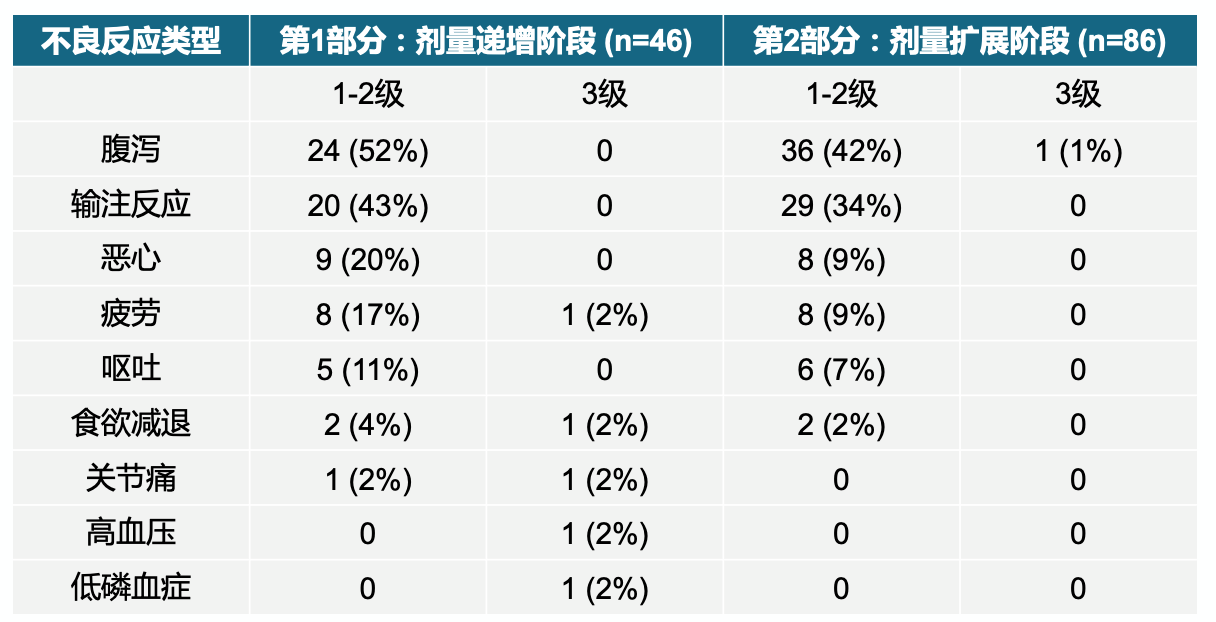
最常见AE为腹泻和输液反应。腹泻在PART 1/2的发生率分别为52%和42%,在PART 2的3个队列的发生率相似。除外1例膀胱癌患者,其余均为1~2级。输液反应在PART 1/2的发生率分别为43%和32%,均为1/2级,且PART 2阶段患者接受了预处理,输液反应发生率遂下降; PRAT 2中84例患者仅出现1例3级TRAE(腹泻),无其他3级TRAE发生;4例患者因2级腹泻、输液反应或左心室射血分数下降暂停或永久停药;未观察到肺部毒性。整个研究中未发生治疗相关死亡。
从疗效数值看,泽尼达妥单药治疗的ORR和PFS已高于妥妥组合,与德曲妥珠单抗相当,但安全性明显优于德曲妥珠单抗单药治疗。因此,泽尼达妥单抗便于广泛联合化疗、免疫治疗、TKI等药物,进一步提升抗HER2疗效。更多临床研究正在开展中。

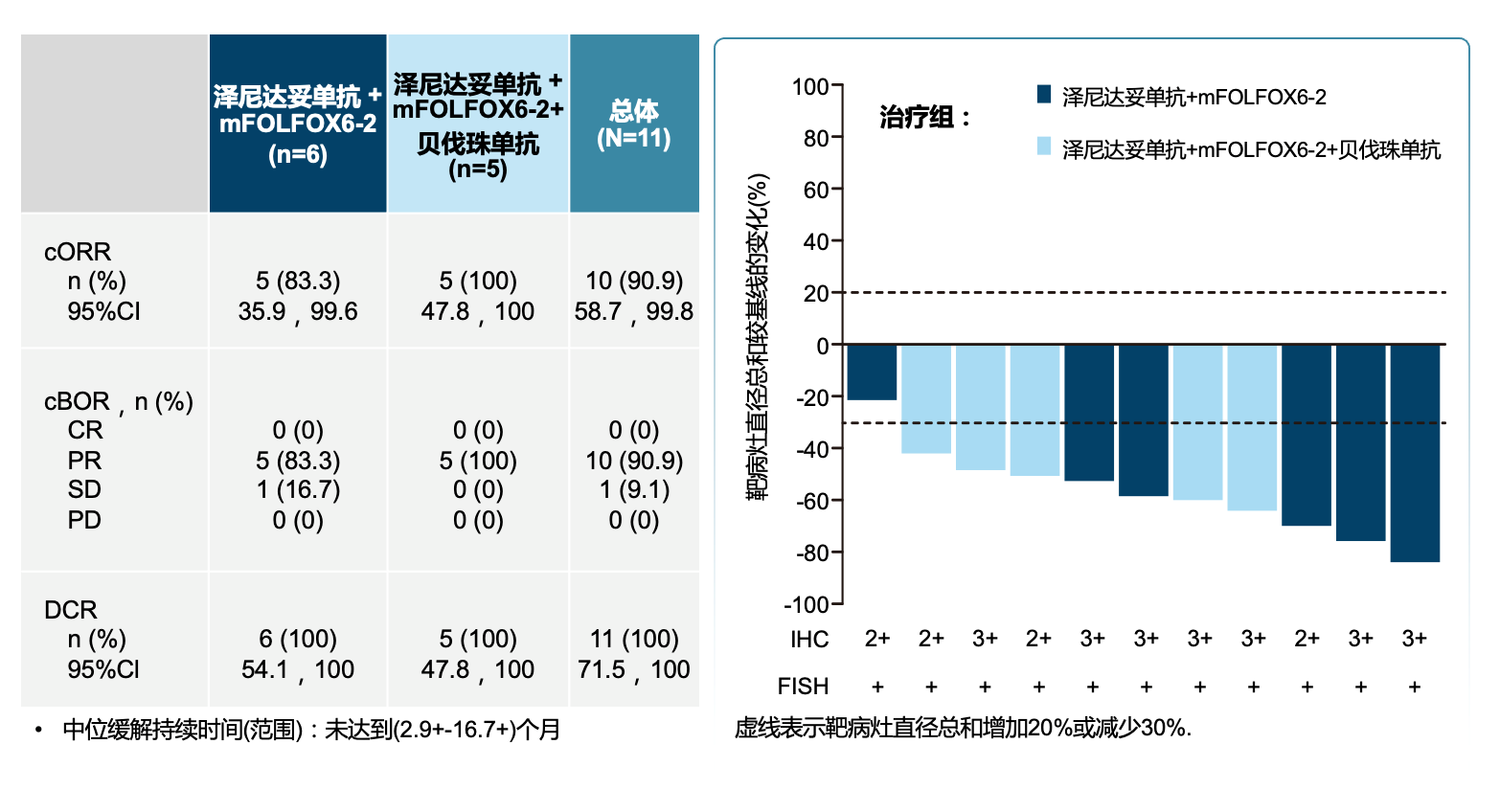
另一项II期研究[22]探索泽尼达妥单抗+化疗±贝伐珠单抗一线治疗HER2阳性(IHC 3+ 或 IHC 2+ 且 FISH+)mCRC的初步疗效。6例患者接受泽尼达妥单抗+FOLFOX6-2治疗,7例接受泽尼达妥单抗+FOLFOX6-2+贝伐珠单抗治疗。泽尼达妥单抗按体重给药(≥70kg:1600 mg,Q2W,<70kg:1200 mg,Q2W)。IHC 3+患者比例为61%。11例疗效可评估患者中,10例患者达到PR,ORR 91%,DCR率100%;中位随访15.4个月,中位PFS和中位OS均未达到。3级及以上TRAE发生率38.5%,没有患者因TRAE而停药,也没有出现与治疗相关的死亡。
展望
不同于乳腺癌和胃癌,CRC的HER2阳性率较低,治疗选择有限,长久以来未获关注。CRC领域抗HER2治疗仍缺乏大型Ⅲ期研究数据,在国内未获批适应症。近年来,随着精准治疗理念逐步深入和更多研究数据读出,CRC领域抗HER2治疗正逐步走向规范化和多元化,治疗观念也从后线治疗逐步移至前线。泽尼达妥单抗等新型抗HER2治疗药物陆续上市,不断刷新有效率和生存数据,为HER2阳性CRC患者带来更多种治疗选择。相信未来几年,HER2作为经典靶点将在CRC的治疗中焕发生机。
1. Luo H, Cui L, Shen K, Li R, Wang Z, Xie Z. HER2 Overexpression and Mismatch Repair Deficiency are Correlated with Malignancy in Colorectal Cancer. Cancer Manag Res. 2021;13:3443-3454.
2. Bekaii-Saab TS, Lach K, Hsu LI, et al. Impact of Anti-EGFR Therapies on HER2-Positive Metastatic Colorectal Cancer: A Systematic Literature Review and Meta-Analysis of Clinical Outcomes. Oncologist. 2023;28(10):885-893.
3. Valtorta E, Martino C, Sartore-Bianchi A, et al. Assessment of a HER2 scoring system for colorectal cancer: results from a validation study. Mod Pathol. 2015;28(11):1481-1491.
4. Hofmann M, Stoss O, Shi D, et al. Assessment of a HER2 scoring system for gastric cancer: results from a validation study. Histopathology. 2008;52(7):797-805.
5. Bartley AN, Washington MK, Colasacco C, et al. HER2 Testing and Clinical Decision Making in Gastroesophageal Adenocarcinoma: Guideline From the College of American Pathologists, American Society for Clinical Pathology, and the American Society of Clinical Oncology. J Clin Oncol. 2017;35(4):446-464.
6. Wolff AC, Hammond MEH, Allison KH, et al. Human Epidermal Growth Factor Receptor 2 Testing in Breast Cancer: American Society of Clinical Oncology/College of American Pathologists Clinical Practice Guideline Focused Update. J Clin Oncol. 2018;36(20):2105-2122.
7. Raghav K, Siena S, Takashima A, et al. Trastuzumab deruxtecan in patients with HER2-positive advanced colorectal cancer (DESTINY-CRC02): primary results from a multicentre, randomised, phase 2 trial. Lancet Oncol. 2024;25(9):1147-1162.
8. Meric-Bernstam F, Makker V, Oaknin A, et al. Efficacy and Safety of Trastuzumab Deruxtecan in Patients With HER2-Expressing Solid Tumors: Primary Results From the DESTINY-PanTumor02 Phase II Trial. J Clin Oncol. 2024;42(1):47-58..
9. Strickler JH, Cercek A, Siena S, et al. Tucatinib plus trastuzumab for chemotherapy-refractory, HER2-positive, RAS wild-type unresectable or metastatic colorectal cancer (MOUNTAINEER): a multicentre, open-label, phase 2 study. Lancet Oncol. 2023;24(5):496-508.
10. Strickler JH, Bekaii-Saab T, Cercek A, et al. MOUNTAINEER-03 phase III study design: first-line mFOLFOX6 + tucatinib + trastuzumab for HER2+ metastatic colorectal cancer. Future Oncol. 2025;21(3):303-311.
11. Sartore-Bianchi A, Lonardi S, Martino C, et al. Pertuzumab and trastuzumab emtansine in patients with HER2-amplified metastatic colorectal cancer: the phase II HERACLES-B trial. ESMO Open. 2020;5(5):e000911.
12. Zhou H, Lv M, Li W, et al. Efficacy of Pyrotinib With/Without Trastuzumab in Treatment-Refractory, HER2-Positive Metastatic Colorectal Cancer: Result From a Prospective Observational Study. Clin Colorectal Cancer. 2024;23(1):58-66.
13. Chang J, Xu M, Wang C, et al. Dual HER2 Targeted Therapy With Pyrotinib and Trastuzumab in Refractory HER2 Positive Metastatic Colorectal Cancer: A Result From HER2-FUSCC-G Study. Clin Colorectal Cancer. 2022;21(4):347-353.
14. Chang J, Xu M, Wang C, et al. Dual HER2 Targeted Therapy With Pyrotinib and Trastuzumab in Refractory HER2 Positive Metastatic Colorectal Cancer: A Result From HER2-FUSCC-G Study. Clin Colorectal Cancer. 2022;21(4):347-353.
15. Meric-Bernstam F, Hurwitz H, Raghav KPS, et al. Pertuzumab plus trastuzumab for HER2-amplified metastatic colorectal cancer (MyPathway): an updated report from a multicentre, open-label, phase 2a, multiple basket study. Lancet Oncol. 2019;20(4):518-530.
16. Nakamura Y, Okamoto W, Kato T, et al. Circulating tumor DNA-guided treatment with pertuzumab plus trastuzumab for HER2-amplified metastatic colorectal cancer: a phase 2 trial. Nat Med. 2021;27(11):1899-1903.
17. Gupta R, Meric-Bernstam F, Rothe M, et al. Pertuzumab Plus Trastuzumab in Patients With Colorectal Cancer With ERBB2 Amplification or ERBB2/3 Mutations: Results From the TAPUR Study. JCO Precis Oncol. 2022;6:e2200306.
18. Spiekman IAC, Zeverijn LJ, Geurts BS, et al. Trastuzumab plus pertuzumab for HER2-amplified advanced colorectal cancer: Results from the drug rediscovery protocol (DRUP). Eur J Cancer. 2024;202:113988.
19. Raghav KPS, Guthrie KA, Tan B Jr, et al. Trastuzumab Plus Pertuzumab Versus Cetuximab Plus Irinotecan in Patients With RAS/BRAF Wild-Type, HER2-Positive, Metastatic Colorectal Cancer (S1613): A Randomized Phase II Trial. J Clin Oncol. 2025;43(11):1348-1357.
20. Yoshino T, Di Bartolomeo M, Raghav K, et al. Final results of DESTINY-CRC01 investigating trastuzumab deruxtecan in patients with HER2-expressing metastatic colorectal cancer. Nat Commun. 2023;14(1):3332.
21. Weisser NE, Sanches M, Escobar-Cabrera E, et al. An anti-HER2 biparatopic antibody that induces unique HER2 clustering and complement-dependent cytotoxicity. Nat Commun. 2023;14(1):1394.
22. Rha SY, Lee KW, Kang YK, et al. Zanidatamab (Zani) + chemotherapy (CT) in first-line (1L) human epidermal growth factor receptor 2-positive (HER2+) advanced/metastatic colorectal cancer (mCRC) . 2024 ESMO, 516MO.
排版编辑:肿瘤资讯-zly












 苏公网安备32059002004080号
苏公网安备32059002004080号


