多发性骨髓瘤(MM)是全球第二常见的血液系统恶性肿瘤,其中髓外病变(EMD)因其侵袭性强、预后差一直是临床诊疗的难点。近日,发表于Hematological Oncology杂志的一项中国多中心研究,首次针对新药时代髓外多发性骨髓瘤的临床特征与治疗结局展开深入分析。该研究纳入1059例患者,通过比较非髓外病变(non-EMD)、骨相关髓外病变(EMB)和新发髓外骨外病变(de novo EME)三组的生存数据,揭示了不同亚型的预后差异及优化治疗策略,为精准诊疗提供了关键依据。【肿瘤资讯】现将该研究主要内容整理如下,以飨读者。

研究背景:EMD的分类困境与治疗挑战
MM患者中约13%会出现EMD,传统上分为骨相关(EMB)和骨外(EME)两类,但两者的临床意义和治疗策略一直存在争议。EMB指紧邻骨骼的软组织浆细胞瘤,而EME则涉及肺、肝等内脏或淋巴结、皮肤等非骨相关部位。既往研究表明,EME预后显著差于EMB,但新型药物(如CD38单抗、BCMA靶向药)能否改善这一局面尚未明确。
此外,高风险细胞遗传学异常(HRA)对髓外病变的影响也亟待厘清。HRA包括1q21扩增、17p-、t (4;14) 和t (14;16)等,携带≥2种HRA的患者被归为超高危,但这类异常在EMB和EME中的分布及预后价值尚不明确。同时,自体造血干细胞移植(ASCT)和新型联合方案在髓外病变中的疗效数据也较为匮乏。
研究方法:多中心大数据解析EMD亚型
该研究回顾性分析了2016年1月至2023年10月来自中山大学肿瘤防治中心和吉林大学第一医院的1059例初治MM患者,其中597例为non-EMD,324例为EMB,138例为 de novo EME。所有患者均经PET/CT或MRI确诊,且排除原发性浆细胞白血病和孤立性浆细胞瘤。
关键定义与评估指标
分组标准:de novo EME指初诊时即存在与骨骼无关的内脏或软组织浆细胞瘤;EMB为骨旁浆细胞瘤;同时存在两者则归为de novo EME。
细胞遗传学检测:通过FISH检测HRA,包括1q21+、17p-、t(4;14)和t(14;16),并根据携带数量分为0、1、≥2种HRA亚组。
治疗方案:包括免疫调节剂(IMiDs)联合蛋白酶体抑制剂(PI,如VRD方案)、CD38单抗为基础的方案(如DVRD)、单药IMiDs或PI,以及移植治疗(ASCT)。
结局指标:主要终点为总生存期(OS)和无进展生存期(PFS),采用Kaplan-Meier法和Cox回归模型分析预后因素。
研究结果:不同EMD亚型的预后差异与治疗突破
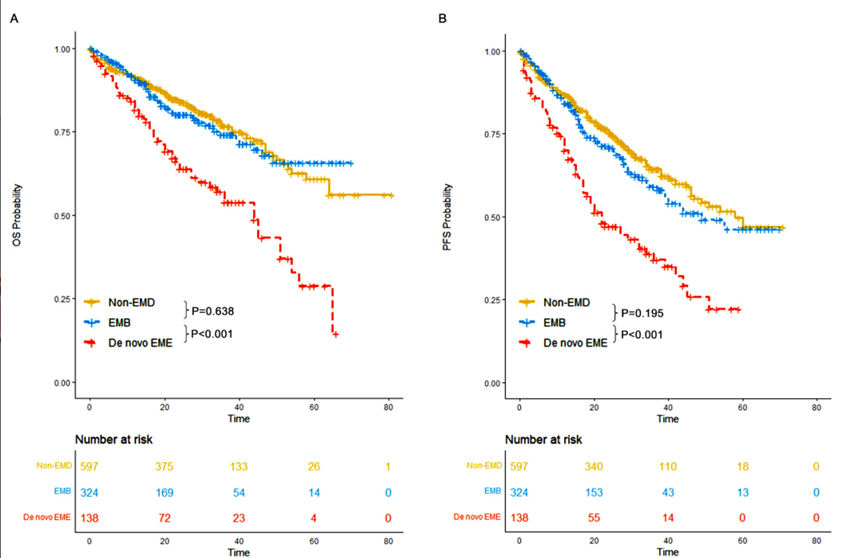
1. de novo EME预后显著最差,EMB与non-EMD无统计学差异
中位随访27个月结果显示:
OS对比:non-EMD组的中位OS未达到,5年OS率为60.8%;EMB组的中位OS也未达到,5年OS率为65.7%,而de novo EME组的中位OS为44个月,5年OS率仅28.8%,显著低于前两组(P<0.01)。
PFS对比:non-EMD组的中位PFS为58个月,4年PFS率为55.4%;EMB组的中位PFS为49个月,4年PFS率为51.1%;de novo EME组的中位PFS为22个月,4年PFS率仅25.9%,差异具有统计学意义(P<0.01)。
亚组分析显示,de novo EME患者的乳酸脱氢酶(LDH)水平更高、血红蛋白更低,提示肿瘤负荷更大,这可能是其预后差的重要原因。
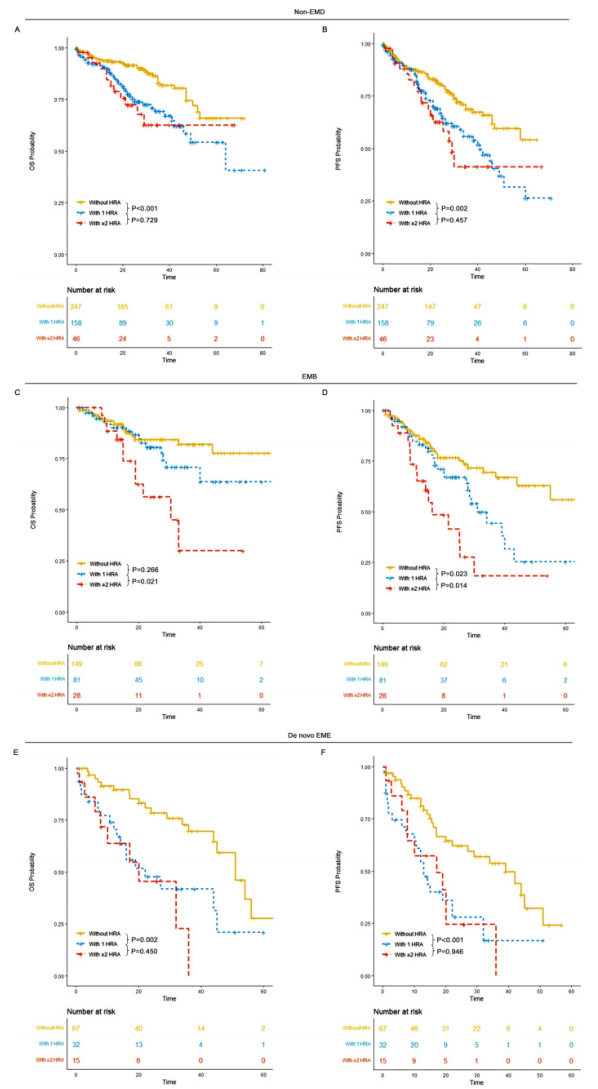
2. HRA加剧预后恶化
non-EMD与EMB组:携带≥2种HRA的患者预后极差,non-EMD组中≥2种HRA者中位PFS仅29个月,EMB组≥2种HRA者中位OS仅30个月,均显著低于无HRA者(P<0.05)。
de novo EME组:即使携带1种 HRA,中位OS也仅22个月,与≥2种HRA者(20个月)无显著差异,提示此类患者只要存在HRA即属超高危。
研究首次提出,de novo EME合并任何HRA均应归类为超高危,需强化治疗。
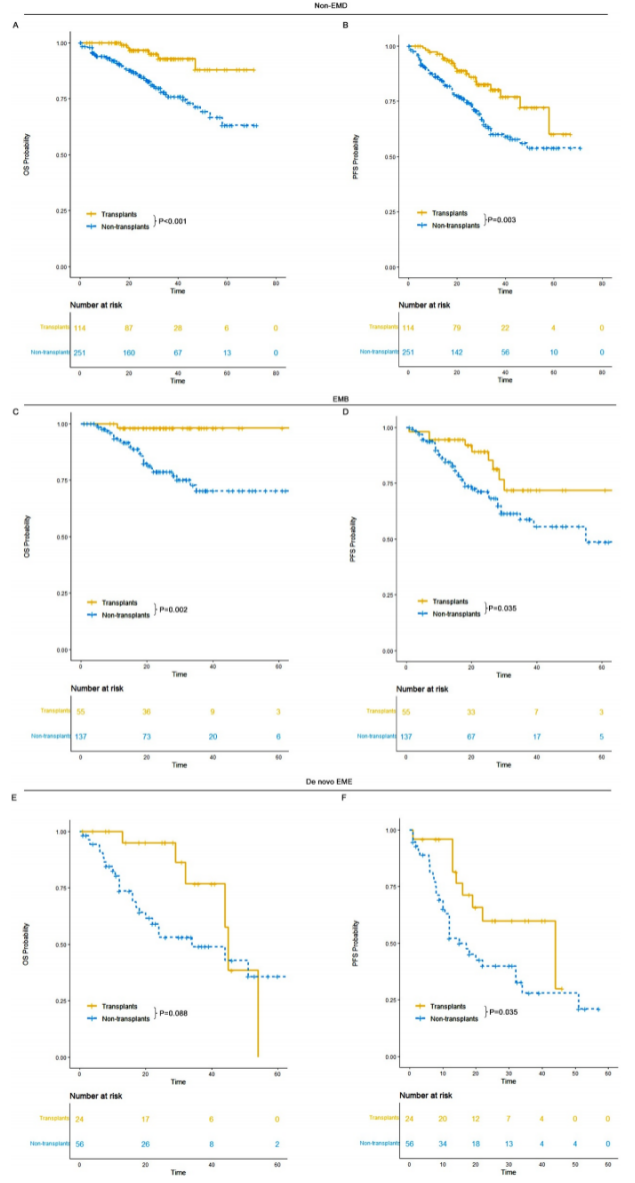
3. 移植可改善de novo EME预后,DVRD方案一线治疗展现潜力
移植疗效:在符合移植条件的患者中,接受ASCT的de novo EME患者中位OS达45个月,显著优于未移植者(34个月,P=0.035);non-EMD和EMB组移植后中位OS均未达到,移植获益更显著。
一线治疗方案:
non-EMD和EMB组中,CD38单抗为基础的联合治疗方案(如DVRD)疗效优于IMiDs+PI,中位OS和PFS均未达到。
de novo EME组中,DVRD四联方案表现最佳,中位OS和PFS均未达到,显著优于VRD(中位OS 51个月)和单药方案(中位OS 24个月)。
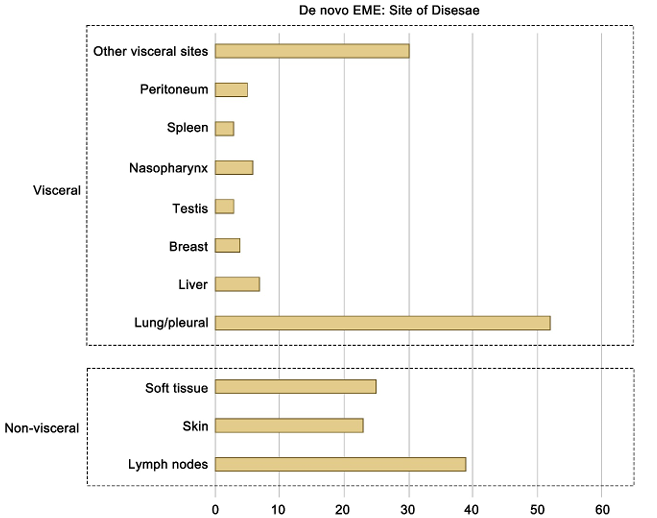
这4. 髓外病变部位与数量不影响预后
de novo EME患者中,单部位与多部位受累、内脏与非内脏受累的OS和PFS均无显著差异(P>0.05)。最常见受累部位为肺/胸膜(52例)、淋巴结(39例)和皮肤(23例),睾丸受累者预后极差,3例患者中位生存期仅13个月。
5. 新型药物与免疫治疗的探索
塞利尼索方案:5 例接受塞利尼索为基础方案的de novo EME患者中,3例达完全缓解(CR),1例达非常好的部分缓解(VGPR),中位随访15个月无进展。
CAR-T与双特异性抗体:2例接受BCMA CAR-T治疗的患者中位PFS为4个月,3例BCMA×CD3双抗治疗者中位PFS为7个月,提示免疫治疗在复发患者中疗效有限,需探索更早应用时机。
结论
本研究揭示了新药时代髓外多发性骨髓瘤的亚型差异:de novo EME预后极差,需作为独立肿瘤亚型进行管理;EMB预后与non-EMD相当,无需过度干预。基于研究结果,临床应根据亚型和HRA状态分层治疗,优先采用DVRD方案联合移植,并探索新型药物与免疫治疗的联合策略,以改善超高危患者的生存结局。
重新定义髓外病变分类,优化治疗策略
该研究通过大样本数据首次证实,EMB与non-EMD预后相似,建议将EMB从传统EMD定义中剔除,仅保留EME作为真正的髓外病变,以避免过度治疗。这一分类调整有助于更精准地评估预后和制定方案。
对于de novoEME 这一超高危亚型,研究提出三项关键措施:
优先选择DVRD四联方案:含CD38单抗的联合方案可最大限度提升缓解深度;
尽早移植:ASCT能显著延长生存期,建议符合条件者均接受移植;
警惕HRA:即使1种异常也需强化治疗,可考虑加入塞利尼索等新型药物。
研究局限性包括回顾性设计和移植率较低(仅20%~22%),未来需前瞻性验证DVRD联合移植的疗效,并探索CAR-T等免疫治疗的最佳应用时机。
Liang D, Yan Y, Wang Q, et al. Clinical Outcome of Extramedullary Multiple Myeloma in the Era of Novel Agents: Insights From a Multicenter Study[J]. Hematological Oncology, 2025, 43(4): e70112.
排版编辑:mathilda











 苏公网安备32059002004080号
苏公网安备32059002004080号


