乳腺癌作为全球女性发病率最高的恶性肿瘤,其诊疗进展始终是学界关注的焦点。在激素受体(HR)阳性乳腺癌的治疗格局中,内分泌治疗占据核心地位,而卵巢功能抑制(OFS)联合内分泌治疗更是绝经前患者的关键策略。
在此,【肿瘤资讯】学术平台特别邀请西安高新医院杜建飞教授,以早期乳腺癌的辅助治疗作为切入点,解析OFS在HR+乳腺癌辅助治疗中的重要地位,并基于OFS药物的更迭,展望创新技术戈舍瑞林微球为HR+乳腺癌引领的内分泌诊疗升级新篇章。
本期特邀专家——杜建飞 教授
肿瘤一病区主任
主任医师
陕西省抗癌协会热疗专业委员会常委
陕西省抗癌协会肿瘤个体化治疗专业委员会常委
陕西省保健协会放射治疗专业委员会常委
陕西省抗癌协会癌痛专业委员会委员
陕西省抗癌协会抗癌药物专业委员会委员
陕西省抗癌协会化疗药物专业委员会委员
参编著作1部,核心期刊发表论文20篇,SCI论文4篇
早期乳腺癌的治疗目标是“治愈”,而辅助治疗是实现这一目标的重要组成部分
乳腺癌是全球女性发病率最高的恶性肿瘤。根据2024年全球癌症统计报告(GLOBOCAN),2022年乳腺癌在全球女性恶性肿瘤中发病率居首位[1]。在中国,乳腺癌的发病率位居女性恶性肿瘤的第2位,2022年新发病例数达到35.7万[2]。HR+/HER2-亚型是最常见的乳腺癌亚型,占所有乳腺癌的70%[3],其中初诊为早期乳腺癌的患者占比高达95.2%,复发转移是其主要致死原因[4]。
早期乳腺癌的治疗目标在于治愈。外科手术作为局部治疗的核心手段,是实现治愈的基石。然而,手术本身难以完全检测或根除那些在术前或术中已从原发肿瘤病灶播散至区域淋巴结或远处的微小转移灶。这正是许多早期乳腺癌患者即便接受了根治性手术切除原发肿瘤,仍面临显著复发风险的根本原因。因此,术后辅助治疗在乳腺癌全程管理中的重要性不言而喻。辅助治疗的主要目标在于清除体内可能存在的微小转移灶,从而降低局部及远处复发的风险,并最终改善患者的总生存,推动我们向“更多患者治愈”的宏伟目标迈进。
辅助放疗、化疗和内分泌治疗共同构建“治愈护城河”,而OFS的升阶强化带来更多保障
杜建飞教授指出,对于HR+/HER2-早期乳腺癌而言,术后辅助内分泌治疗,必要时结合放疗或化疗,是术后降低疾病复发和转移风险的基石。其中,对于高风险患者,治疗策略多采取强化方式,通过提高治疗强度来增强疗效并降低疾病复发风险,例如绝经前患者加用OFS,或对于其他高风险患者延长辅助内分泌治疗时长、联合靶向治疗等;而在低风险患者中,治疗策略则侧重于辅助治疗的降阶梯,以避免过度治疗和不良反应。
辅助放疗:放疗是早期乳腺癌综合治疗的重要组成部分,其不仅可以提高局部区域控制率,还可以通过放疗远隔效应来降低远处转移风险,从而改善患者的远期生存乃至总生存。CBCS乳腺癌诊治指南与规范(2025 精要版)[5]系统阐述了术后放疗的个体化决策路径。对于保乳术后患者,指南指出全乳放疗作为标准治疗可显著降低局部复发风险,全乳切除术后患者则需依据复发风险进行分层:原发肿瘤≥5cm(pT3+)、皮肤/胸壁浸润、腋窝淋巴结转移≥4枚等高危因素者明确需放疗;对于1-3枚淋巴结转移的T1-2期患者,放疗可降低局部复发率及乳腺癌相关死亡,但需权衡低危亚组的获益风险比;对于行乳腺单纯切除联合前哨淋巴结活检(SLNB)的T1-2期患者,如前哨淋巴结阳性,在不考虑后续腋窝淋巴结清扫时,同样推荐术后放疗。
辅助化疗:辅助化疗是HR+/HER2-早期乳腺癌辅助治疗的重要手段,其旨在消灭残留病灶,降低乳腺癌转移和复发的风险。然而,仅有2%~20%的患者真正从化疗中获益[6],因此如何筛选出化疗获益患者成为亟待解决的问题。目前 CBCS乳腺癌诊治指南与规范(2025 精要版)[5]推荐中危且pN0、中危且pN1、高危患者接受辅助化疗。
辅助内分泌治疗:内分泌治疗是HR+/HER2- 早期乳腺癌患者重要的治疗基础,其疗效确切,被证明可有效降低患者复发风险,延长患者的无进展生存期,并且副作用相对较小,有利于患者坚持长期治疗。初始辅助内分泌治疗包括他莫昔芬(TAM)和芳香化酶抑制剂(AI)治疗5年,而新型靶向治疗药物CDK4/6抑制剂的应用,显著改善了HR+/HER-2-早期乳腺癌的治疗模式,从单一内分泌治疗转变为联合靶向治疗,为患者带来突破性生存获益。CBCS乳腺癌诊治指南与规范(2025 精要版)[5]建议中高危患者在标准内分泌治疗的基础上加用CDK4/6抑制剂可以显著降低其复发风险。但值得注意的是,我国乳腺癌发病呈现显著年轻化特征,绝经前患者中HR+占比高达50%-60%[7]。目前,国内外权威乳腺癌指南[5,8],均推荐在术后辅助内分泌治疗或联合靶向治疗基础上加用OFS作为绝经前HR+/HER2-、中高危早期乳腺癌的标准治疗方案。其中,戈舍瑞林凭借更强的受体亲和力有望使更高比例的患者维持理想的绝经后状态,因此被视为OFS的经典治疗药物。然而,戈舍瑞林自1987年上市以来,其植入剂型因独特的崩解过程,或可导致药物缓释的血药浓度波动大,治疗持续性面临挑战[9-11]。为了突破这一瓶颈,我国自主研发的戈舍瑞林微球顺应而生。
与普通制剂相比,微球是一种特殊的高端制剂,有更好疗效和更小的不良反应,临床优势明显。这是由于微球制剂中,药物通常溶解或分散于粒径在微米级别 (1~250μm)的球体,进入人体后则可实现长效缓释和靶向的作用[12],是实现药物长效释放的重要方式[13]。戈舍瑞林微球采用符合FDA标准的全球领先微球技术,将“戈舍瑞林”这一经典老药与新兴微球技术强强联合,突破了传统植入剂在药代动力学等方面的局限,通过剂型的创新为内分泌治疗带来了“升级”之选。
从制备工艺到缓释特性、再到临床疗效,戈舍瑞林微球以创新技术驱动诊疗“再”升级
在杜建飞教授看来,促性腺激素释放激素激动剂(GnRHa)缓释制剂的理想化标准集中于三点:它必须拥有先进且稳定的制备工艺和可靠的质量;其缓释特性需实现精准控制;并且最终落脚于临床实践,其需展现出卓越的有效性和良好的安全性。而戈舍瑞林微球正是满足这三大条件的升级之选。
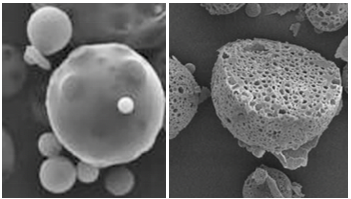
既往研究表明,微球形态和结构与载药量和药物释放行为密切相关,但传统微球工艺所做的微球表现为典型的粒径不均、结构不致密(图1)[14]。然而,理想微球的微观形态应为圆整球型或椭圆形实体,形态饱满,颗粒的大小应尽可能均匀,微球之间无粘连,且包封率高,体内外药物缓释平稳[15,16]。戈舍瑞林微球作为首例使用“二代微球技术”的上市药物,采用水包油包固(S/O/W)的乳化挥发法更新工艺,实现药物高包封率(突破90%)、粒径均一(图2)、缓释结构稳定,显著降低了微球释放初期吸附在微球表面的药物通过扩散而快速释放的风险,并延长了释放周期[9-11]。

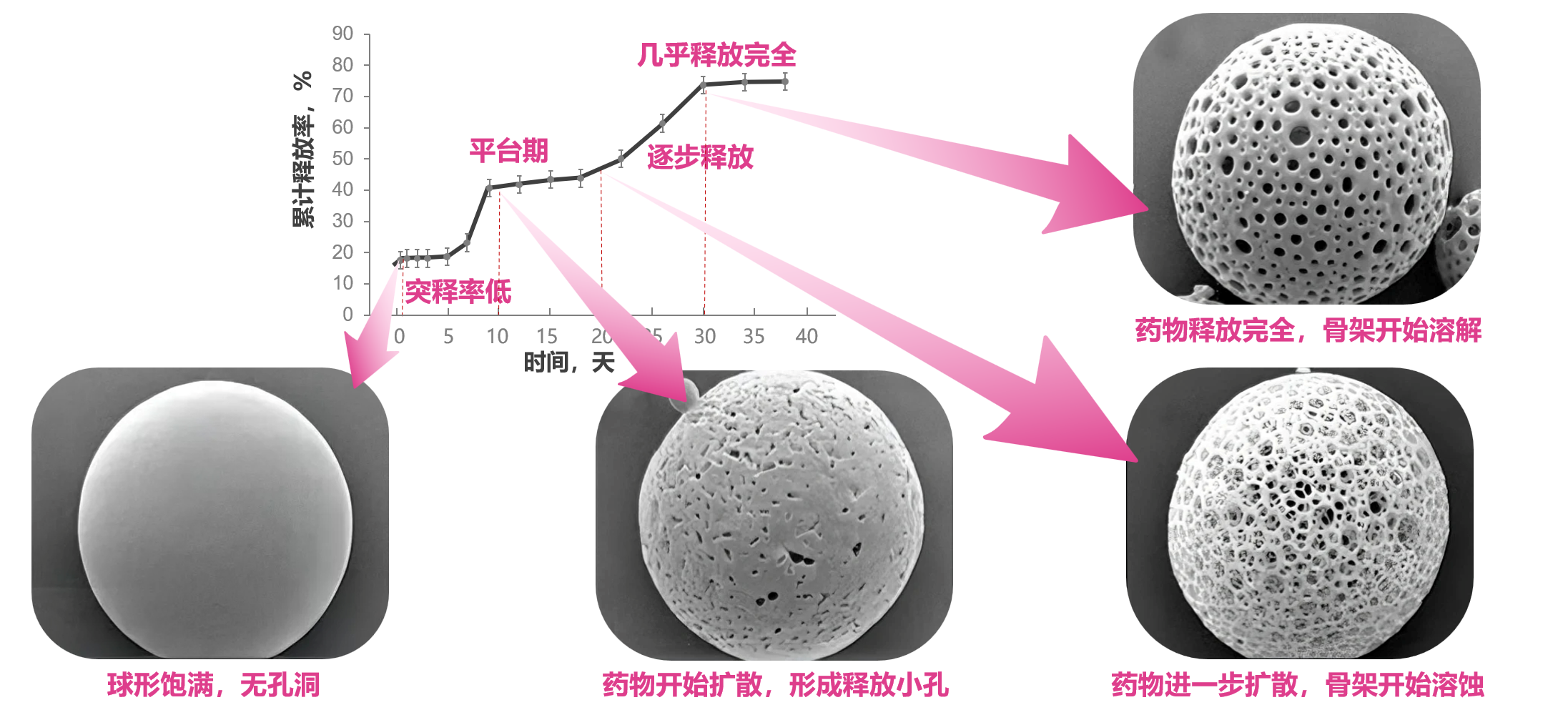
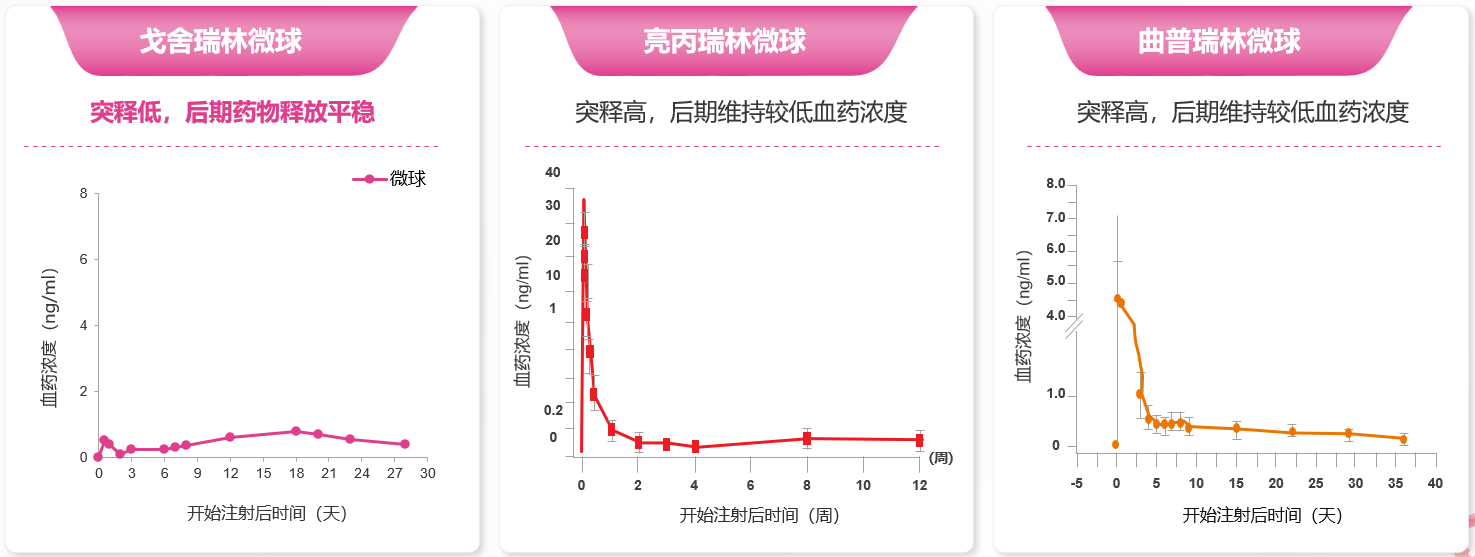
此外,与植入剂相比,戈舍瑞林微球血药浓度波动更小(图3)。既往研究表明,戈舍瑞林植入剂组的第二个峰值达峰时间出现在给药后的第15天,该峰浓度的几何均值为2.13±0.69 ng/mL(图4)。然而,戈舍瑞林微球制剂的前瞻性研究显示,PK/PD亚组患者首次给药后,血浆中戈舍瑞林在1小时左右出现第1个峰值,浓度为(0.29±0.12)ng/ml,之后戈舍瑞林从微球中缓慢释放,血药浓度较平稳。首次给药28天内药物总暴露浓度-时间曲线下面积(AUC)0~t为 138.89 h·ng/ml,初始释放的暴露量 AUC0~48 h为2.52 h・ng/ml,仅占总暴露量的1.8%,这亦证实戈舍瑞林微球制剂突释控制良好,从而有效避免了单药浓度过高增加的用药风险及相关不良反应(如阴道出血、疼痛加重等)[17]。
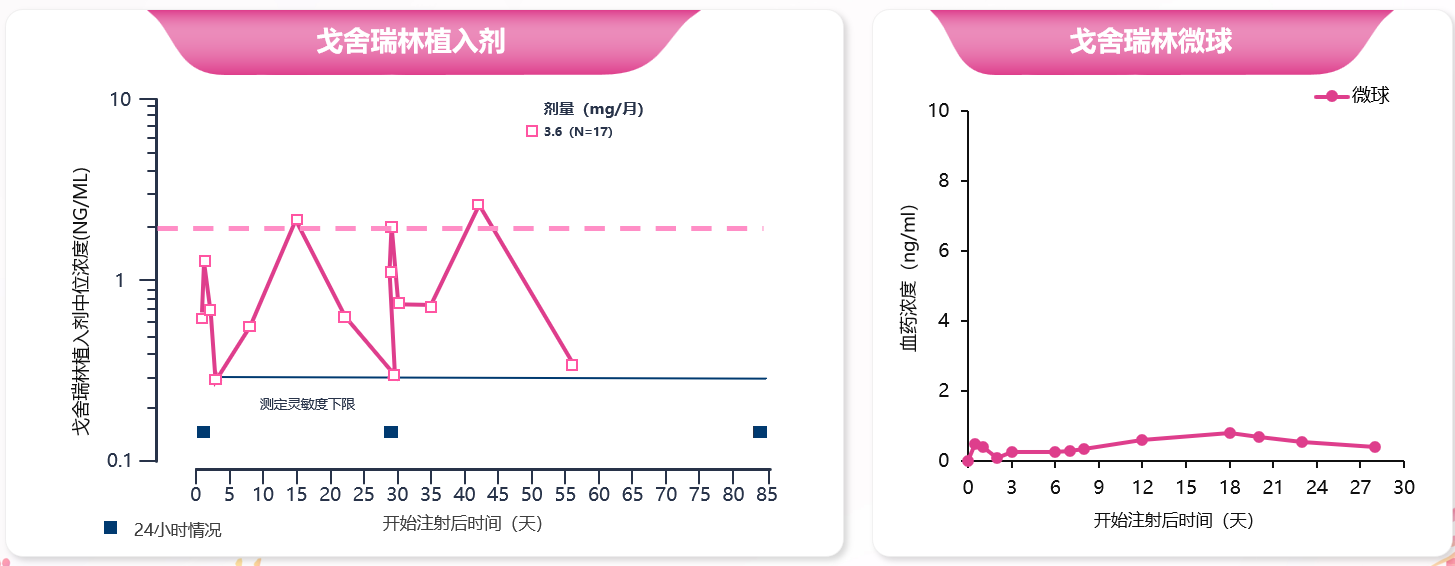 图4. 戈舍瑞林植入剂和微球制剂的血药浓度曲线
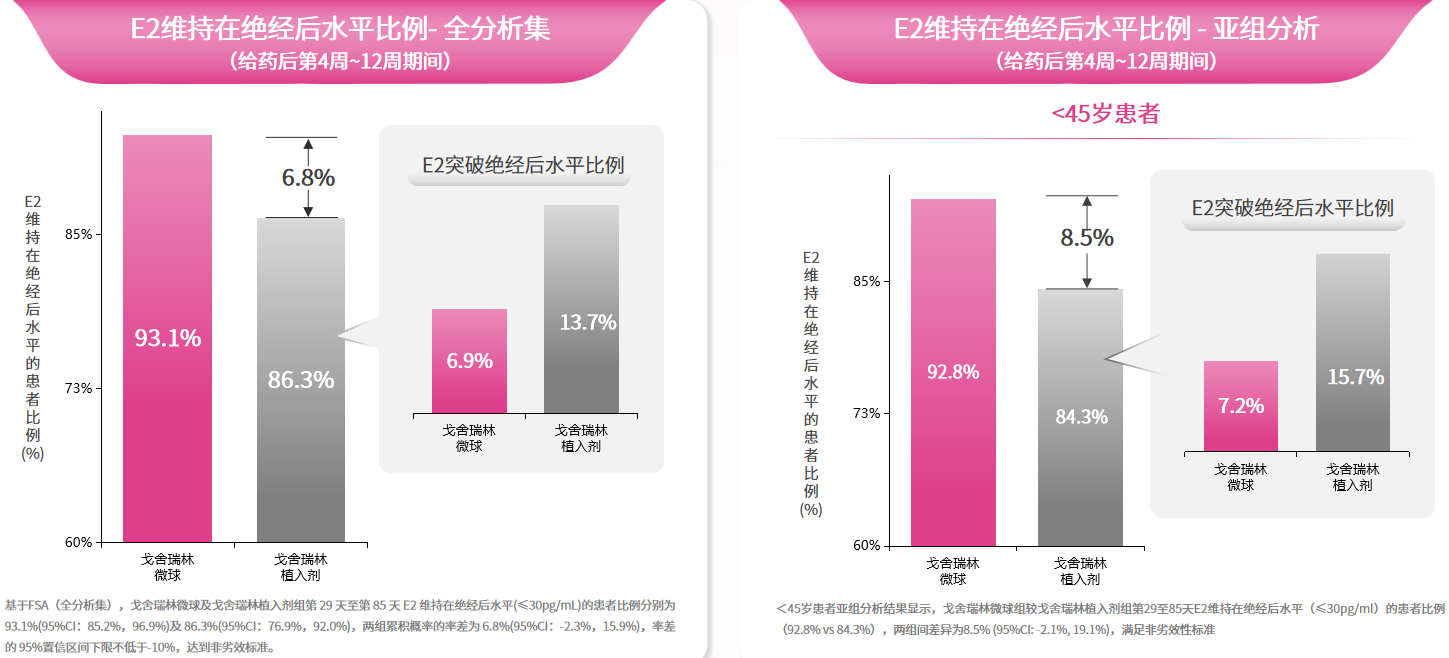
图4. 戈舍瑞林植入剂和微球制剂的血药浓度曲线更为值得关注的是,戈舍瑞林微球通过高效抑制性腺轴使性激素稳定维持于治疗目标水平(E2≤30 pg/ml),其持续稳定的雌激素抑制作用显著降低逃逸性排卵风险,特别适合卵巢功能活跃的绝经前患者群体。多中心随机对照III期临床试验数据[17]表明,戈舍瑞林微球组和戈舍瑞林植入剂组患者第29天至第85天维持雌二醇(E2)在绝经后水平(≤30pg/ml)的比例分别为93.1%和86.3%,两组累计概率的差值为6.8%(95% CI:-2.3%~15.9%),达到了非劣效标准(图5左)。亚组分析显示,与≥45岁患者相比,<45岁患者戈舍瑞林微球组有更高比例的患者血清E2维持在绝经后水平( 92.8% vs 84.3%),两组累计概率的差值为8.5% (95%CI: -2.1%, 19.1%)(图5右),戈舍瑞林微球组E2维持在绝经后水平患者比例数值有更高趋势,提示<45岁乳腺癌患者从戈舍瑞林微球获益更多。安全性方面,戈舍瑞林微球组和植入剂组治疗期间不良反应事件(TEAEs)发生率无显著性差异,但由于戈舍瑞林微球制剂的设计允许多部位肌肉注射的给药方式,可有效规避同一部位反复注射可能导致的不良反应风险,进一步优化了患者的治疗体验。
总而言之,戈舍瑞林微球作为基于戈舍瑞林活性成分优化而成的2.2类改良新药,在药物释放长效稳定性方面实现了重大突破,且其疗效的非劣效性及安全性已通过III期临床研究得到了验证。随着戈舍瑞林微球乳腺癌适应症成功纳入2025年国家医保目录,绝经前乳腺癌患者已迎来全新的、兼顾疗效与经济性的OFS治疗选择。我们相信,此举将开启HR+乳腺癌患者OFS治疗的新篇章,并进一步助力优化乳腺癌的慢病化管理。
[1]BRAY F, LAVERSANNE M, SUNG H, et al. CA Cancer J Clin, 2024, 74(3): 229-263.
[2]SUN K X, ZHANG B L, LEI S Y, et al. Chin Med J (Engl), 2024, 137(20): 2429-2436.
[3]GIAQUINTO A N, SUNG H, NEWMAN L A, et al. CA A Cancer J Clinicians, 2024, 74(6): 477-495.
[4]Zeng HM , Ran XH , An L ,et al. Lancet Public Health, 2021,6(12):e877-e887.
[5]《中国抗癌协会与中华医学会肿瘤学分会乳腺癌诊治指南与规范(2025年版 精要本)》
[6]中国抗癌协会国际医疗与交流分会, 中国医师协会肿瘤医师分会乳腺癌学组. 激素受体阳性人表皮生长因子受体2阴性早期乳腺癌术后辅助治疗多基因检测应用专家共识(2023版)[J]. 中华肿瘤杂志, 2023, 45(10):863-870.
[7]Davies C, Pan H, Godwin J, et al. Lancet. 2013;381(9869):805-816.
[8]NCCN Guidelines Version 3.2025
[9] Li, Xuebing, et al. Materials Horizons 11.12 (2024): 2820-2855.
[10]Qi, Pan, et al. Molecular pharmaceutics 16.8 (2019): 3502-3513.
[11]Wang, aoyi, and Diane J. Burgess. Advanced Drug Delivery Reviews 178 (2021): 113912.
[12]微球技术:https://www.avt-avt.com/article-item-3214.html?app=mb.
[13]徐明新,陶颖,陈园园等.长效缓释微球制剂生产技术的发展现状[J].现代生物医学进展,2017,17(19):3772-3775.
[14]陈超,樊海丽,蔡志威,等.扫描电子显微镜在缓释微球制剂表征中的应用进展[J].分析测试技术与仪器,2022,28(02):132-138
[15]http://www.leadingpharm.com/News/desc.html?id=24&aid=488
[16]魏颖,尹湉,张宇,等. 缓释微球仿制药一致性评价过程中质量管理策略[J]. 医药导报,2022,41(3):412-416.
[17]邵喜英等.LY01005和诺雷得®治疗绝经前乳腺癌的多中心随机对照Ⅲ期临床研究.10.3760/cma.j.cn112152-20240126-00051
[18]注射用醋酸亮丙瑞林微球说明书(2021年12月20日)
[19]张成乾,寸冬梅,陶安进,唐星,杨明世.不同封端的PLGA/PLA-醋酸曲普瑞林微球的制备及体内外评价[J].沈阳药科大学学报,2021,38(1):1-7
排版编辑:肿瘤资讯-王俊澔











 苏公网安备32059002004080号
苏公网安备32059002004080号


