编译:肿瘤资讯
非小细胞肺癌(NSCLC)的治疗格局经历了显著的演变,从化学治疗发展到靶向治疗和免疫治疗。如今,抗体药物偶联物(ADC)作为一种创新且强大的治疗类别,已成为癌症治疗的新前沿。通过将单克隆抗体的特异性与化疗药物的强效细胞毒性相结合,ADC实现了靶向药物递送,拓宽了治疗窗口,并为克服治疗耐药性提供了可能。基于此,【肿瘤资讯】特将ADC在NSCLC领域的最新临床进展进行整理,重点关注TROP2和HER2两大关键靶点的最新进展,以飨读者。
ADC的作用机制
NSCLC的治疗已历经数个时代,从奠定含铂化疗的地位,到针对驱动基因突变患者的精准靶向治疗 [1],再到改变治疗格局的免疫检查点抑制剂。尽管取得了这些进步,但治疗过程中的耐药性和显著的毒副作用等挑战依然存在 [2, 3]。
随着ADC的问世,一个新的治疗时代已经来临。ADC的概念最早由保罗·埃尔利希(Paul Ehrlich)在一个多世纪前提出,他将其设想为能够选择性地将强效细胞毒性药物递送至癌细胞,同时避免损伤健康组织的“魔法子弹” [4]。ADC通过三个核心部分实现这一目标:一个能与肿瘤相关抗原结合的高度特异性单克隆抗体、一个强效的细胞毒性载荷,以及一个连接两者的稳定连接子 [5]。
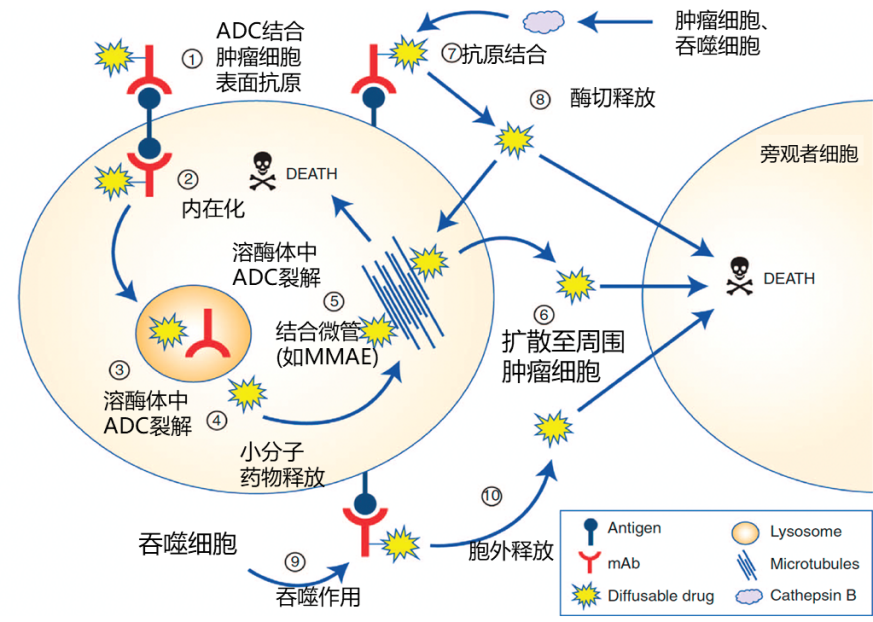
ADC的作用机制是多方面的。其核心机制为:ADC与肿瘤细胞表面的靶抗原结合,随后被内化进入溶酶体中降解,释放出细胞毒性载荷,从而诱导细胞死亡(图1) [6]。许多现代ADC,如德达博妥单抗(Dato-DXd)和德曲妥珠单抗(T-DXd),还具有“旁观者效应”——其高细胞膜渗透性的载荷能够从靶细胞中扩散出来,杀伤邻近的、无论是否表达靶抗原的肿瘤细胞(图1) [6]。此外,ADC的抗体部分还可以通过抗体依赖的细胞介导的细胞毒性作用(ADCC)和补体依赖的细胞毒性作用(CDC)等机制,触发抗肿瘤免疫应答 [6]。这种精准靶向与强效细胞毒性的结合,使得ADC相较于传统化疗拥有更宽的治疗窗口。
TROP2 ADC NSCLC研究最新进展
滋养层细胞表面抗原2(TROP2)是一种在多种实体瘤(包括NSCLC)中过表达的跨膜糖蛋白 [7]。在NSCLC中,TROP2在高达64%的肺腺癌中呈高表达,且其表达水平与较短的总生存期(OS)、更晚的肿瘤分期等不良预后因素直接相关 [8, 9]。TROP2的高表达及其与不良预后的关联性,使其成为肺癌ADC治疗领域一个极具前景的靶点 [9]。
目前,多款靶向TROP2的ADC正处于后期临床开发阶段,其中以德达博妥单抗(Dato-DXd)、戈沙妥珠单抗(SG)和芦康沙妥珠单抗(SKB264, sac-TMT)最为瞩目。这些药物在结构设计上存在差异,尤其是在连接子和载荷方面,这直接影响了它们的稳定性、效能及安全性。Dato-DXd 是一种以人源化抗 TROP2 IgG1 单克隆抗体MAAP-9001a为载体、通过四肽可断裂连接子将有效载荷 DXd(TOP1 抑制剂,伊喜替康衍生物)与抗体偶联而成的 ADC [10]。sac-TMT同样采用人源化抗 TROP2 IgG1 单克隆抗体hRS7 ,但使用可水解的 2-甲基磺酸吡亚胺-CL2A 碳酸盐连接子携带 KL610023(TOP1 抑制剂,倍罗替康衍生物)[11]。SG则借助人源化抗 TROP2 IgG1 单克隆抗体 hRS7,通过可水解的 CL2A 碳酸盐连接子将 SN-38(TOP1 抑制剂,伊立替康活性代谢物)递送至靶细胞[12]。
德达博妥单抗(Dato-DXd)
III期TROPION-Lung01研究是首个在肺癌领域取得阳性结果的ADC关键性临床试验。该研究旨在评估Dato-DXd对比多西他赛在经治晚期或转移性NSCLC患者中的疗效。在预设的非鳞状(NSQ)组织学亚组分析中,Dato-DXd在无进展生存期(PFS)和OS方面均显示出具有统计学意义和临床意义的显著改善 [13]。在非鳞癌亚组中,Dato-DXd组的中位PFS为5.5个月,而多西他赛组为3.6个月(HR=0.63)。研究同样观察到显著的OS获益,在非鳞癌亚组中Dato-DXd组的中位OS为14.6个月,多西他赛组为12.3个月(HR=0.84)。此外,非鳞癌患者中, 无论是否具有可靶向基因组改变,Dato-DXd 相较多西他赛,ORR也有临床意义的改善。在安全性方面,Dato-DXd展现出良好且可管理的安全性。≥3级治疗相关不良事件(TRAEs)的发生率显著低于多西他赛组(25.6% vs. 42.1%) [13]。
Dato-DXd在对靶向治疗产生耐药性的EGFR突变NSCLC患者中也显示出令人鼓舞的活性。一项对TROPION-Lung01和TROPION-Lung05研究的汇总分析显示[14],在这一经多线治疗的患者人群中,Dato-DXd治疗的经盲法独立中央审查(BICR)确认的ORR达到42.7%,中位PFS为5.8个月,中位OS为15.6个月 。此外,II期ORCHARD研究评估了Dato-DXd联合奥希替尼用于一线奥希替尼治疗后进展的患者,其中6mg/kg剂量组的中位PFS达到11.7个月,中位缓解持续时间(mDoR)达到20.5个月,提示了这一联合策略在克服TKI耐药方面的巨大潜力[15]。
芦康沙妥珠单抗(SKB264, sac-TMT)
Sac-TMT是另一款表现出良好前景的TROP2-ADC。II期OptiTROP-Lung03研究在EGFR-TKI和含铂化疗均治疗失败的晚期EGFRm NSCLC患者中,对比了sac-TMT与多西他赛的疗效 [16]。结果显示,sac-TMT具有显著的疗效优势,其BIRC确认的ORR为45.1%,而多西他赛组仅为15.6%;中位PFS也显著延长(6.9个月 vs. 2.8个月,HR=0.30)。其最常见的TRAEs为血液学毒性,56.0%的患者出现了≥3级的TRAE。
戈沙妥珠单抗(SG)
II期TROPiCS-03研究旨在评估SG二线治疗广泛期小细胞肺癌的疗效及安全性。研究结果显示[17],研究者评估的ORR为41.9%,中位DOR、中位PFS和中位OS分别为4.7个月、4.4个月和13.6个月,与独立评审委员会评估的数据类似。在安全性方面,32例患者(74.4%)发生≥3级的治疗后出现的不良事件(TEAE)。
HER2 ADC NSCLC研究最新进展
人表皮生长因子受体2(HER2)的改变,主要是激活突变,见于约2-4%的NSCLC患者中,是一种与不良预后相关的驱动基因 [18]。在中国,其发生率约为3.1% [19]。在过去,HER2突变(HER2m)NSCLC患者的治疗选择有限,传统化疗、TKI和免疫治疗的疗效均不理想,ORR通常在10-30%之间,mPFS不足5个月 [20-23]。
德曲妥珠单抗(T-DXd),一款靶向HER2的ADC,显著改变了这一疾病的治疗格局。关键性II期DESTINY-Lung02研究评估了两种剂量的T-DXd在经治HER2m转移性NSCLC患者中的疗效 [24]。研究证实了T-DXd强劲且持久的抗肿瘤活性。5.4 mg/kg剂量组经BICR确认的ORR高达50.0%,中位PFS为10.0个月,中位OS长达19.0个月。这些优异的结果在中国人群的DESTINY-Lung05研究中也得到了验证,该研究报告了相似的ORR(58.3%)和疾病控制率(91.7%) [25]。T-DXd在脑转移患者中也表现出显著疗效,而脑部是该病常见的进展部位。DESTINY-Lung02研究的分析显示,在基线伴有CNS转移的患者中,ORR达到了60% [24]。
在安全性方面,基于其良好的获益-风险比,5.4 mg/kg被确立为最佳剂量。与6.4 mg/kg剂量组相比,该剂量组的≥3级TRAEs和经裁定的药物相关间质性肺病(ILD)/肺炎的发生率更低 [24]。
T-DXd的应用前景已不局限于HER2突变人群。在DESTINY-Lung01研究中,T-DXd在HER2过表达(IHC 2+/3+)的NSCLC患者中也显示出积极的临床活性。5.4 mg/kg剂量组的ORR为34.1%,在IHC 3+亚组中更是高达52.9%[26]。正在进行的DESTINY-Lung03研究将进一步探索T-DXd在这一人群中的治疗潜力[27]。
总结
ADC作为一种新型治疗模式,已在NSCLC的治疗格局中占据了关键地位 。ADC药物通过其独特的“抗体-连接子-载荷”三联结构,将单克隆抗体的高特异性靶向作用与强效细胞毒性载荷相结合,并通过抗体部分介导抗肿瘤免疫效应,从而实现对肿瘤细胞的精准杀伤,为NSCLC治疗领域拓展了一种全新的策略。
更为关键的是,对于酪氨酸激酶抑制剂(TKI)或免疫检查点抑制剂治疗后出现耐药的患者,ADC有望提供一种全新的治疗选择,以应对这一严峻的临床挑战与未满足的医疗需求。目前,多款ADC药物已获得美国食品药品监督管理局(FDA)和中国国家药品监督管理局(NMPA)的批准,用于特定NSCLC患者亚群的治疗。这些进展预示着ADC药物将进一步重塑晚期NSCLC患者的诊疗模式与临床实践。
排版编辑:肿瘤资讯-明小丽
[1] Wang, Meina et al. Nature medicine vol. 27,8 (2021): 1345-1356.
[2] 曾益新,张晓实,刘强等.分子靶向治疗:肿瘤治疗的里程碑[J].癌症,2008,27(8):785-787.
[3] Corrie P G . Cytotoxic chemotherapy: clinical aspects[J]. 2004;32(3):25-29.
[4] LoRusso PM, et al. Clin Cancer Res. 2011;17(20):6437-6447.
[5] Nakada T, et al. Chem Pharm Bull (Tokyo). 2019;67(3):173-185.
[6] Zhiwen F, et al. Signal Transduct Target Ther. 2022 Mar 22;7(1)-93.
[7] Lenart S, et al. Cancers(Basel). 2020-12(11)-3328.
[8] Kentaro Inamura, et al. Oncotarget. 2017 Apr 25;8(17):28725-28735.
[9] Inamura K, et al. Oncotarget. 2017;8:28725-28735.
[10] Daisuke Okajima, et al. Mol Cancer Ther. 2021 Dec;20(12):2329-2340.
[11] Yezhe Cheng , et al. Front Oncol. 2022 Dec 23:12:951589.
[12] Kopp A , Hofsess S , Cardillo T M ,et al..Molecular cancer therapeutics, 2022.
[13] Myung-Ju Ahn, et al. TROPION-Lung01 Trial Investigators. Datopotamab Deruxtecan Versus Docetaxel for Previously Treated Advanced or Metastatic Non-Small Cell Lung Cancer: The Randomized, Open-Label Phase III TROPION-Lung01 Study. J Clin Oncol. 2025 Jan 20;43(3):260-272.
[14] Myung-Ju Ahn, et al. Efficacy and safety of datopotamab deruxtecan (Dato-DXd) in patients (pts) with previously-treated EGFR-mutated advanced non-small cell lung cancer (NSCLC): a pooled analysis of TROPION-Lung01 and TROPION-Lung05. 2024 ESMO Asia. LBA7.
[15] X. Le, et al. Journal of Thoracic Oncology (2025) 20 (3): S1-S97.
[16] Li Zhang et al. 2025 ASCO Abstract 8507.
[17] Dowlati A, et al. Phase 2 Open-Label Study of Sacituzumab Govitecan as Second-Line Therapy in Patients With Extensive-Stage SCLC: Results From TROPiCS-03. J Thorac Oncol. 2025 Jun;20(6):799-808.
[18] Shirong Zhang, et al. Thorac Cancer. 2023 Jan;14(1)-91-104.
[19] Fan Xu, et al. J Clin Oncol 40, 2022 (suppl 16; abstr 8546).
[20] Mazières J, et al.Ann Oncol. 2016;27:281–6.
[21] Lai WV, et al. European Journal of Cancer, 2019, 109: 28-35.
[22] Zhou C, et al. Journal of Clinical Oncology, 2020, 38(24): 2753-2761.
[23] Saalfeld F C, et al. Journal of Thoracic Oncology, 2021, 16(11): 1952-1958.
[24] Pasi J, et al. 2024 ASCO. Abstract 8543.
[25] Ying Cheng, et al. 2024 AACR. Poster CT248.
[26] Egbert Smit, et al. ESMO 2022. Abstract 975P.
[27] https://clinicaltrials.gov/study/NCT04686305











 苏公网安备32059002004080号
苏公网安备32059002004080号


