病史摘要:患者,男性,53岁,患者为MSS/pMMR型结肠癌术后复发肝转移患者,综合治疗(靶向、化疗联合射频消融治疗)后,继发急性髓系白血病,经积极治疗后复查骨穿达完全缓解。目前患者采用呋奎替尼联合“阿扎胞苷+维奈克拉”维持治疗,病情稳定。
症状体征:入院时神志清,精神可,腹部可见陈旧性手术瘢痕,生命体征平稳,KPS 90分。
诊断方法:CT,MRI,骨穿。
治疗方法:综合评估患者当前病情,多次MDT,制定全程治疗策略,同时动态监测血生化和影像学检查,更加关注血小板减少等相关不良反应的全程管理,兼顾疗效和安全性,制定个体化的治疗方案,提高患者的生活质量和总生存期。
临床转归:目前患者处于无疾病进展生存状态,骨穿提示完全缓解,影像学评估稳定。
适合阅读人群:肿瘤科;胃肠外科;消化科
关键词:结肠癌;白血病;综合治疗;血小板减少;海曲泊帕
前言
近年来,多学科团队会诊(MDT)在恶性肿瘤的临床治疗实践中不断得到深化应用,其不仅聚焦于治疗效果,还极为重视对不良反应的关注,并为肿瘤治疗制定了全面的管理策略。这些进步显著提升了恶性肿瘤诊疗的水平。随着肿瘤患者生存期的延长以及现有患者数量的增加,多原癌(multiple primary cancer,MPCC)的发病率亦随之上升,成为临床关注的焦点。多原癌是指在同一患者体内,不论是同一器官还是不同器官、组织中,同时或先后发生的两种及以上的原发性恶性肿瘤。其中,实体肿瘤、林奇综合征以及多发性内分泌肿瘤综合征等情况较为常见,而实体肿瘤合并血液病,特别是在初诊即遇到两种情况的案例,则较为少见[1-2]。因此,为多原癌患者制定个体化的治疗策略显得格外重要,尽管目前在这一领域内尚缺乏广泛的共识。许多临床医生对于多原癌的了解不足。针对这一点,本文以一例结肠癌合并急性髓系白血病的多原癌患者为例,个体化治疗方面以海曲泊帕预防血小板减少为代表,总结并探讨了多原癌的综合治疗策略,以期待为临床提供有价值的参考和启示。
临床资料
一般资料
54岁男性,3年前因“升结肠占位”行“右半结肠癌根治术”,术后给予“奥沙利铂+卡培他滨”方案辅助化疗6周期,末次化疗时间2020-09-03。后定期复查病情稳定,2021-6行MRI示“肝占位”,行PET/CT示“结肠癌术后,肝脏肿块代谢增高,考虑肝转移”。
全程治疗的前提示完整的病理诊断和分子病理诊断,我院病理会诊: 1.(升结肠活检)腺癌。2.(直肠活检)绒毛-管状腺瘤。3.(结肠癌根治术标本)中分化腺癌伴坏死,浸润肠壁全层达浆膜下;可见脉管内癌栓;未见明确神经侵犯;小肠切缘、上切缘及环周切缘均未见癌;大网膜及阑尾未见癌累及;淋巴结未见转移癌(肠周0/20,回肠血管0/1,结肠中动脉0/1)。PMS2(+),MLH1(+),MSH2(+),MSH6(+)。基因检测示:KRAS/NRAS野生,MSS,UGT1A1基因杂合多态性。结合患者病理和影像学检查等,第一次MDT会诊,治疗目标是争取NED。后于2021-6-29、2021-7-19、2021-08-09、2021-09-01给予“贝伐珠单抗+mFOLFOXIRI(奥沙利铂+伊立替康+亚叶酸钙+氟尿嘧啶) ”方案治疗,期间出现III度骨髓抑制(血小板减少),后给与海曲泊帕二级预防应用,按时足量完成4周期化疗,疗效评价PR。
2021-9-25于中国人民解放军总医院行“肝转移瘤射频消融治疗”。术后于2021-10-26、2021-11-19、2021-12-04、2021-12-29行“贝伐珠单抗+mFOLFOXIRI”方案化疗,复查病情稳定。于2022-01-18、2022-2-10行“贝伐珠单抗+卡培他滨”方案治疗。2022-4-1行“贝伐珠单抗+卡培他滨(减量)”方案化疗,定期复查,病情稳定。后因白细胞减少、血小板减少未能按时治疗。2022-8因血小板持续进行性减少,行骨穿,确诊急性髓系白血病,转科至血液内科治疗,考虑为继发白血病,于2022.09.03行DA方案化疗,于2022.10.14、2022.11.21给予阿扎胞苷针+维奈克拉口服方案化疗。2023-3评估白血病缓解,复查MRI:肝右后叶病变上方(下腔静脉旁)较前为新发。沟通病情后于2023-3-9给予呋喹替尼治疗。复查骨穿,免疫学检测提示:MRD≈23.128%。结合骨髓穿刺结果,急性髓系白血病复发,于2023-07-14行“阿扎胞苷+维奈克拉”方案化疗,后复查骨穿达完全缓解,后行“阿扎胞苷+维奈克拉+呋奎替尼”方案维持治疗中,患者生活质量好,生存随访中。
检查
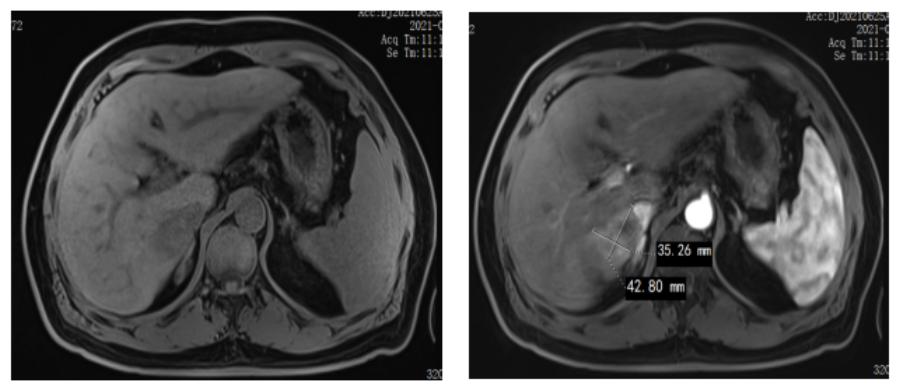 图1. 患者结肠癌术后复查肝转移 治疗前
图1. 患者结肠癌术后复查肝转移 治疗前
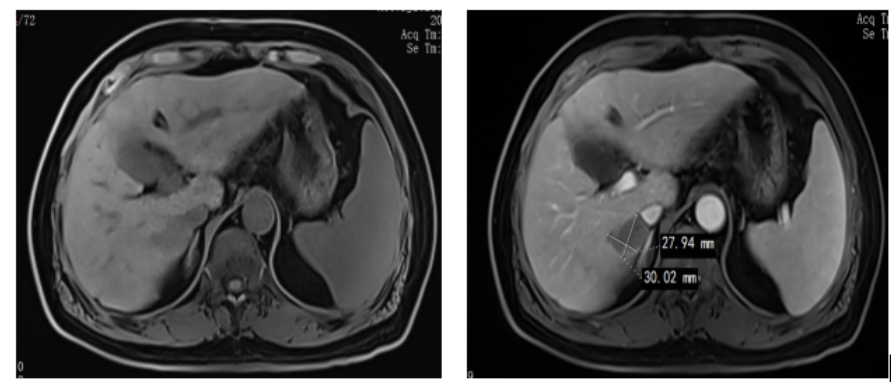 图2. 患者结肠癌术后复查肝转移 3次靶向联合化疗治疗后
图2. 患者结肠癌术后复查肝转移 3次靶向联合化疗治疗后
诊断与鉴别诊断
综合症状,体征、实验室检查及影像学检查,
诊断: 升结肠癌术后 pT3NxM1 IV期(肝),KRAS/NRAS 野生型MSS/pMMR
继发急性髓系白血病
治疗
在多学科团队(MDT)的首次会诊中,治疗的主要目标是达到无证据疾病(NED)状态,采取的策略是将全身系统化疗与局部治疗结合使用。治疗方案选用了“贝伐珠单抗+mFOLFOXIRI”,进行了4个疗程的治疗。在第一和第二个疗程化疗后,患者出现了II度和III度的骨髓抑制(血小板减少),在第三个疗程化疗后,应用海曲泊帕进行了二级预防以减少血小板的进一步减少。经过4个疗程后,疗效评估为部分缓解(PR)。在第二次MDT会诊后,综合评估决定进行“肝转移灶射频消融术”,手术后继续实施原先的治疗方案,疗效评价为稳定。随后,由于血小板减少,患者接受了骨髓穿刺,确诊为急性髓系白血病,并开始了以DA方案为序贯的阿扎胞苷针+维奈克拉方案的维持治疗。2023年3月,白血病的评估显示已缓解,但复查的MRI显示肝右后叶病变上方(紧邻下腔静脉)较前有新发展。经过MDT会诊后,调整了治疗方案,采用阿扎胞苷+维奈克拉+呋奎替尼方案进行维持治疗。
治疗结果、随访及转归
目前患者生活质量好,生存随访中。
讨论
结肠癌是我国最常见的恶性肿瘤之一。随着免疫治疗和靶向治疗等综合治疗方法的进步,5年生存率持续提升,但结肠癌仍然对人类健康构成了严重威胁。肝脏作为结肠癌远处转移的主要靶器官,许多患者在初诊时就已出现肝转移,使得根治性手术切除变得不可能。即便是接受了结直肠癌原发灶的根治性手术,患者术后也容易发生肝转移[3-5],这使得结肠癌肝转移成为临床治疗的一个重点和难点。
面对结肠癌术后复发及肝转移的情况,经MDT会诊后,会制定一套全身系统化疗联合局部治疗的综合治疗方案。根据肝转移灶的位置、大小、血供和数量等因素的综合评估,局部治疗手段包括手术、射频消融以及介入治疗等,其中MDT治疗的思路始终贯穿其间。对于那些暂时无法达到无证据疾病(NED)状态的结肠癌肝转移患者,一线化疗推荐使用5-FU+LV(或卡培他滨)联合奥沙利铂或伊立替康的双药或三药方案,并可辅以分子靶向治疗,或采用肝动脉灌注化疗[6]。对于dMMR/MSI-H患者,还可选择免疫检查点抑制剂治疗[7]。在本例中,经MDT会诊后,患者采用了“贝伐珠单抗+mFOLFOXIRI”方案,并接受了消融治疗,实现了治疗的转化成功。重要的是,我们需要特别关注不良反应,尤其是血小板减少的情况,并通过海曲泊帕进行二级预防,确保治疗方案能够按时足量顺利进行,从而获得更好的疗效。
多原发癌(MPC)发生的具体原因目前尚不明确,推测与遗传、环境等多种因素有关,可能与吸烟、基因状态、治疗方案等因素相关,也有研究表明奥沙利铂可能诱发白血病的风险[8-9],这是临床上需要重视的问题。本例中,患者在接受含奥沙利铂的化疗方案治疗结肠癌术后复发出现白血病,其确切机制尚不清楚。异时性多原发癌的临床治疗应当针对每种肿瘤的恶性程度进行具体分析:(1) 首选进行手术切除,必要时可采取分期手术;(2) 优先治疗恶性程度较高、预后较差的肿瘤;(3) 在MDT治疗框架下,一种肿瘤稳定后,可积极治疗另一种肿瘤,不断优化治疗方案。在本例患者中,结肠癌治疗后继发急性髓系白血病,治疗策略是先积极治疗结肠癌肝转移,发现急性髓系白血病时进行积极治疗。考虑到患者经过多周期化疗后,无法耐受较强的化疗,因此在结肠癌总体状况稳定时,将治疗重点转向白血病。在结肠癌病情再次进展时,再次调整治疗方案以积极控制结肠癌肝转移灶。当两种疾病都处于稳定状态时,采用联合的维持治疗方案,患者总体耐受情况良好,取得了较好的临床疗效。
综上所述,学科团队(MDT)合作在临床治疗中具有重要的意义。MDT允许不同领域的专家共同讨论患者的病例,从而制定出更全面、更有效的治疗计划;可以确保医疗资源得到合理分配,避免重复检查和治疗,降低医疗成本;对于复杂的病例,尤其是罕见病和多系统受累的疾病,MDT能够提供更全面的视角和解决方案。总之,MDT合作模式通过整合不同领域的专业知识和技能,为患者提供了更高质量、更个性化的医疗服务,同时也提高了医疗团队的工作效率和治疗效果。
[1] Badwelan M, Muaddi H, Ahmed A ,et al.Oral Squamous Cell Carcinoma and Concomitant Primary Tumors, What Do We Know? A Review of the Literature[J]. Curr Oncol. 2023,30(4):3721-3734.
[2] Al-Salameh A, Cadiot G, Calender A, et al.Clinical aspects of multiple endocrine neoplasia type 1.Nat Rev Endocrinol[J]. 2021,17(4): 207- 224.
[3] Gao J, Zhuang L, He C, et al. Risk and prognostic factors in patients with colon cancer with liver metastasis[J].J Int Med Res. 2023 Sep;51(9):3000605231191580.
[4] Liu Z, Xu Y, Xu G, et al.Nomogram for predicting overall survival in colorectal cancer with distant metastasis[J].BMC Gastroenterol,2021, 21(1):103.
[5] 中国医师协会外科医师分会, 中华医学会外科分会胃肠外科学组, 中华医学会外科分会结直肠外科学组, 等. 中国结直肠癌肝转移诊断和综合治疗指南(V2023)[J]. 中华胃肠外科杂志, 2023, 26(1): 1-15.
[6] Rahbari NN, Birgin E, Bork U, et al.Anterior Approach vs Conventional Hepatectomy for Resection of Colorectal Liver Metastasis: A Randomized Clinical Trial[J].JAMA Surg. 2021, 156(1):31-40.
[7] Datta J, Narayan RR, Kemeny NE, et al.Role of Hepatic Artery Infusion Chemotherapy in Treatment of Initially Unresectable Colorectal Liver Metastases: A Review[J]. AMA Surg, 2019, 154(8): 768-776.
[8] Saito M, Miyajima T, Ogasawara R, et al.Therapy-Related Acute Myeloid Leukemia with 11q23 Abnormality That Developed after Chemotherapy for Colorectal Cancer[J].Gan To Kagaku Ryoho. 2021,48(7):971-974.
[9] Damodaran S, Bellavia T, Sait SN, et al. Acute myeloid leukemia secondary to oxaliplatin treatment for esophageal cancer[J]..Clin Colorectal Cancer,2012,11(2):151-4.
排版编辑:肿瘤资讯-Olivia











 苏公网安备32059002004080号
苏公网安备32059002004080号


