病史摘要:54岁女性患者,驱动基因阳性肺腺癌术后5年病情进展,多发淋巴结转移,经历靶向治疗、含铂方案化疗、入组药物临床试验,治疗过程中出现I-IV继发性血小板下降,经海曲泊帕口服后血小板下降好转,抗肿瘤治疗顺利进行,病情得以控制。
症状体征:2017年8月首次发病时表现为咳嗽、胸闷、胸痛,右肺上叶呼吸音减低。肺癌根治术后症状好转。2023年2月出现持续性腹痛,剑突下、下腹胀痛不适,腹部查体无明细阳性体征。
诊断方法:包括影像学(CT、PET-CT)、血液检验、病理学检测、肿瘤组织标本基因二代测序等。
治疗方法:治疗方法主要有靶向治疗、含铂方案化疗、药物临床试验
临床转归:首诊PFS为54个月,复发后一线治疗PFS 2月,二线治疗PFS 3月,3线治疗PFS 7月。
适合阅读人群:肿瘤科;呼吸科
关键词:肺腺癌;继发性血小板下降;海曲泊帕;药物临床试验;TKI靶向治疗
前言
肺腺癌是肺癌的一种,起源于支气管黏膜上皮,少数源于大支气管的粘液掀,约占40-55%[1]。继发性血小板减少为肺癌患者治疗过程中常见的不良反应,临床工作中多使用白介素11(IL-11)、重组人血小板生成素(TPO)进行对症处理,但存在水钠潴留、心脏毒性风险。该患者因频发室性早搏史以及参加临床试验,我们选择了口服的血小板生成素受体激动剂(TPO-RA)海曲泊帕纠正血小板减少,保证了患者治疗的顺利进行,为肿瘤治疗所致血小板减少症(CTIT)提供另一个安全有效的新思路。
临床资料
一般资料
孙某某,女性,54岁,2017年8月因“咳嗽、胸闷、胸痛”行外院胸部CT提示右肺上叶前段结节影(2.1×1.6×2.1cm),2017年8月23日行右肺上叶切除术,术后病理提示:浸润性肺腺癌(肿瘤大小约2.5×2cm),非粘液-粘液混合性,粘液型癌占10%,腺泡状约占45%,乳头状约占40%,实体状约占5%),癌组织未侵犯肺被膜,脉管癌栓(-),神经侵犯(-),淋巴结(-),R0切除。术后出现支气管胸膜瘘在2017年9月在当地医院行修补术。诊断为:右肺腺癌(pT1cN0M0,IA3期)。第一次肿瘤组织基因检测提示:EGFR 21exon L858R突变。2017年10月开始口服吉非替尼至2022年4月自行停药,出现I-II级腹泻。
2023年2月27日因“上腹痛”于外院行PET-CT:1.右肺术后改变,未见肿瘤残留及复发征象;2.右肺门(SUVmax 7.7)、心底后方下腔静脉旁(26.2mm×24.1mm,SUVmax 10.4)、肝门区、腹膜后、双侧髂血管旁多发肿大淋巴结(较大者直径22.5mm,SUVmax 7.2),代谢增高,均考虑转移;3.L4棘突溶骨性骨质破坏,代谢增高,考虑转移瘤。2023年2月28日开始继续口服吉非替尼,腹痛无缓解。2023年3月3日就诊于我院。胸腹平扫+增强CT:1.右肺术后改变;2.胸主动脉右旁、肝门区、腹膜后多发增大淋巴结(图1A、1B、1C)。腹腔超声造影:腹腔淋巴结肿大并异型(上腹部脐上腹主动脉内侧下腔静脉前方可见一大小约1.6cm×1.0cm肿大的淋巴结回声,左侧髂血管旁可见一大小约1.5cm×1.3cm淋巴结回声,考虑转移性)。2023年3月7日行超声引导下左侧髂窝淋巴结穿刺活检,病理结果回报:穿刺标本1.(腹腔淋巴结)腺癌,结合免疫组化及病史,符合肺腺癌来源。2.免疫组化结果显示:CK7(+),TTF-1(+),Napsin A(+),CK20(-),Ki-67(+,约60%)。头颅MRI未见转移。第二次组织基因检测:EGFR 21exon p.L858R变异,T790M 位点无变异;PI3KCA 基因检测到 c.1633G>A(p.E545K)变异;ALK、BRAF、ERBB2、KRAS、MAP2K 1、MET、NRAS、ROS1 和 TP53 基因等热点区域未检测到变异。修正诊断为:右肺腺癌术后复发(rT0N2M1,rIV期,骨,腹盆腔淋巴结转移)。患者既往有频发室性早搏病史3年,心电图可见二联律、三联律,口服美托洛尔片缓释片治疗。入院查体ECOG PS 1分,BMI 18.36,NRS 5-7分,右侧胸壁沿肋间隙走形分别见长约20cm、6cm陈旧灶手术疤痕,双肺呼吸音粗,未闻及干湿啰音。腹软,无压痛及反跳痛,肝脾肋下未及,浅表淋巴结未触及肿大。考虑到女性、不吸烟、既往一代TKI治疗有效,手术距今无疾病进展(PFS)时间达54个月,2023年3月6日开始甲磺酸阿美替尼片(110mg qd)靶向治疗1月,腹痛无缓解,影像学评估SD,病灶无缩小。考虑患者腹痛明显,药物镇痛效果欠佳。2023年4月15日至2023年5月8日行PC方案化疗(培美曲塞0.8g+卡铂600mg)+恩度210mg靶向治疗*2周期。2023年5月10日至2023年6月12日行姑息性放疗:肝门区肿大淋巴结GTV 60Gy/3Gy/20F。出现III级血小板下降、III级白细胞下降,予TPO升血小板过程中患者出现心慌加重,予利尿等对症处理后症状缓解。放疗后患者上腹痛疼痛明显缓解,新增间断小腹疼痛。2023年7月10日行临床试验用药BL-B01D1第一周期给药:2.5mg/kg剂量组 Q3W D1/D8 ,出现III级血小板下降,给予TPO用药2周,因血小板AE持续,D8天治疗延期。考虑患者使用TPO疗效欠佳,且既往出现心慌不适,且TPO为针剂,需反复返院给药,且临床试验患者管理要求细致,于2023年8月1日行第一周期第8天减量给药:2.0mg/kg,同时给予海曲泊帕口服(5mg qd)二级预防,出现血小板I级下降(表2),按计划完成C2~C9周期用药,末次治疗时间为2024年2月2日。2周期、4周期、6周期用药后疗效评价PR(图2A、2B、2C),CEA显著下降(表1)。1周期治疗后患者小腹疼痛完全缓解。
检查
2017年8月29日 胸部CT平扫提示右肺上叶前段结节影(2.1×1.6×2.1cm)。
2017年8月23日 协和医院行右肺上叶切除术,术后病理提示:浸润性肺腺癌(肿瘤大小约2.5cm×2cm),非粘液-粘液混合性,粘液型癌占10%,腺泡状约占45%,乳头状约占40%,实体状约占5%),癌组织未侵犯肺被膜,脉管癌栓(-),神经侵犯(-),淋巴结(-),R0切除。
2017年9月组织肺癌相关基因检测:EGFR 21exon L858R突变,无伴随突变。
2023年2月27日 PET-CT:1、右肺术后改变,未见肿瘤残留及复发征象;2、右肺门(SUVmax 7.7)、心底后方下腔静脉旁(26.2mm×24.1mm,SUVmax 10.4)、肝门区、腹膜后、双侧髂血管旁多发肿大淋巴结(较大者直径22.5mm,SUVmax 7.2),代谢增高,均考虑转移;3、L4棘突溶骨性骨质破坏,代谢增高,考虑转移瘤。
2023年3月3日 胸腹CT平扫+增强:1.右肺术后改变;2.胸主动脉右旁、肝门区、腹膜后多发增大淋巴结。
2023年3月7日腹腔超声造影:腹腔淋巴结肿大并异型(上腹部脐上腹主动脉内侧下腔静脉前方可见一大小约1.6cm×1.0cm肿大的淋巴结回声,左侧髂血管旁可见一大小约1.5cm×1.3cm淋巴结回声,考虑转移性)。
2023年3月7日 行超声引导下左侧髂窝淋巴结穿刺活检,病理结果回报:穿刺标本1.(腹腔淋巴结)腺癌,结合免疫组化及病史,符合肺腺癌来源。2.免疫组化结果显示:CK7(+),TTF-1(+),Napsin A(+),CK20(-),Ki-67(+,约60%)。
2023年4月28日头颅+颈椎MRI平扫:1.双侧额叶皮层下缺血灶,双侧筛窦炎;2.胼胝体部分缺如,请结合临床;3、颈椎退行性变,颈3-7相邻椎间盘突出;4.颈3-4椎体相对缘终板骨软骨炎,颈3-4、5-6椎体相对缘及颈7椎体上缘许莫氏结节;5.所及左侧颈部皮下脂肪瘤可能。
2023年3月5日组织肺癌基因检测:EGFR 21exon p.L858R变异,T790M 位点无变异;PI3KCA 基因检测到 c.1633G>A(p.E545K)变异;ALK、BRAF、ERBB2、KRAS、MAP2K 1、MET、NRAS、ROS1 和 TP53 基因等热点区域未检测到变异。
2023年6月8日胸部增强CT:1.右肺术后改变;2.两肺多发微小结节,较前相仿;3.胸主动脉旁增大淋巴结,较前缩小(2.0cm×2.5cm)。
2023年6月28日腹盆腔增强CT:1.肝门区、腹膜后淋巴结增多、增大;2.考虑子宫肌瘤;3.左侧附件周围血管增粗、迂曲;4、所及肝左叶一过性强化结节,建议复查,肝囊肿,左肾结石。
2023年10月17日颈胸部增强CT:1.右肺术后改变;2.两肺多发微小结节,较前相仿;3.胸主动脉旁增大淋巴结,较前缩小(1.0cm×1.5cm)。
2023年10月15日腹盆腔增强CT:1.腹膜后、髂血管旁淋巴结未见肿大;2.考虑子宫肌瘤;3.左侧附件周围血管增粗、迂曲;4、肝囊肿,左肾结石。
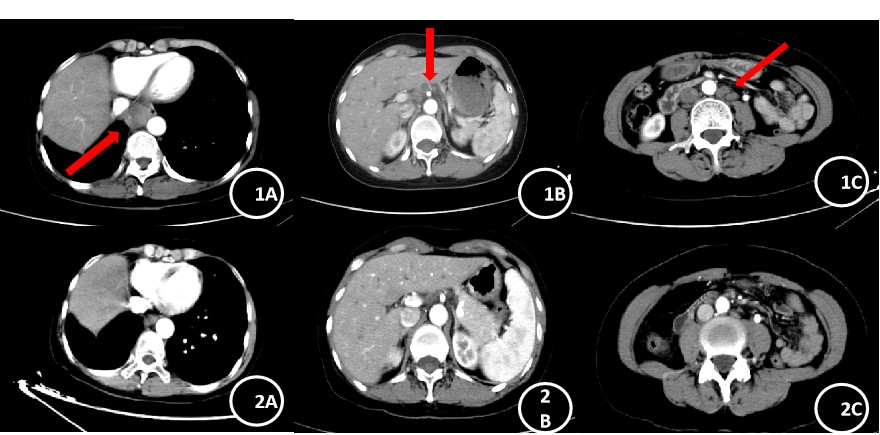 图1A、1B、1C:2023年3月3日病情进展CT图:.胸主动脉右旁、肝门区、腹膜后多发增大淋巴结;图21A、2B、2C:6周期治疗后对比图,病灶较前明显缩小。
图1A、1B、1C:2023年3月3日病情进展CT图:.胸主动脉右旁、肝门区、腹膜后多发增大淋巴结;图21A、2B、2C:6周期治疗后对比图,病灶较前明显缩小。
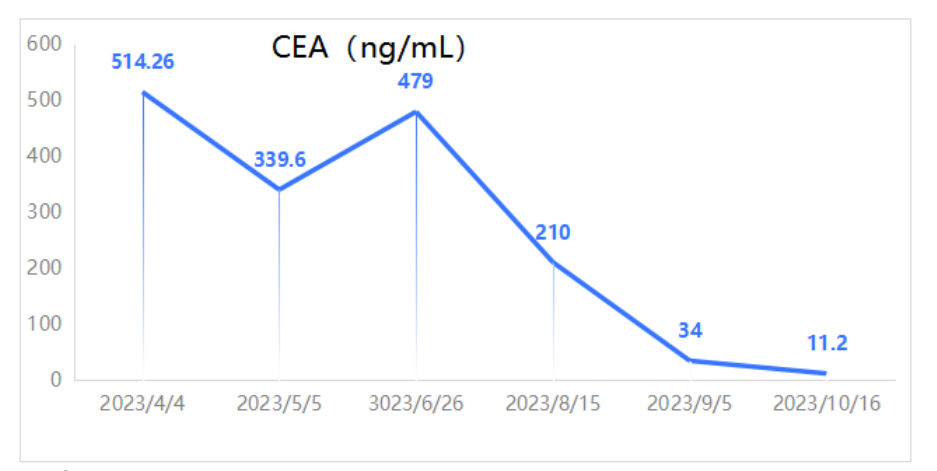 图1. 患者治疗期间癌胚抗原(CEA)变化
图1. 患者治疗期间癌胚抗原(CEA)变化
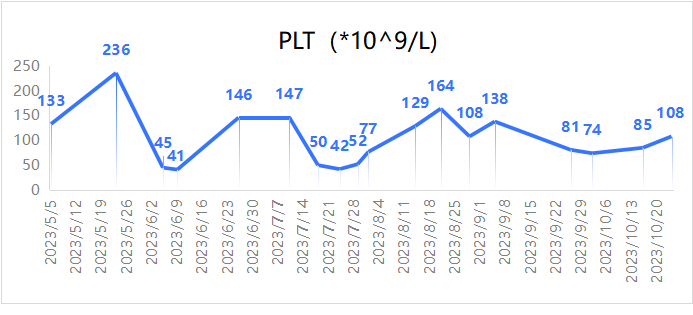 图2. 患者治疗期间血小板(PLT)变化
图2. 患者治疗期间血小板(PLT)变化
诊断与鉴别诊断
2017年8月诊断为:右肺腺癌(pT1cN0M0,IA3期)
2023年3月诊断为:右肺腺癌术后复发(rT0N1M1,rIV期,骨,腹盆腔淋巴结转移)
治疗
一位54岁女性患者,经历了肺腺癌驱动基因阳性的确诊后的多阶段治疗旅程。患者在肺腺癌手术5年后,病情出现进展,伴有多发淋巴结转移。在这段时间内,患者接受了包括靶向治疗、含铂化疗方案、以及参与药物临床试验在内的多种治疗方式。治疗过程中,患者遇到了I级至IV级的继发性血小板下降问题,这是一种可能由化疗或其他药物治疗引起的副作用,表现为血液中血小板数量的减少。幸运的是,通过口服海曲泊帕,血小板数量得到改善,使得抗肿瘤治疗得以顺利进行,病情得到了一定程度的控制。
患者的治疗历程详细如下:
2017年8月23日,患者接受右肺上叶切除手术,这是一种针对早期肺癌的常见手术方式,目的是移除肺部中的癌细胞。
从2017年10月至2022年4月,患者通过口服吉非替尼(250mg 每日一次)进行靶向治疗。然而,患者在2022年4月自行停药,出现I-II级腹泻。。吉非替尼是一种针对特定类型的非小细胞肺癌(NSCLC)的EGFR抑制剂,可以阻断癌细胞的生长信号。
2023年3月6日,患者开始使用甲磺酸阿美替尼片(110mg 每日一次)进行为期一个月的靶向治疗。甲磺酸阿美替尼是另一种针对特定驱动基因变异的靶向疗法。
在2023年4月15日和5月8日,患者接受了PC化疗方案(培美曲塞0.8g+卡铂600mg)加上恩度210mg,共2个疗程。这是一种包含铂类药物的化疗组合,用于治疗晚期非小细胞肺癌。
从2023年5月10日至6月12日,患者接受了针对肝门区肿大淋巴结的姑息性放疗,总剂量为60Gy,分为20次治疗,每次3Gy。这种治疗目的是缓解症状,控制癌症的局部扩散。
从2023年7月10日至2024年2月2日,患者参与了一项名为BL-B01D1的药物临床试验,共进行了8个周期的治疗。临床试验是医学研究的一部分,用于测试新药或新治疗方法的安全性和有效性。
治疗结果、随访及转归
患者目前仍在按计划行临床试验用药中,定期复查,最佳疗效PR,截至2024-01,已使用8周期用药,耐受可。
讨论
肺癌在中国以及世界范围内高居恶性肿瘤发病率第一、第二位。据美国癌症协会统计, 2023 年预计肺癌死亡人数为 127,070,约占癌症总体死亡人数的 1/5。2022年我国恶性肿瘤新发病例为482.47万,其中肺癌106.06万,2022 年有870,982 人死于肺癌[2-5]。10年前肺癌总体人群中以肺鳞癌居多,与吸烟相关。随着疾病谱发生改变,肺腺癌比例逐渐上升,现在占比最高。随着医学进步,非小细胞肺癌已进入驱动基因治疗时代,其中表皮生长因子受体(EGFR)突变是EGFR TKIs(酪氨酸激酶抑制剂)治疗的生物标志物,主要发生在肺腺癌人群中,尤其是亚裔、不吸烟女性患者,肺腺癌行肺癌基因检测已成为诊疗规范 [ 6-8]。
本例患者同样为不吸烟女性患者,首诊是为早期肺腺癌,EGFR 21号外显子经典突变,采取一代TKI辅助治疗。复发后根据临床诊疗标准,再次取转移灶活织活检,证实为肺腺癌转移,二次基因检测仍提示EGFR 21号外显子经典突变,伴随磷脂酰肌醇激酶-3(PI3KCA)突变。 PI3KCA在非小细胞肺癌发展中起重要的作用,可使AKT磷酸化而激活下游通路,促进肿瘤细胞存活和扩增。PIK3CA p.E545K突变被认为是EGFR-TKI治疗耐药产生的潜在原因之一 [9]。后续先后尝试一代TKI、三代TKI疗效欠佳也应证了这点。靶向耐药后,我们尝试了含铂双药化疗联合抗血管生成抑制剂,对控制癌痛也疗效欠佳,故后续选择了姑息性放疗、参加抗体药物偶联物(antibody-drug conjugate,ADC)临床试验,病情控制理想,最佳疗效PR。
在整个病程管理过程中,患者的骨髓抑制主要表现为血小板下降,对常规药物起效慢,反应欠佳;同时合并频发室性早搏增加了升血小板药物不良反应风险。为保证临床试验用药顺利进行,缩短患者在院治疗时间,我们选择了海曲泊帕作为二级预防用药。海曲泊帕乙醇胺片是我国自主研发的新一代口服、小分子、非肽类血小板生成素受体激动剂(TPO-RA),用于治疗既往对糖皮质激素、免疫球蛋白等治疗反应不佳的慢性原发性免疫性血小板减少症(ITP)成年患者以及对免疫抑制治疗(IST)反应不佳的重型再生障碍性贫血(SAA)成年患者,效果显著,其在肿瘤治疗所致血小板减少症(CTIT)、非重型再生障碍性贫血(NSAA)、移植后血小板减少等其他血小板减少症领域的相关研究正在进行中 [10-13]。TPO-RA靶向作用于巨核细胞前体或巨核细胞上TPO受体的跨膜域,刺激下游JAK/STAT、AKT、ERK等信号通路的转导,诱导其增殖和分化以增加血小板的产生。有研究显示TPO-RA对于CTIT也有治疗作用 [14-15]。虽然该类药物尚未被获批CIT为适应证,但鉴于CTIT治疗的困难及出血风险的严重性,在评估CTIT患者的病情及治疗情况后,TPO-RA也是一种可考虑的选择,2024版CSCO肿瘤治疗所致血小板减少症诊疗指南将海曲泊帕纳入Ⅱ级推荐 [16]。海曲泊帕整体安全性良好。汇总了3项ITP和1项SAA的共526例患者的临床研究数据显示,所有级别的不良反应发生率为52.3%,且大多数为轻中度,重度不良反应发生率为1.3%。常见不良反应(发生率≥3%)按照发生率从高到低依次为丙氨酸氨基转移酶(ALT)升高、天冬氨酸氨基转移酶(AST)升高、PlT升高、乳酸脱氢酶升高、胆红素升高、γ-谷氨酰转移酶升高、头痛和碱性磷酸酶升高。本患者在药物使用过程中未观察到海曲泊帕相关药物不良反应。海曲泊帕个体化治疗在肿瘤治疗中的价值展望在于其为患者提供了一个更为精准和便捷的治疗选择。作为新一代口服、小分子、非肽类血小板生成素受体激动剂(TPO-RA),海曲泊帕在改善肿瘤治疗所致血小板减少症(CTIT)方面显示出显著的疗效和良好的安全性。
回顾整个治疗过程展示了现代医学在对抗晚期肺癌方面的多元化治疗策略,包括手术、靶向治疗、化疗、放疗以及参与新药临床试验等,体现了个体化治疗计划的重要性。此外,治疗中对血小板下降的管理也是优化治疗效果、提高患者生活质量的关键因素。这位患者的案例强调了在复杂疾病治疗过程中,如何通过精准医疗和综合治疗策略来实现病情控制与副作用管理的平衡。继发性血小板下降是化疗和靶向治疗常见的副作用之一,它可能导致出血倾向增加,从而对患者的治疗计划和生活质量产生重大影响。通过及时调整治疗方案,使用如海曲泊帕这类能够改善血小板计数的药物,医疗团队能够有效应对这一挑战,确保患者能继续接受必要的抗肿瘤治疗。循证医学时代,制定诊疗指南得有据可循,但邓小平同志也说过,黑猫白猫,能抓到耗子就是好猫。基于循证、敢于尝试、细心管理,让患者活得久、活得好是我们共同的奋斗目标。
[1] 中华医学会肿瘤学分会,中华医学会杂志社. 中华医学会肺癌临床诊疗指南(2022版). 中华肿瘤杂志,2022,44(06):457-490. DOI:10.3760/cma.j.cn112152-20220413-00255
[2] Han BF,Zheng RS ,Zeng HM, et al. Cancer incidence and mortality in China, 2022.Journal of the National Cancer Center. Available online 2 February 2024
[3] Global Burden of Disease Cancer C, Kocarnik J M, Compton K, et al. Cancer Incidence, Mortality, Years of Life Lost, Years Lived With Disability, and Disability-Adjusted Life Years for 29 Cancer Groups From 2010 to 2019: A Systematic Analysis for the Global Burden of Disease Study 2019[J]. JAMA Oncol, 2022, 8(3): 420-444.
[4] Siegel R L, Miller K D, Wagle N S, et al. Cancer statistics, 2023[J]. CA Cancer J Clin, 2023, 73(1): 17-48.
[5] Xia C, Dong X, Li H, et al. Cancer statistics in China and United States, 2022: profiles, trends, and determinants[J]. Chin Med J (Engl), 2022, 135(5): 584-590.
[6] Wang L , Dong F , Su J ,et al. Resistance to both chemotherapy and EGFR-TKI in small cell lung cancer with EGFR 19-Del mutation: a case report[J]. Front Oncol, 2020,10:1048.
[7] Li T, Kung HJ, Mack PC, Gandara DR. Genotyping and genomic profiling of non-small-cell lung cancer: implications for current and future therapies. J Clin Oncol. 2013;31(8):1039-1049.
[8] Alice T. Shaw, Luc Friboulet,Ignaty Leshchiner, et al.Resensitization to Crizotinib by the Lorlatinib ALK Resistance Mutation L1198F. New England Journal of Medicine. No1. Vol.374: 54-61. 2016
[9] Giorgia Guaitoli,Francesco Facchinetti,Juan David Flórez-Arango et al. Abstract 3418: Alterations in PIK3CA/PTEN as resistance mechanisms in lung cancer patients progressing on first-line next generation EGFR/ALK tyrosine kinase inhibitors.April 2023 Cancer Research 83(7_Supplement):3418-3418
[10] Guiling Li,Ai Huang,Qin Yang, et al. Real-World Evidence of Hetrombopag for Cancer Therapy-Induced Thrombocytopenia Among Patients with Gynecologic Malignancies.Blood (2023) 142 (Supplement 1): 5432.
[11] 中国临床肿瘤学会(CSCO) 抗肿瘤药物治疗安全管理专家委员会. 海曲泊帕临床应用指导原则.白血病·淋巴瘤, 2022, 31 (10): 577-582.
[12] GHANIMA W, COOPER N, RODEGHIERO F, et al. Thrombopoietin receptor agonists: Ten years later. Haemato-logica, 2019, 104 (6): 1112-1123.
[13] PENG G, HE G, CHANG H, et al. A multicenter phase IIs tudy on the efficacy and safety of hetrombopag in patients with severe aplastic anemia refractory to immunosuppressive therapy. Ther Adv Hematol, 2022, 13: 20406207221085197.
[14] ASH 2022. Poster 3772. Combination of Thrombopoietin Receptor Agonist and Recombinant Human Thrombopoietin for Treating Cancer Therapy Induced Thrombopenia.
[15] Jun Ma, et al. 2023 European Congress of Internal Medicine, Abstract 2360.
[16] 中国临床肿瘤学会指南工作委员会. 中国临床肿瘤学会(CSCO)肿瘤治疗所致血小板减少症指南2023[M].北京:人民卫生出版社,2023.
排版编辑:肿瘤资讯-Olivia











 苏公网安备32059002004080号
苏公网安备32059002004080号


