病史摘要:患者为一名84岁女性,因持续一个月的胸闷、心悸和活动后气促于2023年4月13日入院。患者有肺结核病史(已治愈),以及左下肢静脉曲张、类风湿关节炎、青光眼和白内障的既往病史。
症状体征:入院时,东部肿瘤协作组评分(ECOG Performance Status)为1分,营养风险评分(Nutritional Risk Screening, NRS)为0分。患者右眼失明,全身浅表淋巴结未扪及明显肿大。双下肺呼吸音弱,可闻及少量啰音。心腹查体未见明显异常。
诊断方法:通过右侧胸膜活检及免疫组化染色诊断为上皮型恶性间皮瘤(MPM)。免疫组化染色结果显示CR、WT-1、CK等阳性,支持MPM的诊断。TNM分期为cT4N2M0,IV期。
治疗方法:患者接受了包含培美曲塞、顺铂和贝伐珠单抗的减量化疗方案。在治疗过程中出现了2级肿瘤治疗相关血小板减少症(cancer treatment-induced thrombocytopenia,CTIT)。使用海曲泊帕乙醇胺片进行治疗后,有效缓解了骨髓抑制,保证了化疗的连续性。
临床转归:经过4个周期的化疗,患者的血小板计数得以恢复,未再出现CTIT。全程化疗结束后,患者血象恢复正常,维持免疫药物治疗,病情稳定。
适合阅读人群:肿瘤内科;胸外科;老年科
关键词:恶性胸膜间皮瘤;高龄;海曲泊帕乙醇胺;化疗所致血小板减少症
前言
本文旨在通过详细分析一例恶性胸膜间皮瘤(MPM)患者的治疗过程,探讨在复杂临床情境下如何有效地应对挑战,并探讨新兴治疗方法的潜在价值。恶性胸膜间皮瘤(malignant pleural mesothelioma, MPM)原发于胸膜表面的浆膜细胞,是一类相对罕见且恶性程度高的肿瘤。世界卫生组织(WHO)发布的数据显示,2020年全球 MPM新发病例数占全球新发恶性肿瘤的0.2%,死亡病例数占全球恶性肿瘤死亡病例数的0.3%[1]。MPM的隐匿起病和多样化的组织学类型增加了临床诊断的难度和误诊率。晚期MPM预后差,中位生存时间一般不超过15个月。对于不可手术切除的MPM患者,培美曲塞联合铂类双药化疗是传统的标准一线治疗,该方案已被证明具有上皮型MPM的效果最佳[2]。在这种一线双药中加入贝伐珠单抗,患者总生存期增加2.7个月[3],现在已经被推荐一线联合治疗。近年来免疫治疗在MPM中应用获得显著发展,CheckMate-743研究证实[4],无论MPM组织学分型以及PD-L1表达水平如何,一线双免疫联合方案相较化疗患者生存获益显著。老年肿瘤患者由于体质弱和多种基础疾病(如心血管疾病、糖尿病等)的共存,面临更高的营养风险。国际癌症与衰老研究组证实年龄≥72岁的肿瘤患者,化疗所带来的不良风险明显增加[5]。老年肿瘤患者化疗间歇期延长,化疗被迫中止,与骨髓抑制、感染性疾病(肺部感染多见)、胃肠道反应、基础疾病控制不佳等有关[6]。通过本文病例的详细报道,展示了海曲泊帕乙醇胺片在治疗CTIT和进行二级预防中的卓越表现,为临床实践提供了有益的参考。
临床资料
一般资料
患者,女性,84岁,2023年4月13日因持续一个月的胸闷、心悸和活动后气促入院。这些症状开始于一个月前,无明显诱因,伴有头晕和全身乏力。初始在当地医院就诊,检查结果显示抗结核分枝杆菌抗体阳性,提示可能的肺结核感染。此外,检查还发现双侧胸腔积液和两肺炎症,其中部分为慢性炎症及纤维增殖灶。为了进一步诊断,患者随后转诊至当地传染病专科医院。在后续检查中,CA19-9(癌胚抗原19-9)和CA125(糖类抗原125)的水平分别为57.96 U/mL和101.42 U/mL。同时,结核菌素皮肤试验(PPD Test)结果为阴性。胸水常规检查显示有核细胞数为3250×106/L。胸水生化分析显示乳酸脱氢酶(LDH)为548 U/L,腺苷脱氨酶(ADA)为12 U/L,蛋白定量为26.8 g/L,葡萄糖为4.47 mmol/L,氯化物为108 mmol/L。胸水结核抗体呈弱阳性反应。右侧胸膜活检病理提示为上皮型间皮瘤。因此,为了进一步的诊治,患者来到我们医院就诊。患者有肺结核病史,但已治愈。此外,还有左下肢静脉曲张、类风湿关节炎、青光眼和白内障的病史。入院查体时,ECOG评分为1分,营养风险评分( NRS)为0分。右眼失明,全身浅表淋巴结无明显肿大,双下肺呼吸音弱,可闻及少量啰音。心腹查体未见明显异常。
检查
2023年4月14日血常规:白细胞计数4.41×109/L,红细胞计数3.99×1012/L,血红蛋白100 g/L,血小板(PLT)计数241×109/L。血生化示:肌酐94μmol/L,尿素9.74mmol/L,乳酸脱氢酶 248U/L,肝功能、心肌酶、电解质正常,凝血功能正常,心电图正常。
2023年4月17日胸部增强CT:两侧胸膜广泛性不均匀增厚,呈结节状、团块状向肺叶内突起,增强扫描不均匀轻度强化,右肺中叶体积减小、密度增高(图1)。
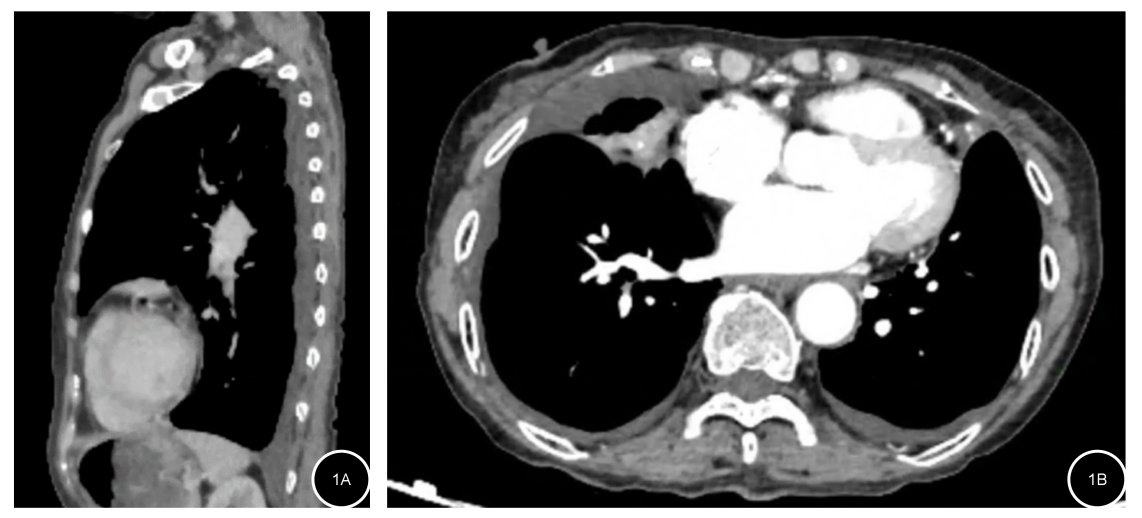 图1. 基线胸部增强CT 1A:矢状面;1B 横断面
图1. 基线胸部增强CT 1A:矢状面;1B 横断面
2023年4月4日病理会诊诊断:恶性间皮瘤,上皮型。免疫组化染色示:CR+、WT-1+、CK+、CK7+、CK5/6+、CK18+、Ki-67 20%、TTF-1(-)、Napsin-A(-)、CgA-、Syn-、CD56-、LCA-(图2)。
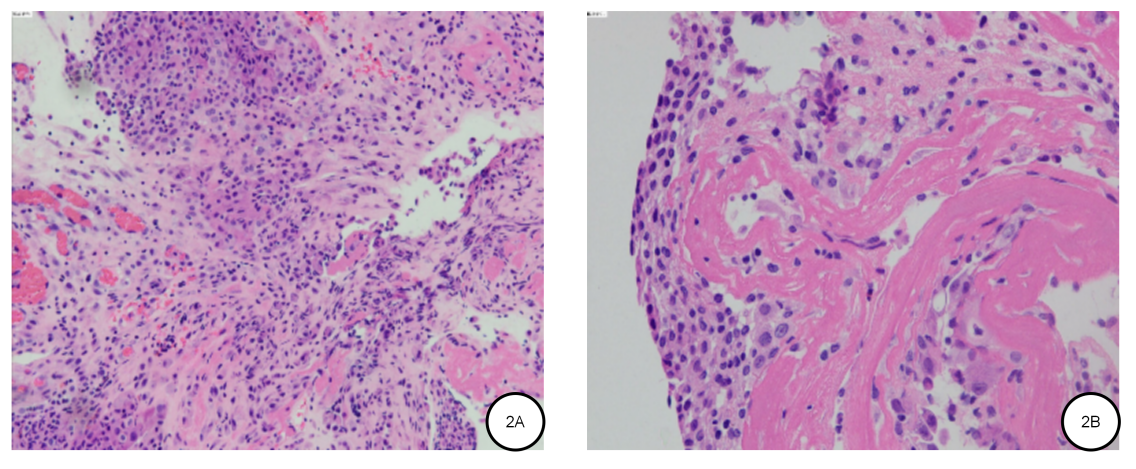 图2. 病理检查结果 见胸膜组织结构 2A:HE×100;2B:HE×400
图2. 病理检查结果 见胸膜组织结构 2A:HE×100;2B:HE×400
诊断与鉴别诊断
患者,84岁的老年女性,因胸闷、心悸和活动后气促入院。免疫组化染色结果显示癌胚抗原(Cytokeratin, CK)、Wilms肿瘤基因1(WT-1)和钙黏蛋白(Calretinin, CR)阳性,这些都是MPM的特征性标志。甲状腺转录因子1(Thyroid Transcription Factor-1, TTF-1)和Napsin-A的阴性反应,有助于排除肺腺癌的可能性。此外,Ki-67标记指数为20%,表明肿瘤细胞具有中等程度的增殖活性,这在MPM中可能预示着较积极的疾病进展和较差的预后。
患者的TNM分期为cT4N2M0,即IV期,表明肿瘤在胸膜内广泛扩散,但没有远处转移。此阶段的MPM通常需要综合治疗策略,而不是单纯的手术切除。在鉴别诊断中,还需考虑与肺腺癌以及肺鳞状细胞癌或其他胸腔内恶性肿瘤的鉴别。在本病例中,其他免疫组化标记如CK7、CK5/6、CK18、CgA(Chromogranin A)、Syn(Synaptophysin)、CD56和LCA(Leukocyte Common Antigen)的阴性结果有助于排除这些疾病的可能性。
治疗
2023年3月外院行右侧胸膜活检,病理提示为间皮瘤(上皮型)。2023年4月4日我院病理会诊诊断恶性间皮瘤,上皮型。分别于2023年4月19日、5月14日、6月10日、7月12日行4个周期“培美曲塞+顺铂+贝伐珠单抗”减量方案治疗(具体方案:培美曲塞0.5g D1+顺铂40mg D1-2+贝伐珠单抗400mg D1)。于2023年6月9日2个治疗疗程后复查增强CT,病情稳定(SD),两侧胸膜增厚程度较前减轻,两侧胸腔积液较前吸收减少,前胸壁皮下软组织病灶较前缩小,两肺各叶未见肺不张。
2023年6月10日行第3周期“培美曲塞+顺铂+贝伐珠单抗”减量方案治疗,治疗后第7天,2023年6月17日复查血常规提示PLT 74×109/L,出现2级CTIT,予口服海曲泊帕乙醇胺片7.5mg qd治疗,连服5天,无不良反应。2023年6月23日复查血常规提示PLT 182×109/L,血小板恢复正常。
2023年7月12日如期进行第4周期“培美曲塞+顺铂+贝伐珠单抗”方案治疗。考虑患者高龄,骨髓造血功能差,为避免再次出现CTIT,进行CTIT二级预防。2023年7月13日-2023年7月17日预防性给予海曲泊帕乙醇胺片7.5mg qd治疗,连续服用5天,无不良反应。2023年7月19日复查血常规提示PLT 167×109/L,随后治疗期间未出现CTIT。(如图3)
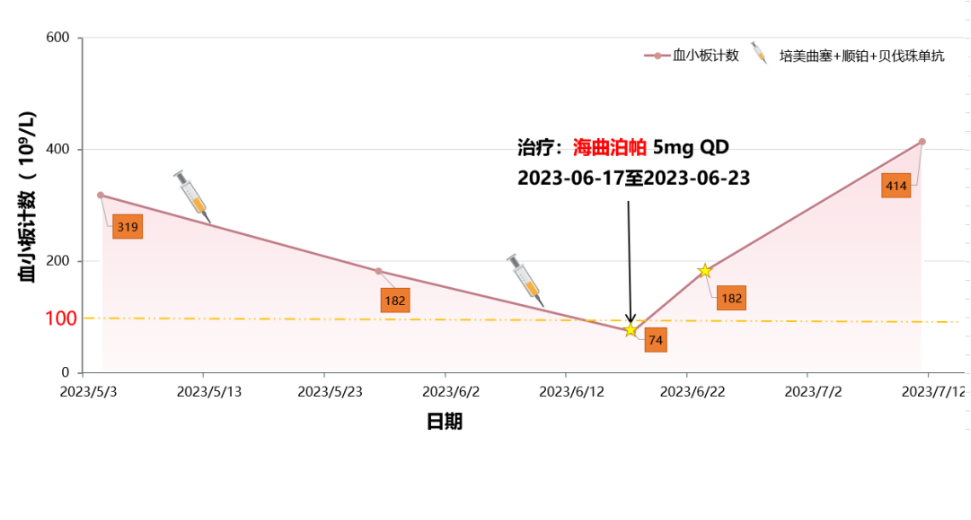 图3. 患者治疗期间血小板变化情况
图3. 患者治疗期间血小板变化情况
治疗结果、随访及转归
患者共行4周期“培美曲塞+顺铂+贝伐珠单抗”减量方案一线治疗,化疗期间反复出现血小板减少,接受海曲泊帕乙醇胺片治疗后,骨髓抑制得到缓解。患者对药物耐受性良好,治疗期间未出现严重头晕、头痛、肝肾损害及血栓形成等不良反应。第4周期抗肿瘤治疗后予海曲泊帕乙醇胺片预防治疗,血小板减少症无再发生。目前全程化疗结束,血象恢复正常,免疫药物维持治疗,病情稳定。
讨论
恶性胸膜间皮瘤(malignant pleural mesothelioma, MPM)原发于胸膜表面的浆膜细胞,是一类相对罕见且恶性程度高的肿瘤。世界卫生组织(WHO)发布的数据显示,2020年全球 MPM新发病例数占全球新发恶性肿瘤的0.2%,死亡病例数占全球恶性肿瘤死亡病例数的0.3%[1]。MPM的隐匿起病和多样化的组织学类型增加了临床诊断的难度和误诊率。晚期MPM预后差,中位生存时间一般不超过15个月。对于不可手术切除的MPM患者,培美曲塞联合铂类双药化疗是传统的标准一线治疗,该方案已被证明具有上皮型MPM的效果最佳[2]。在这种一线双药中加入贝伐珠单抗,患者总生存期增加2.7个月[3],现在已经被推荐一线联合治疗。
近年来免疫治疗在MPM中应用获得显著发展,CheckMate-743研究证实[4],无论MPM组织学分型以及PD-L1表达水平如何,一线双免疫联合方案相较化疗患者生存获益显著。老年肿瘤患者由于体质弱和多种基础疾病(如心血管疾病、糖尿病等)的共存,面临更高的营养风险。国际癌症与衰老研究组证实年龄≥72岁的肿瘤患者,化疗所带来的不良风险明显增加[5],特别是CTIT,指抗肿瘤治疗对骨髓产生抑制作用,导致外周血血小板计数低于100×109/L[7]。不同的化疗方案引起血小板减少症的发生率不同,其中铂类药物导致CTIT发生率可达31%[8],3~4级CTIT发生率为11%[8]。老年肿瘤患者,骨髓造血功能相对差,且基础疾病多,合并疾病负担较重,CTIT导致化疗剂量强度降低、化疗间歇期延长,甚至治疗被迫中止,从而影响抗肿瘤效果,对患者的长期生存产生不利影响。CTIT的治疗包括输注血小板和给予促血小板生长因子。过去,治疗CTIT的药物有限,主要依赖于rhTPO和rhIL-11等注射制剂。近年来,随着研究的深入,血小板生成素受体激动剂(TPO-RA)类药物显示出治疗CTIT的潜力[9]。其中,海曲泊帕乙醇胺片作为一种新型口服TPO-RA,相比之前的治疗方法,已被证明具有更好的耐受性和便利性,因此被2023年中国临床肿瘤学会(CSCO)CTIT指南推荐使用[7]。由于rhTPO、rhIL-11对升高血小板均有延迟效应,所以提前二级预防有助于稳定血小板数量。海曲泊帕乙醇胺片使用方便,患者对药物耐受性良好,为CTIT提供了新的治疗策略。
本病例报告描述了一位84岁高龄女性患者,确诊为MPM,疾病初诊时已存在多发转移。本讨论旨在深入分析治疗策略、CTIT管理以及患者预后,从而提供对类似病例的全面见解。考虑到患者的高龄和多发转移,遵循《中国恶性胸膜间皮瘤临床诊疗指南(2021版)》[10],选择了培美曲塞联合顺铂和贝伐珠单抗的一线治疗。该方案综合考虑了疗效和患者耐受性,适用于晚期MPM患者。此治疗选择强调了针对高龄患者的个体化治疗计划的重要性,同时考虑到了患者可能的耐药性和对治疗的耐受度。
在抗肿瘤治疗期间,患者出现了2级的癌症治疗相关血小板减少症(CTIT),这是由于铂类药物和贝伐珠单抗联用增加的血小板破坏。铂类药物导致CTIT的主要机制是通过增加血小板凋亡,即“破坏增多”[11]。而贝伐珠单抗的CTIT发生机制可能为免疫介导的外周血小板破坏[12]。此外,患者高龄、骨髓造血功能较差,以及存在的多重危险因素均增加了CTIT的风险。
海曲泊帕乙醇胺片在本病例中显示了良好的防治效果,有效避免了严重CTIT的发生,保障了化疗的连续性。及时使用海曲泊帕进行治疗,使得患者的血小板计数迅速恢复正常,确保了第4周期化疗的如期进行。既往研究显示,使用海曲泊帕乙醇胺片进行二级预防后,能帮助绝大多数因血小板减少导致化疗延迟的患者顺利、足量完成后续化疗[13]。在2023年版《CSCO肿瘤治疗所致血小板减少症诊疗指南》中,海曲泊帕作为唯一一个TPO-RA药物获得CTIT治疗和二级预防的Ⅱ级推荐[7]。
纵观本病例治疗历程,采用海曲泊帕乙醇胺片的及时、有效的升板治疗和二级预防对于抗肿瘤治疗的足剂量、足疗程、按时、顺利进行发挥了重要作用。对应于CTIT的危害,海曲泊帕防治所产生的积极的医学和社会价值也是多维度、“连锁性”的。海曲泊帕应用可以降低医疗成本,减少住院治疗的需求,从而减轻医疗经济负担;其也是一种更为有效的自我管理方式,有助于改善患者的治疗效果及生活质量。这些影响是相互关联的,一个方面的变化可能会引发连锁反应,影响其他方面。其不仅使患者未因CTIT显著影响生存和生活质量,也未发生出血等严重并发症而带来沉重的医疗和经济负担。这一创新治疗策略的应用,展示了新药改变临床实践的力量。希望随着新版指南的推广和落地,海曲泊帕为更多CTIT患者带来更多的益处。
[1] Sung H,Ferlay J,Rebecca L,et al. Global cancer statistics 2020:GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries [J]. CA Cancer J Clin,2021,71(3):209-249.
[2] Vogelzang NJ, Rusthoven JJ, Symanowski J, et al. Phase III study of pemetrexed in combination with cisplatin versus cisplatin alone in patients with malignant pleural mesothelioma[J]. J Clin Oncol, 2003, 21( 14):2636-2644.
[3] Zalcman G, Mazieres J, Margery J, et al. Bevacizumab for newly diagnosed pleural mesothelioma in the Mesothelioma Avastin Cisplatin Pemetrexed Study (MAPS): a randomised, controlled, open-label, phase 3 trial[J]. Lancet(London, England), 2016, 387( 10026):1405- 1414.
[4] Baas P,Scherpereel A,Nowak AK,et al. First-line nivolumab plus ipilimumab in unresectable malignant pleural mesothelioma (CheckMate-743): a multicentre, randomised,open-label,phase 3 trial[J]. Lancet,2021,397 (10272):375-386.
[5] Hurria A,Togawa K,Mohile SG,et al. Predicting chemo-therapy toxicity in older adults with cancer:a prospective multicenter study[J].J Clin Oncol,2011, 29(25):3457-65.
[6] 黄毕林,丁西平,殷实,等. 老年恶性肿瘤患者化疗中止原因[J]. 中国老年学杂志, 2017,37(24):6105-6106.
[7] 中国临床肿瘤学会(CSCO)肿瘤治疗所致血小板减少症诊疗指南2023.
[8] Wu Y,Aravind S,Ranganathan G,et al. Anemia and thrombocytopenia in patients undergoing chemotherapy for solid tumors: a descriptive study of a large outpatient oncology practice database, 2000-2007[J]. Clinical Therapeutics, 2009, 31 Pt 2:2416-2432.
[9] Song AB, Al-Samkari H. Emerging data on thrombopoietin receptor agonists for management of chemotherapy-induced thrombocytopenia[J]. Expert Rev Hematol. 2023, 16(5):365-375.
[10]中国医师协会肿瘤多学科诊疗专业委员会. 中华肿瘤杂志, 2021, 43(4):383-394.
[11] Marini I, Uzun G, Jamal K, et al. Treatment of drug-induced immune thrombocytopenias[J]. Haematologica, 2022, 107(6):1264-1277.
[12] Li T, Witteman D T, Weber E D, et al. Severe immune-mediated thrombocytopenia after intravitreal bevacizumab injection[J]. Retinal Cases and Brief Reports, 2020, 14(3): 251-254.
[13] 2023 ECIM abstract 2360.
排版编辑:肿瘤资讯-Olivia











 苏公网安备32059002004080号
苏公网安备32059002004080号


