胆道恶性肿瘤(BTC)因其复杂的生物学特性、高度异质性及侵袭性,一直是临床诊疗中的一大难题。传统治疗手段的疗效有限,患者总体预后不佳。随着精准医学的快速发展,BTC的治疗格局也在发生变化。近期,多项BTC的前沿研究成果公布,内容涵盖基因组异质性的意义、精准靶点检测、真实世界免疫治疗的启示以及基于基因组学的探索等,为BTC的临床诊疗提供了新的思路和方向。在此背景下,特邀中山大学肿瘤防治中心张东生教授,对BTC的最新研究进展进行深入解读,以期为临床实践提供科学依据,并进一步推动BTC精准治疗的发展。
专家简介
主任医师,博士研究生导师
内科五区区长,I期病房II区区长(兼)
中山大学肿瘤防治中心中西医结合研究中心副主任
中山大学医学博士(M.D., Ph.D.)
香港中文大学Research fellow
美国Mayo Clinic胃肠及癌症中心访问学者
中国初级卫生保健基金会消化肿瘤专委会主任委员
中国抗癌协会肿瘤药物临床研究专业委员会常委
广东省临床医学会免疫治疗专委会副主任委员
广州市支持与康复专业委员会副主任委员
广东省抗癌协会生物治疗专业委员会常委
广东省医学会临床肿瘤专业委员会常委
中国抗癌协会肿瘤化疗专业委员会委员
广东省抗癌协会靶向与个体化专业委员会委员
广东省临床医学会消化肿瘤协作组 组长
基因组异质性的意义
解剖学和地理学视角下的思考
Genomic Profiling of Biliary Tract Cancers: Comprehensive Assessment of Anatomic and Geographic Heterogeneity, Co-Alterations and Outcomes1
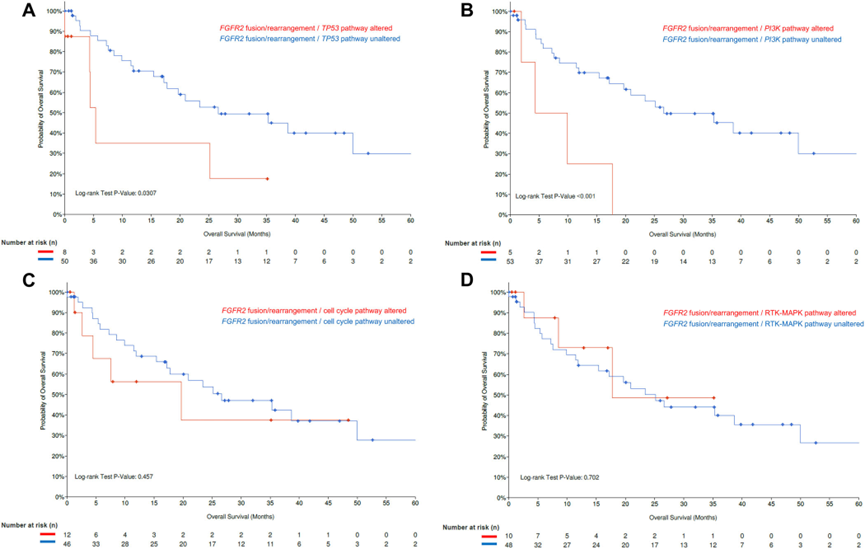
BTCs是一类具有显著异质性的恶性肿瘤。本研究聚焦于胆道癌的基因组特征,通过分析来自AACR GENIE注册表及其他数据集的基因组数据,全面评估了其解剖学和地理学异质性、基因组共改变及其对预后的影响。
研究发现,不同亚型胆道癌的基因改变存在差异,如IDH1和FGFR2基因改变多见于肝内胆管癌,而胆囊癌中TP53、ERBB2/HER2和SMAD4突变更频繁,肝外胆管癌则常携带KRAS突变。不同地理区域的胆道癌患者基因组特征也有所不同,西方人群肝内胆管癌中IDH1和FGFR2改变更常见,而东方人群中KRAS、SMAD4和ERBB2突变更频繁。此外,基因组共改变现象在胆道癌患者中普遍存在,且与预后密切相关,如携带FGFR2融合/重排的肝内胆管癌患者中,TP53通路或PI3K通路的共改变与更差的总生存期相关。
靶向治疗的精准之路
从基因检测到临床获益
Molecular and clinical determinants of targeted therapy (TT) outcomes in biliary tract cancer (BTC): Analysis of a prospectively maintained next generation sequencing (NGS) biorepository2
在胆道癌治疗领域,靶向治疗为部分携带可靶向突变的患者带来了新的希望,但大多数患者仍面临耐药挑战。本研究通过前瞻性维护的下一代测序(NGS)生物样本库,分析了1254例BTC患者的基因组特征和临床数据,其中61.2%为肝内胆管癌,16.8%为肝外胆管癌,22.1%为胆囊癌。在MSS胆管癌中,最常见的突变基因包括TP53(36%)、CDKN2A(21%)、ARID1A(18%)、KRAS(17%)和IDH1/2(16%)。
研究发现,胆道癌患者二线接受靶向治疗相较于传统的5-FU化疗显示出显著的PFS优势。接受靶向治疗的患者中位PFS为4.2个月(IDH1/2靶向治疗)、7.4个月(FGFR2靶向治疗)和8.2个月(ERBB2靶向治疗)。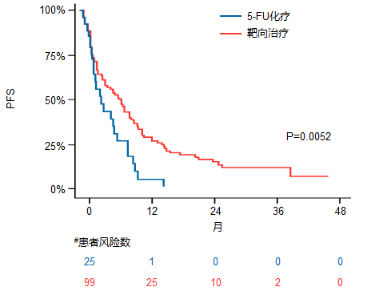
免疫治疗的探索与挑战
真实世界数据的启示
Real-world survival differences in advanced biliary tract cancer patients with ctDNA detected IDH1 mutations and FGFR2 fusions receiving first-line gemcitabine-cisplatin with and without immunotherapy3
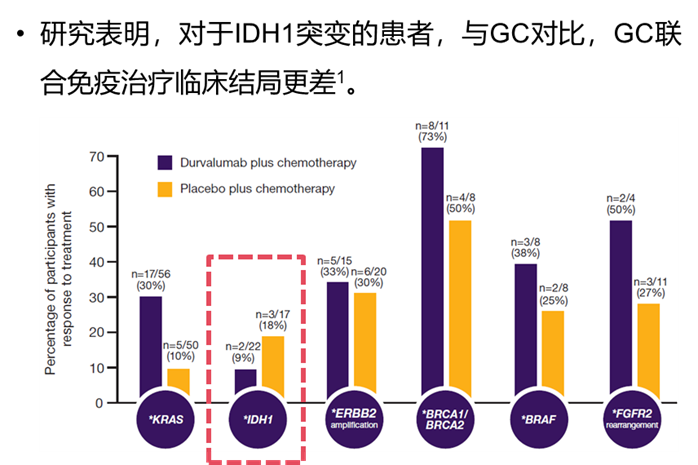
本真实世界研究旨在探讨ctDNA检测到IDH1突变(IDH1+)或FGFR2融合(FGFR2+)的mBTC患者在接受一线GC与GC+免疫检查点抑制剂(IO)治疗后的生存差异。研究数据来源于GuardantINFORM数据库中,2019年4月至2024年6月间,经ctDNA检测为IDH1+(412例)或FGFR2+(154例)的mBTC患者。
在IDH1+患者中,接受GC治疗患者的OS显著优于接受GC+IO患者(16.0个月 vs 20.0个月,p<0.001)。相似的是,在FGFR2+患者中,接受GC治疗患者的OS也显著优于接受GC+IO的患者(未达到 vs 43.0个月,p=0.005)。然而,无论在IDH1+患者还是FGFR2+患者中,接受GC±IO治疗的真实世界至后线治疗时间(TTNT)和至停药时间(TTD)均未观察到显著差异。
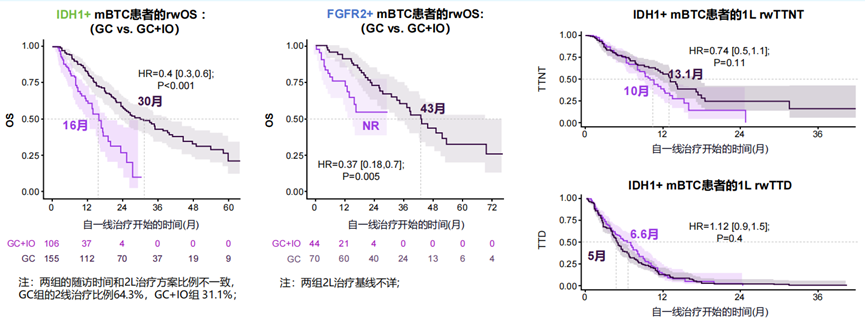
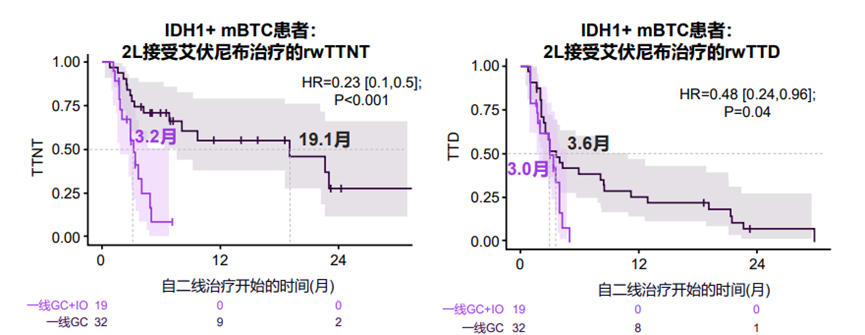
在有二线治疗记录的IDH1+患者中,艾伏尼布是最常使用的二线治疗药物,占比达到38.1%。在这些患者中,一线接受GC者的rwTTNT(19.1个月 vs 3.2个月,P<0.01)和rwTTD(3.6个月 vs 3.0个月,P=0.04)均显著优于接受GC+IO者。
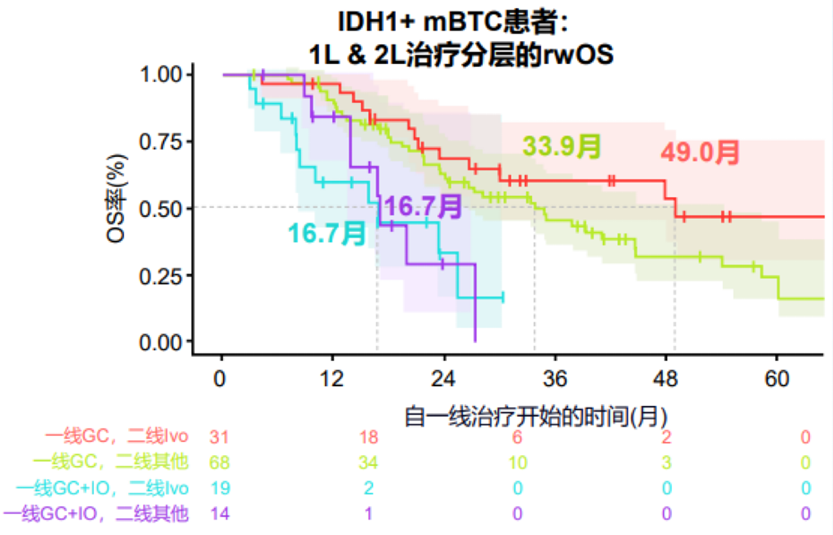
对于接受一线GC和二线艾伏尼布治疗的患者,其真实世界总生存期(rwOS)显著优于接受一线GC+IO和二线艾伏尼布治疗的患者(49.0个月 vs 16.7个月,P=0.004),也优于接受一线GC+IO和二线其他治疗的患者(33.9个月 vs 16.7个月,P=0.0021)。
免疫基因组学的未来方向
从TIME到新型疗法的开发
The Immune-Genomics of Cholangiocarcinoma: A Biological Footprint to Develop Novel Immunotherapies4
本综述聚焦于胆管癌的免疫基因组学,揭示了其分子亚型和可靶向遗传改变,如肝内胆管癌中的FGFR2重排/融合(7-15%)和IDH1突变(10-20%),以及肝外胆管癌和胆囊癌中的HER2扩增/过表达。同时,研究指出,胆管癌的肿瘤-免疫微环境(TIME)在疾病发生发展中起关键作用,其中癌症相关成纤维细胞(CAFs)通过维持免疫原性较差的微环境,与患者较差的生存预后密切相关。
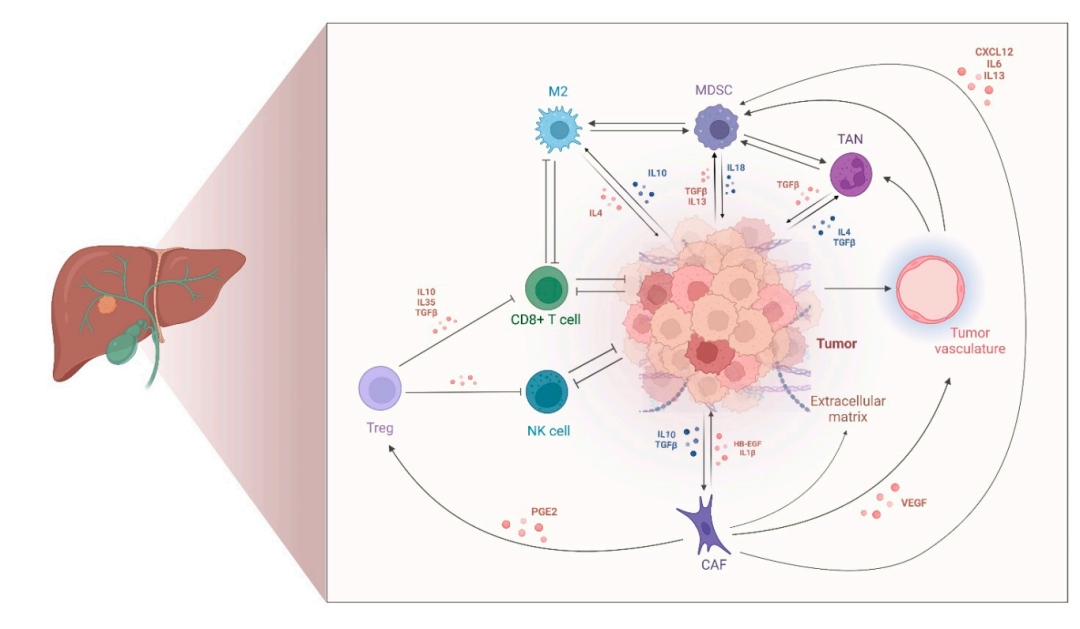
治疗方面,顺铂和吉西他滨联合免疫检查点抑制剂(ICIs)已成为晚期胆管癌的新标准治疗方案,但生存改善效果仍有限。因此,研究者正在探索针对多种免疫检查点、血管生成以及肿瘤特异性抗原的靶向治疗策略,以更有效地靶向胆管癌的TIME。此外,ICIs在晚期胆管癌的成功应用也促使研究者探索其在疾病早期阶段(如辅助治疗和新辅助治疗)的应用潜力。
1. 李家军, 白睿 & 孙备. 《英国胃肠病学会:胆管癌指南》2023版解读. 中华普通外科杂志 39, 564-568 (2024).
2. Zhang, J. et al. Reprogramming of fatty acid metabolism: a hidden force regulating the occurrence and progression of cholangiocarcinoma. Cell Death Discov 11, 72 (2025).
3. De Santis, A., Zhu, L., Tao, J., et al. Molecular subtypes of intrahepatic cholangiocarcinoma. Trends Mol Med (2025).
4. Knox, J.J. et al. A phase III randomized study of first-line NUC-1031/cisplatin vs. gemcitabine/cisplatin in advanced biliary tract cancer. J Hepatol (2025).
5. Cecchini, M. et al. Olaparib in treatment-refractory isocitrate dehydrogenase 1 (IDH1)- and IDH2-mutant cholangiocarcinoma: Safety and antitumor activity from the phase 2 National Cancer Institute 10129 trial. Cancer 131, e35755 (2025).
6. Cai, Y., Wen, W., et al. The Efficacy and Safety of Hepatic Artery Infusion Chemotherapy Combined with Lenvatinib and Programmed Death (PD)-1 Inhibitors for Unresectable Intrahepatic Cholangiocarcinoma: A Retrospective Study. Curr Oncol 32 (2025).
7. Jiang, C. et al. Comparing Immunotherapy Versus Chemotherapy Alone as Second-Line Therapy for Malignant Tumors of the Biliary Tract: A Retrospective Study. Clin Med Insights Oncol 19, 11795549251317012 (2025).
排版编辑:肿瘤资讯-展思懿











 苏公网安备32059002004080号
苏公网安备32059002004080号


