胆管癌(CCA)是起源于胆道上皮的恶性肿瘤,以隐匿起病、进展迅速、预后不良为特点。由于缺乏特异性早期诊断标志物和有效治疗方案,多数患者确诊时已处于晚期,五年生存率仅为5%~10%1。近年来,随着基础和临床转化研究的不断深入,胆管癌的分子病理机制、临床分型及治疗策略取得了一定进展。特邀西京医院张红梅教授,基于最新研究成果,探讨胆管癌的分子机制、药物治疗现状及未来发展方向,为临床实践提供参考。
专家简介
肿瘤科主任、肿瘤学教研室主任教授、博导、博士后合作导师
转化医学国家重大科技基础设施(西安)特聘研究员
中国医师协会肿瘤医师分会委员
中国临床肿瘤学会免疫治疗专委会常委
中国临床肿瘤学会胰腺癌专委会常委
陕西省抗癌协会肿瘤综合治疗专委会主委
陕西省医学会肿瘤内科分会副主委
国家卫生健康委能力建设和继续教育肿瘤学专家委员会委员
探索胆管癌的分子图谱与亚型
Reprogramming of fatty acid metabolism: a hidden force regulating the occurrence and progression of cholangiocarcinoma2
《脂肪酸代谢重编程:胆管癌发生发展的隐匿推手》综述指出,脂肪酸(FA)代谢重编程在CCA的发生和发展中发挥重要作用。随着现代生活水平提高,高脂、高蛋白、高碳水饮食日益普及,由此导致的代谢异常与肿瘤的发生和转移密切相关。
本综述深入探讨FA代谢重编程在胆管癌中的作用机制、不同类型FA的影响及潜在治疗策略。在内源性合成方面,乙酰辅酶A羧化酶(ACC)和脂肪酸合成酶(FASN)等关键酶的表达与胆管癌进展密切相关;在外源性摄取方面,CD36、脂肪酸转运蛋白(FATPs)等多种转运蛋白助力脂肪酸进入癌细胞,推进肿瘤恶性转化。脂肪酸氧化(FAO)为癌细胞提供能量支持,而脂质过氧化(LPO)则对肿瘤的恶性进程产生影响。
值得注意的是,不同类型脂肪酸对胆管癌的影响迥异。饱和脂肪酸(SFAs)中的丁酸表现出抑癌作用,而棕榈酸(PA)表现出促癌特性;单不饱和脂肪酸(MUFAs)如油酸可促进肿瘤转移;ω-3多不饱和脂肪酸(PUFAs)普遍发挥抗癌作用,而ω-6 PUFAs则多表现为促癌效应。目前,针对脂肪酸代谢重编程的胆管癌治疗策略已初显成效,如TOFA、TVB-2640等药物,可有效抑制脂肪酸合成,热量限制可减少脂肪酸摄取。但这些治疗策略仍面临挑战,尚需深入探究。
Molecular subtypes of intrahepatic cholangiocarcinoma3
胆道肿瘤可根据解剖部位分为肝内胆管癌、肝门部胆管癌和远端胆管癌。本综述指出,肝内胆管癌(iCCA)的分子分型研究取得了显著进展。肝内胆管癌可分为大胆管型(LD-iCCA)和小胆管型(SD-iCCA)两种临床亚型,这两种亚型在分子、遗传和组织病理特征方面存在显著差异,这些差异直接影响患者预后和治疗反应。
研究显示,LD-iCCA的总生存率和无复发生存率均显著低于SD-iCCA。在病因学上,大胆管型胆管癌与原发性硬化性胆管炎、肝吸虫感染相关,常表现为黏液分泌性腺癌;而小胆管型胆管癌则与慢性肝炎、非酒精性脂肪肝、代谢综合征相关,组织学上常为导管样腺癌。
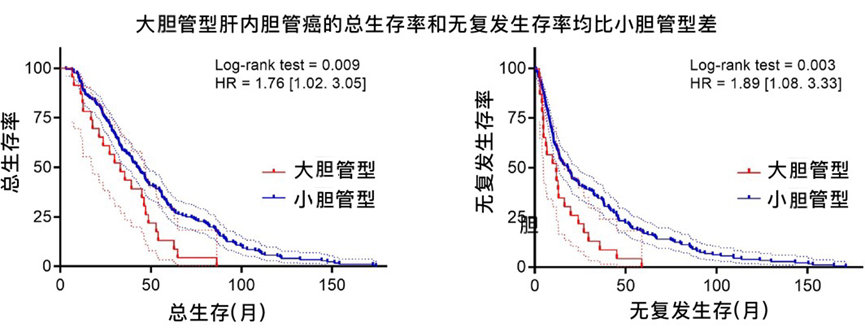 图. 大胆管型和小胆管型肝内胆管癌患者的生存曲线
图. 大胆管型和小胆管型肝内胆管癌患者的生存曲线
在分子水平上,两种亚型表现出不同的突变谱和信号通路激活模式。常见的基因突变包括IDH1/2、FGFR2融合、BAP1和PBRM1等,这些突变不仅参与肿瘤发生,还与治疗反应和预后密切相关。基于这些分子改变的靶向治疗已成为研究热点。此外,基于DNA甲基化和转录组测序的分子诊断方法在胆管癌亚型分类中显示出潜力,有望进一步指导精准医疗的临床实践。
A phase III randomized study of first-line NUC-1031/cisplatin vs. gemcitabine/cisplatin in advanced bilary tract cancer4
目前,胆管癌的治疗仍面临巨大挑战。手术切除是唯一可能治愈的方法,但多数患者诊断时已失去手术机会。对于晚期胆管癌患者,吉西他滨联合顺铂(GC方案)是目前公认的一线标准治疗方案之一,但疗效有限。
本论文报道了NuTide:121研究的最终分析结果,这是迄今为止在晚期胆道系统肿瘤一线治疗中进行的最大规模随机干预性研究之一,旨在比较NUC-1031(吉西他滨的磷酰胺形式)联合顺铂和标准GC方案的疗效。该研究纳入773例患者,基线特征平衡,中位年龄65岁,原发肿瘤类型包括肝内胆管癌(54%)、肝外胆管癌(21%)、胆囊癌(21%)和壶腹癌(5%)。
研究结果显示,尽管NUC-1031/顺铂组的客观缓解率(ORR)更高(18.7% vs. 12.4%),但中位总生存期(mOS)(9.2 vs. 12.6个月)和中位无进展生存期(mPFS)(4.9 vs. 6.4个月)均低于GC方案。安全性方面,虽然两组不良事件谱相似,但NUC-1031/顺铂组的肝胆系统不良反应发生率更高(25% vs. 11%),而GC组的血液学毒性更常见(48% vs. 65%)。该研究因无效性评估而提前终止,NUC-1031/顺铂未能成为晚期胆道恶性肿瘤的一线治疗的新标准。
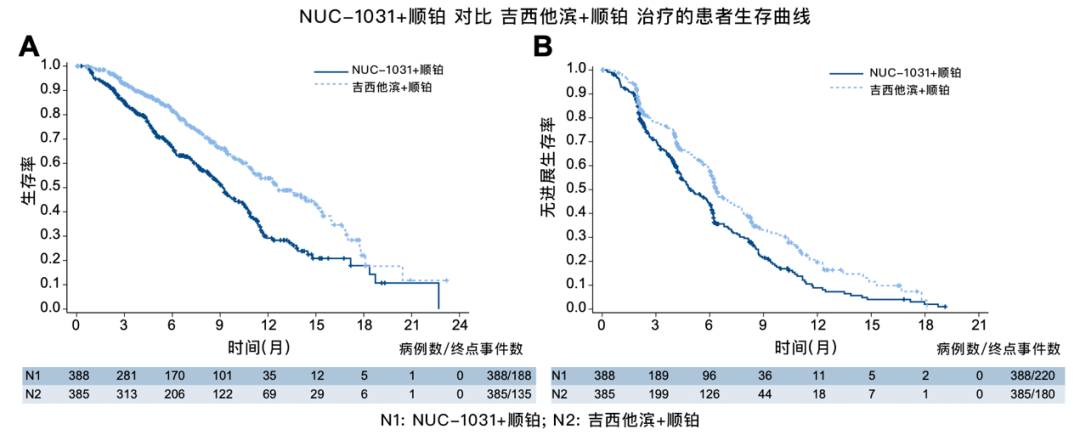 图. NUC-1031/顺铂方案与吉西他滨+顺铂方案治疗的生存率和无进展生存率
图. NUC-1031/顺铂方案与吉西他滨+顺铂方案治疗的生存率和无进展生存率
Olaparib in treatment-refractory isocitrate dehydrogenase 1 (IDH1)- and IDH2-mutant cholangiocarcinoma: Safety and antitumor activity from the phase 2 National Cancer Institute 10129 trial5
对于携带IDH1和IDH2突变的胆管癌患者,靶向治疗也面临挑战。本论文评估了PARP抑制剂奥拉帕利在难治性IDH突变胆管癌中的疗效。新形态IDH突变导致2-羟基戊二酸(2-HG)积累,这一致癌代谢物通过抑制α-酮戊二酸进而参与肿瘤演进,同时导致同源重组修复缺陷(HRD),使肿瘤对PARP抑制剂敏感。
该研究纳入30例IDH突变胆管癌患者,未观察到客观缓解,因此提前终止入组。中位PFS为2.4个月(95%CI,1.9-6.5个月),中位OS为12.9个月(95%CI,6.3个月-未达到)。值得注意的是,8例(27%)患者获得临床获益(PFS≥6个月),这部分患者基线2-HG水平显著低于未获益患者(1.4 vs. 5.9μmol/L)。总体生存方面,之前接受过IDH抑制剂治疗的患者与未接受过此类治疗的患者相比,有显著优势,但在无进展生存期方面无显著差异。
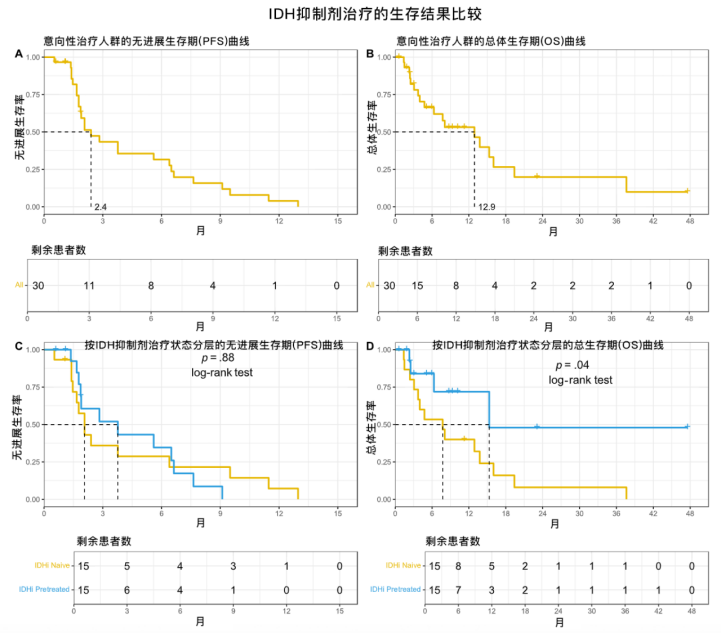 图. IDH抑制剂治疗的生存结果比较
图. IDH抑制剂治疗的生存结果比较
免疫联合治疗策略研究
The Efficacy and Safety of Hepatic Artery Infusion Chemotherapy Combined with Lenvatinib and Programmed Death (PD)-1 Inhibitors for Unresectable Intrahepatic Cholangiocarcinoma: A Retrospective Study6
随着免疫治疗和靶向治疗在肿瘤领域的广泛应用,胆管癌的治疗策略也在不断推陈出新。本研究比较了肝动脉灌注化疗(HAIC)联合仑伐替尼、PD-1抑制剂(HLP方案)与全身化疗联合相同药物(SCLP方案)在不可切除肝内胆管癌中的疗效。
该研究总计纳入53例患者,其中25例接受HLP方案,28例接受SCLP方案,两组基线特征匹配良好。结果显示,HLP方案相比SCLP方案获得了更长的中位OS(12.8 vs. 11.0个月)和中位PFS(8.8 vs. 6.4个月),其中PFS具有统计学差异(P=0.043)。HLP组的ORR显著更高(52% vs. 25%,P=0.043),疾病控制率也更高(96% vs. 78.6%,P=0.104)。亚组分析显示,无肝外转移患者从HLP方案获益更为显著,无论是OS(P=0.019)还是PFS(P=0.032)。安全性方面,HLP组3-4级不良反应少于SCLP组,表明该方案安全性更佳。
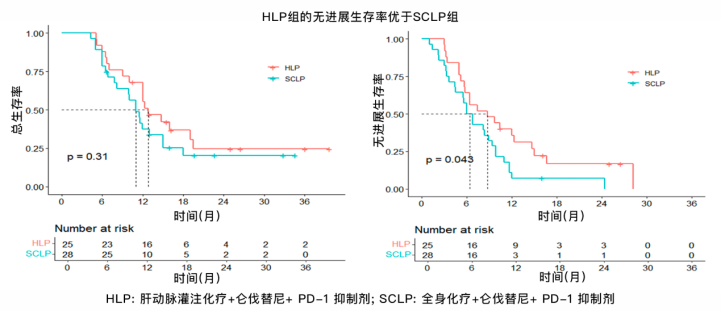 图. HLP与SCLP治疗方案的总生存率和无进展生存率曲线
图. HLP与SCLP治疗方案的总生存率和无进展生存率曲线
Comparing Immunotherapy Versus Chemotherapy Alone as Second-Line Therapy for Malignant Tumors of the Biliary Tract: A Retrospective Study7
本研究比较了免疫治疗(联合或不联合靶向治疗)联合化疗,与单纯化疗二线治疗胆道肿瘤的疗效。研究纳入126例胆道肿瘤患者,所有患者均接受标准化疗,其中57例接受免疫检查点抑制剂(联合或不联合靶向治疗),69例接受单纯化疗。
结果显示,免疫联合组相比单纯化疗组,表现出更长的PFS(4.68个月)和OS(30.26个月)(P<0.001),ORR(5.26% vs. 1.45%)和疾病控制率(54.39% vs. 33.33%)也更高。Cox分析显示,TNM分期、T分期、组织学分级、CA199水平和治疗评估分级与OS相关(P<0.05),其中组织学分级和CA199下降是独立预后因素。3-4级不良反应主要是是血红蛋白下降(29.37%),总体安全性可接受。
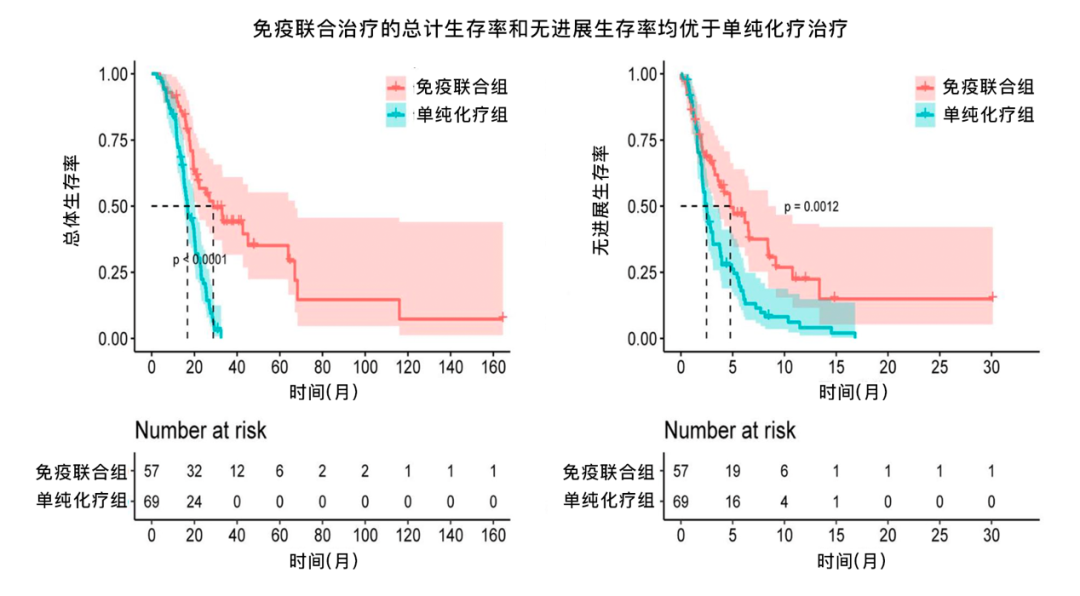 图. 免疫联合组和单纯化疗组患者的总体生存和无进展生存曲线
图. 免疫联合组和单纯化疗组患者的总体生存和无进展生存曲线
1.李家军, 白睿 & 孙备. 《英国胃肠病学会:胆管癌指南》2023版解读. 中华普通外科杂志 39, 564-568 (2024).
2. Zhang, J. et al. Reprogramming of fatty acid metabolism: a hidden force regulating the occurrence and progression of cholangiocarcinoma. Cell Death Discov 11, 72 (2025).
3. De Santis, A., Zhu, L., Tao, J., et al. Molecular subtypes of intrahepatic cholangiocarcinoma. Trends Mol Med (2025).
4. Knox, J.J. et al. A phase III randomized study of first-line NUC-1031/cisplatin vs. gemcitabine/cisplatin in advanced biliary tract cancer. J Hepatol (2025).
5. Cecchini, M. et al. Olaparib in treatment-refractory isocitrate dehydrogenase 1 (IDH1)- and IDH2-mutant cholangiocarcinoma: Safety and antitumor activity from the phase 2 National Cancer Institute 10129 trial. Cancer 131, e35755 (2025).
6. Cai, Y., Wen, W., et al. The Efficacy and Safety of Hepatic Artery Infusion Chemotherapy Combined with Lenvatinib and Programmed Death (PD)-1 Inhibitors for Unresectable Intrahepatic Cholangiocarcinoma: A Retrospective Study. Curr Oncol 32 (2025).
7. Jiang, C. et al. Comparing Immunotherapy Versus Chemotherapy Alone as Second-Line Therapy for Malignant Tumors of the Biliary Tract: A Retrospective Study. Clin Med Insights Oncol 19, 11795549251317012 (2025).
本资料的内容仅作为科学信息参考,并仅用于医疗卫生专业人士间的学术交流之目的,请勿转发或用于任何其他用途。
本资料可能会出现某些药品信息,但该药品/适应症可能尚未获得国家药品监督管理局的注册批准。医疗卫生专业人士做出的任何与治疗有关的决定应根据患者的具体情况并应参照国家药品监督管理局批准的药品说明书。对于本资料可能提到的相关诊断、治疗方法,请遵守国家卫生健康委员会以及相关政府部门批准使用的指南或规定。
责任编辑:肿瘤资讯-于晓燕
排版编辑:肿瘤资讯-Olivia
本文转自:论坛报











 苏公网安备32059002004080号
苏公网安备32059002004080号


