由福建省抗癌协会癌痛专业委员会和福建省抗癌协会中西医整合肿瘤专委会青年委员会主办的【十邑论坛】开播啦!论坛于每周四推出,带您用中文听原汁原味的美国临床肿瘤学会胃肠道肿瘤研讨会(ASCO GI)研究。本期十邑论坛带来了来自纪念斯隆凯特琳癌症中心(Memorial Sloan Kettering Cancer Center)的Eileen M O'Reilly教授分享了关于胰腺癌(PDAC)治疗新进展的深刻见解。【肿瘤资讯】特邀泉州市第一医院洪燕妮教授进行相关研究解读。
泉州市第一医院 肿瘤内科副主任医师
福建省抗癌协会癌痛专委会委员
福建省抗癌协会中西医整合肿瘤专业委员会青年委员
福建省抗癌协会肿瘤营养与支持治疗专业委员会青年委员
泉州市抗癌协会免疫治疗专业委员会委员
胰腺导管腺癌(PDAC)的治疗长期面临严峻挑战。其独特的肿瘤微环境(TME)——富含致密的间质纤维、存在物理屏障、并充满免疫抑制细胞——极大地削弱了药物递送和免疫反应。此外,肿瘤内部的异质性、靶点在正常组织中的表达等因素,也限制了传统靶向治疗和免疫治疗的效果,开发能够克服这些障碍的新型治疗策略显得尤为迫切。抗体偶联药物(ADCs)、放射性核素标记抗体以及双特异性抗体(BsAbs)和新型免疫检查点抑制剂(CPIs)代表了这一研究方向。
单克隆抗体在胰腺癌治疗中的探索与挑战
尽管PDAC的复杂TME和内在异质性对基于抗体的治疗策略构成了显著障碍,但针对特定肿瘤相关抗原的单克隆抗体(mAbs)研发仍在积极推进,部分项目已进入后期临床评估阶段,其最终结果对于指导未来治疗策略具有重要意义。
其中,靶向紧密连接蛋白Claudin 18.2(CLDN18.2)的佐妥昔单抗代表了基于生物标志物选择的治疗尝试。CLDN18.2作为一种在正常组织中表达受限、但在胃癌及部分胰腺癌细胞表面异常富集的跨膜蛋白,为靶向治疗提供了潜在窗口。关键性的 GLEAM 研究,一项随机对照II期临床试验,旨在评估佐贝妥昔单抗联合标准一线化疗(吉西他滨联合白蛋白紫杉醇)对比单纯化疗在CLDN18.2高表达(定义为免疫组化检测≥75%的肿瘤细胞呈现中至强强度膜染色)转移性PDAC患者(N=357)中的疗效。根据会议报告引述的初步数据,联合治疗组展现出潜在的生存获益信号,其中位总生存期(OS)据报道为15.0个月,相较于对照组的10.5个月,风险比(HR)为0.70(图1)。若此结果在最终分析中得以确证,将为CLDN18.2高表达PDAC患者群体提供一种新的治疗选择,并验证生物标志物驱动策略在该癌种中的可行性。
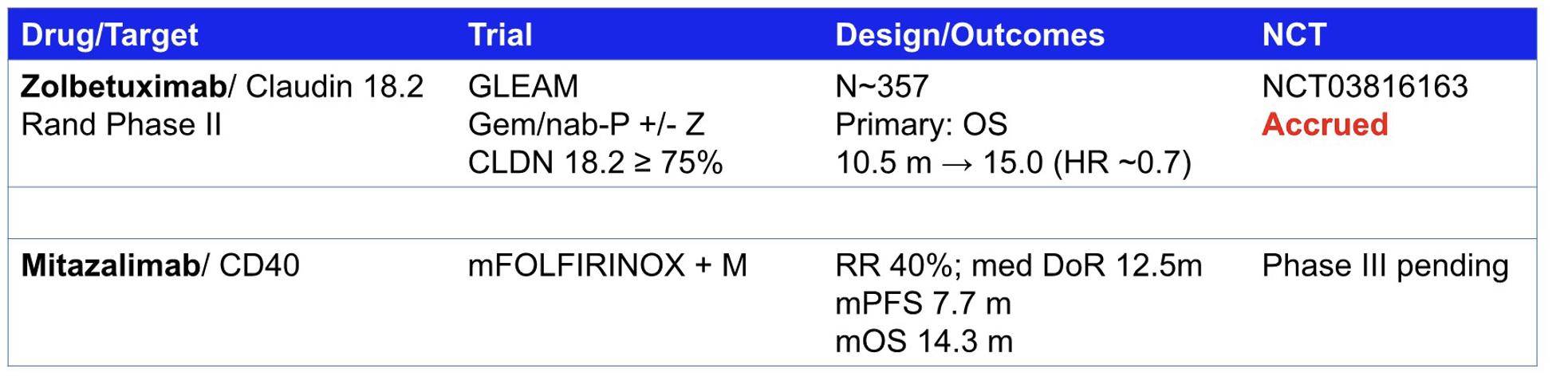
另一项备受关注的策略是利用Mitazalimab,一种CD40激动性单克隆抗体,旨在通过激活免疫系统对抗肿瘤。CD40信号通路在抗原呈递细胞(APCs),尤其是树突状细胞(DCs)的成熟和功能激活中扮演核心角色。通过激动CD40,Mitazalimab旨在增强APCs提呈肿瘤抗原的能力,促进T细胞启动和效应功能,以期克服PDAC固有的免疫抑制状态。该研究探索了Mitazalimab联合标准化疗方案mFOLFIRINOX作为转移性PDAC一线治疗的潜力。报告的中期分析数据显示出抗肿瘤活性:客观缓解率(ORR)达到约40%,中位缓解持续时间(DOR)为12.5个月,中位无进展生存期(PFS)为7.7个月,中位OS则达到14.3个月(图1)。这些数据提示Mitazalimab联合化疗可能产生协同增效作用,但正如报告者所强调,单克隆抗体在PDAC治疗领域的整体进展仍充满不确定性,Mitazalimab的确切临床价值及其在治疗路径中的定位,尚有待更大规模、设计更严谨的III期临床试验结果来最终确立。
双特异性抗体:精准介导多维抗肿瘤效应的新兴策略
面对mAbs在PDAC治疗中遭遇的瓶颈以及TME的复杂性,BsAbs正受到越来越多的关注。BsAbs的核心特征在于其分子结构包含两个不同的抗原结合位点,赋予其同时与两种不同分子靶点相互作用的能力。这种结构特性带来了功能多样性,包括但不限于:桥接免疫效应细胞(如T细胞、NK细胞)与肿瘤细胞,介导免疫细胞对肿瘤的特异性杀伤;同时干预两条关键信号传导通路;或靶向肿瘤细胞与 TME 中的基质或免疫组分。其抗肿瘤机制亦多元化,可涉及抗体依赖性细胞介导的细胞毒性作用(ADCC)、补体依赖的细胞毒性作用(CDC)、抗体依赖性细胞吞噬作用(ADCP)及T细胞重定向等多种途径。尽管BsAbs在血液系统恶性肿瘤领域已取得显著的临床成功并有多种药物获批,其在实体瘤,特别是胃肠道肿瘤中的应用研究亦在快速推进。
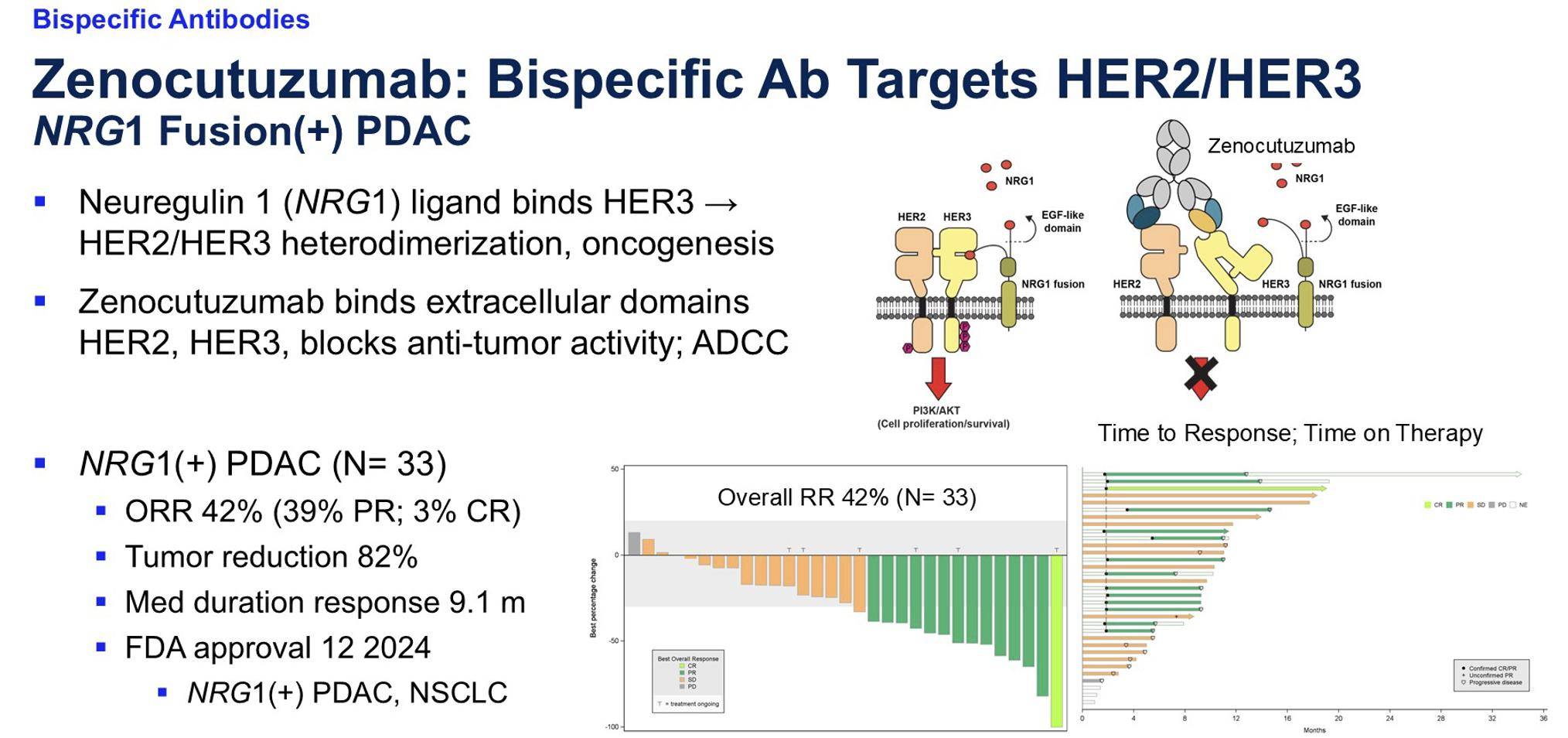
Zenocutuzumab是一种靶向HER2和HER3的双特异性抗体,其独特之处在于其设计主要针对携带NRG1基因融合这一罕见驱动性基因变异的肿瘤。NRG1配体与其受体HER3结合后,会诱导HER3与HER2形成异二聚体,从而激活下游致癌信号通路。Zenocutuzumab通过与HER2结合,并有效阻断NRG1与HER3的相互作用,从而抑制关键的HER2/HER3异二聚化及其下游信号传导,发挥抗肿瘤作用,同时其Fc段也可能介导ADCC效应。
一项临床试验的数据结果显示,该药物在该难治性人群中诱导了高达42%的ORR,其中包括3%的完全缓解(CR)和39%的部分缓解(PR)。影像学评估显示82%的患者肿瘤体积出现不同程度缩小,中位DOR达到9.1个月(图2)。这一发现不仅凸显了识别并靶向此类罕见驱动基因变异的极端重要性,也深刻提示临床实践中,全面的分子诊断策略对于准确检出可能被常规DNA检测遗漏的NRG1融合至关重要。基于此,Zenocutuzumab已被批准用于治疗既往接受全身治疗后进展的、不可切除或转移性的NRG1融合阳性PDAC,是PDAC精准治疗领域的一个里程碑式进展。
其他新兴双特异性抗体及挑战
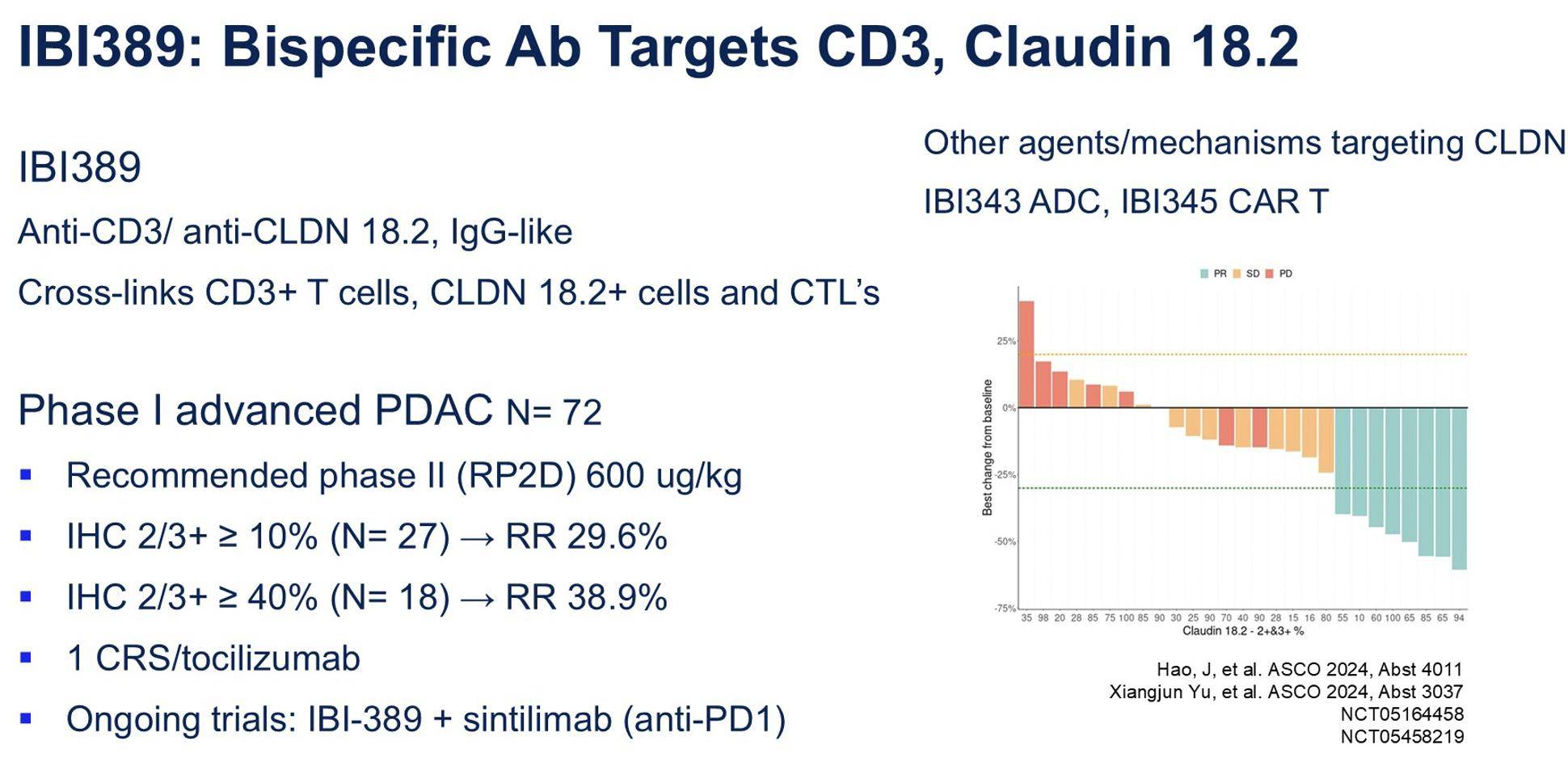
IBI389,一种靶向CLDN18.2与CD3的T细胞衔接器(TCE),通过重定向T细胞攻击CLDN18.2阳性肿瘤细胞发挥作用。早期临床研究显示其具有良好的抗肿瘤活性,尤其在CLDN18.2高表达患者中。值得注意的是,在低表达亚组亦观察到30%的客观缓解率,提示其潜在的广泛适用性。相关细胞因子释放综合征(CRS)据报道可控(图3)。目前,评估IBI389单药及联合PD-1抑制剂治疗胰腺癌的临床试验正在进行。
PT886是一种IgG样双特异性抗体,同时靶向CLDN18.2和CD47。通过特异性阻断CLDN18.2阳性肿瘤细胞上的CD47“别吃我”信号,PT886旨在增强巨噬细胞介导的先天免疫吞噬作用,并可能促进适应性免疫应答。该药物正处于I/II期临床开发,探索其单药、联合化疗或PD-1抑制剂在转移性胰腺癌及胃食管癌中的应用。PT886已获得美国FDA授予的胰腺癌治疗孤儿药认证。
IMM2510是一种靶向PD-L1和VEGF的双特异性抗体融合蛋白。其设计旨在通过同时阻断这两个关键通路,达到激活T细胞免疫(抗PD-L1)和抑制肿瘤血管生成(抗VEGF)的双重效果,并可能具备 ADCC 活性。该药物的研发目前主要集中在亚洲,已在肺癌和胸腺癌中显示出显著活性,一项针对胰腺癌的中期临床研究正在亚洲进行。
尽管BsAbs展现出治疗潜力,但其开发和应用仍面临挑战。耐药机制是关键问题之一,可能涉及靶抗原丢失、肿瘤细胞下调MHC-I类分子表达以逃避T细胞识别、干扰素-γ信号通路缺陷以及宿主产生抗药抗体等。此外,毒性管理同样重要,尤其是TCE类BsAbs可能引发的CRS需要有效的预防和处理策略,同时需关注潜在的靶向相关或脱靶毒性。
新型免疫检查点抑制剂:Botensilimab的探索
鉴于标准PD-1/PD-L1抑制剂在大多数微卫星稳定(MSS)型胰腺癌中疗效受限,研究正转向探索其他免疫检查点通路及具有增强机制的新型抑制剂。Botensilimab,一种处于研发后期的新型抗CTLA-4抗体,是该方向的代表。相较于第一代CTLA-4抗体,Botensilimab经人源化改造并据称具有更强的效应器功能,其机制可能涉及强化免疫突触促进T细胞启动及更有效地耗竭Tregs,从而可能更有效地克服肿瘤免疫抑制。
支持其在胰腺癌中探索的依据部分来源于其在其他免疫治疗反应欠佳的肿瘤类型中展现的积极信号,包括在晚期MSS型结直肠癌(尤其无肝转移者)中的显著疗效,以及在早期直肠癌新辅助治疗研究中观察到的显著病理缓解(12例中6例病理缓解,含2例pCR)(图4)。此外,在小样本回顾性分析中,联合吉西他滨/白蛋白紫杉醇治疗经治乳腺癌亦显示出初步疗效迹象。基于这些跨瘤种的数据,一项评估Botensilimab联合吉西他滨/白蛋白紫杉醇对比单纯化疗用于转移性胰腺癌二线治疗的随机II期“信号探索”研究已经完成患者招募。该研究的结果预计于2025年下半年公布,对于评价此类新型CTLA-4抗体在胰腺癌治疗中的潜力至关重要。

胰腺癌的治疗正借助抗体的持续创新(包括单抗、双特异性抗体及新型免疫检查点抑制剂等)向前推进。双特异性抗体尤为瞩目,Zenocutuzumab在NRG1融合亚组的成功获批,凸显了精准诊断(如依赖RNA检测)与靶向治疗的重要性,同时丰富的在研管线正探索更多可能。新型检查点抑制剂Botensilimab的关键数据亦值得期待。未来挑战在于优化联合策略、克服耐药与毒性、并筛选获益人群,但认识到胰腺癌的潜在免疫反应性,为持续研发改善预后注入了动力。
排版编辑:xiaodong











 苏公网安备32059002004080号
苏公网安备32059002004080号


