2025年3月14日至17日,56届美国妇科肿瘤学会年会(SGO)在美国西雅图盛大召开。本次大会,湖南省肿瘤医院唐洁教授团队开展的两项研究:“卡度尼利单抗联合新辅助化疗治疗晚期卵巢癌的开放标签前瞻性II期研究(CANECT/AK104-IIT-003)[1]”“新辅助化疗后序贯放化疗加辅助化疗治疗局部晚期宫颈癌:10年真实世界研究[2]”成功入选,引发了广泛关注。借此契机,【肿瘤资讯】特别邀请唐洁教授进行专访,围绕此两项研究的临床数据、意义以及未来探索方向等话题展开深入探讨。
传统治疗R0切除率仅50%,晚期卵巢癌治疗仍存挑战
肿瘤资讯:晚期卵巢癌的标准治疗以新辅助化疗(NAC)联合手术为主,但目前R0切除率仅约50%,患者预后仍不理想。您能否结合当前临床挑战,谈谈AK104-IIT-003研究的背景和初衷?
唐洁教授:卵巢癌是病死率最高的妇科恶性肿瘤,起病隐匿,确诊时多为晚期。对于III~IV期的晚期患者,初次肿瘤细胞减灭术难以满意减灭,且易增并发症与死亡率。新辅助化疗(NACT)后间歇性肿瘤细胞减灭术可提高R0率、降低并发症、延长生存、提升生活质量,已成为晚期卵巢癌初始治疗模式之一。虽然这种治疗方案在一定程度上延长了患者的生存期,但是其R0切除率仍然仅约为50%。这意味着大约一半的晚期卵巢癌患者在手术后仍然会面临肿瘤残留的问题,这增加了疾病复发的风险。
近年来,免疫疗法在肿瘤治疗领域取得了显著的进展,其中免疫检查点抑制剂(ICIs)更是成为了研究的热点。已有研究[3]显示,NACT联合免疫治疗可以提高晚期卵巢癌R0切除率,延长患者生存时间,但总体AE发生率均较高。卡度尼利单抗是一种新型的双特异性抗体,它同时靶向PD-1和CTLA-4这两个关键的免疫检查点[4]。这种设计使得卡度尼利单抗能够更有效地激活免疫系统,从而更好地识别和清除肿瘤细胞。此外,卡度尼利单抗还具有独特的四价结构,这增强了其在肿瘤微环境中的高结合活性,并减少了由Fc受体介导的一系列可能导致临床安全性不佳的问题[3]。

基于以上背景,我们开展了AK104-IIT-003这项研究,旨在评估卡度尼利单抗联合NACT在晚期卵巢癌患者中的疗效和安全性[1]。我们希望通过这项研究,能够为晚期卵巢癌患者提供一种更有效、更安全的治疗方案,从而提高R0切除率,并最终改善患者的预后。
免疫联合化疗协同增效,卵巢癌新辅助治疗模式迎来新进展
肿瘤资讯:AK104-IIT-003研究结果显示,R0切除率达到了79.3%,显著高于历史数据,且ORR高达97%。能否请您解读该研究的结果以及联合策略的可能机制?
唐洁教授:AK104-IIT-003研究[1]中的R0切除率达到了79.3%,相较传统的新辅助治疗模式提升了将近30%,意味着更多的患者能够在接受新辅助治疗和手术后,实现无肉眼残留病灶的状态,从而大大降低肿瘤复发和转移的风险。该研究的客观缓解率(ORR)也高达97.0%,这进一步证实了卡度尼利单抗联合化疗在晚期卵巢癌中的强大疗效。此外,患者中位无进展生存期(PFS)为17.5个月(95%CI:14.77-NE),中位总生存期(OS)尚待进一步随访确定。
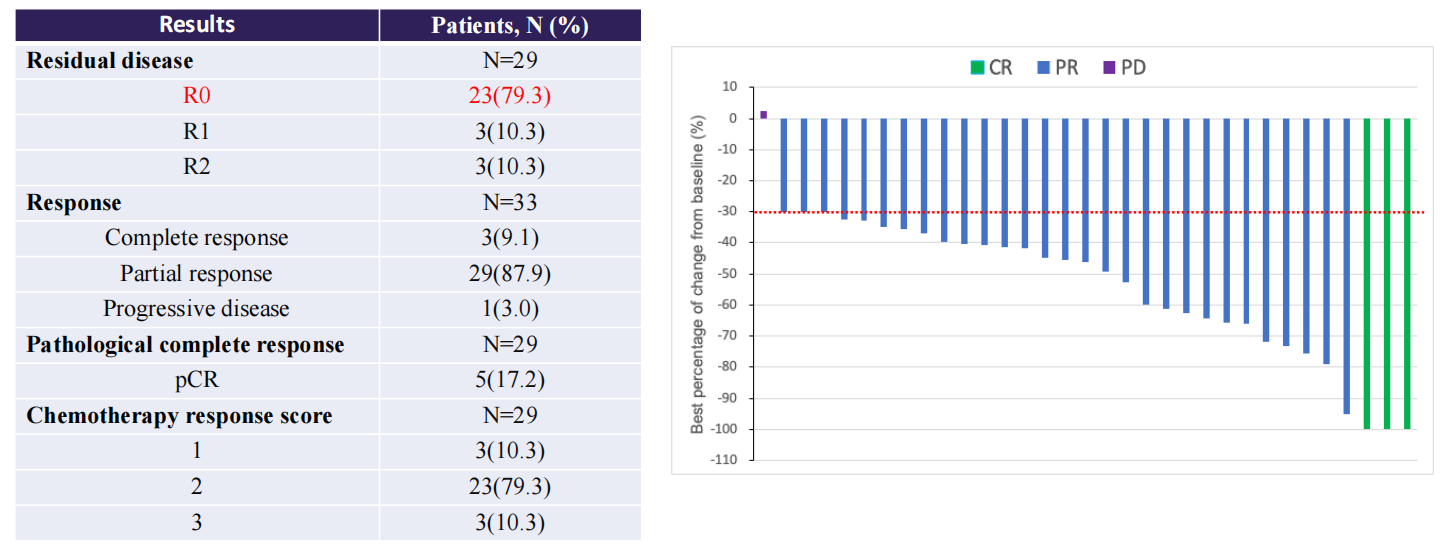
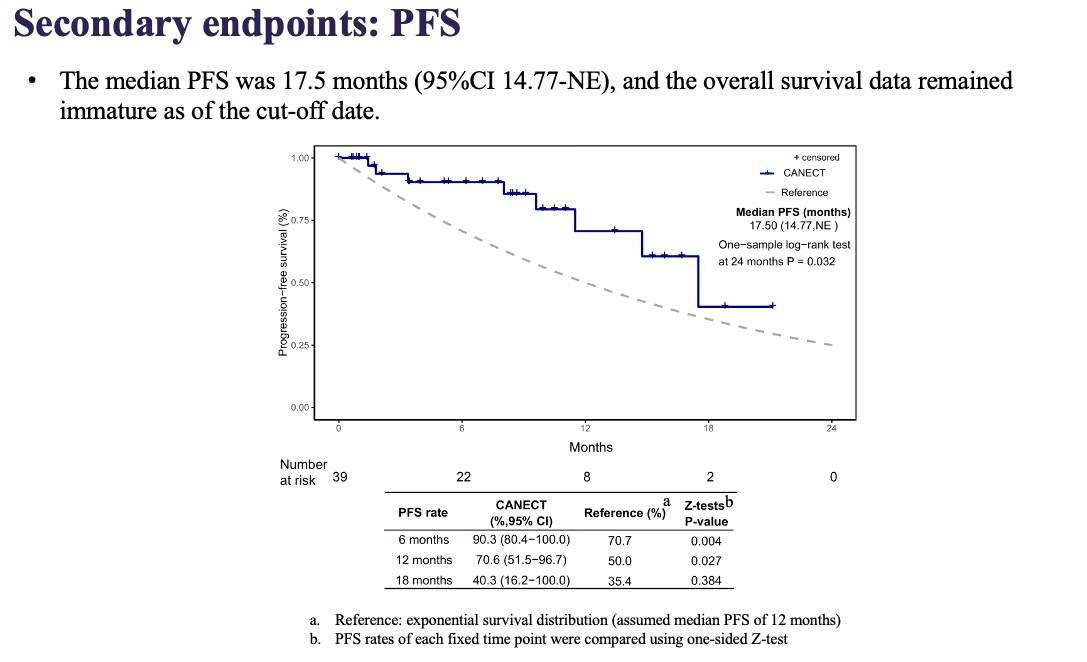
卡度尼利单抗联合化疗通过以下机制协同提升手术效果:卡度尼利单抗作为双特异性抗体,同时靶向PD-1和CTLA-4,可激活T细胞,打破肿瘤免疫抑制,引发强烈抗肿瘤免疫反应;化疗药物直接杀死肿瘤细胞,破坏肿瘤血管和基质,为免疫细胞渗透创造条件,并通过免疫原性死亡(ICD)释放肿瘤抗原,进一步激活免疫系统。两者协同作用,在AK104-IIT-003研究中,显著提高了R0切除率和ORR,改善肿瘤微环境,降低术后复发和转移风险,且安全性良好,所有级别的治疗相关不良事件(TRAEs)的发生率为46.2%,≥3级TRAEs为7.7%,大多数患者能够耐受并顺利完成治疗。
综上所述,AK104-IIT-003研究的结果预示着,卡度尼利单抗联合化疗的新辅助治疗模式或为晚期卵巢癌患者带来了新的治疗选择和希望。
局部晚期宫颈癌同步放化疗之外,是否存在更优解?真实世界研究揭晓答案
肿瘤资讯:在您团队开展的局部晚期宫颈癌真实世界研究中,为何选择“NACT→放化疗→辅助化疗”的序贯策略?其理论依据和临床优势是什么?
唐洁教授:宫颈癌在全球范围内对女性健康构成了严重威胁。目前,局部晚期宫颈癌的标准治疗是同步放化疗(CRT)。NACT和辅助化疗(AC)理论上可提升CRT的疗效。NACT能在放化疗前杀灭远处微小转移病灶,缩小原发灶体积,降低肿瘤分期,使难以控制的肿瘤更易处理,还能评估肿瘤对化疗的敏感性,为后续治疗方案调整提供依据,提高针对性和有效性。AC则可杀灭残留肿瘤细胞,巩固放化疗疗效,降低复发和转移风险。
然而,OUTBACK试验[5]显示,CRT后AC(卡铂和紫杉醇)相较单独CRT,没有提高局部晚期宫颈癌总生存率(5年OS:72% vs 71%;P=0.81)。相反,GCIG INTERLACE试验[6]显示,NACT(卡铂和紫杉醇)后CRT,相比单纯CRT可以改善OS率(5年OS:80% vs 72%,P=0.04)。总之,CRT与化疗的不同组合是否可以改善局部晚期宫颈癌的长期生存仍然存在争议。因此,我们此项真实世界研究旨在评估“NACT→放化疗→AC”的序贯策略,在局部晚期宫颈癌中的疗效和安全性,以期为临床决策提供参考。
5年OS达85.16%,三联序贯方案显著优于传统放化疗
肿瘤资讯:该研究的长期生存及安全性结果如何?10年的真实世界数据能提供哪些独特洞见?
唐洁教授:在该真实世界研究[2]中,接受NACT后序贯CRT和AC的患者,与NACT+CRT相比,5年PFS(77.16% vs 73%)和OS(85.16% vs 80%)虽无显著差异,但与单纯CRT及CRT+AC相比,5年PFS(77.16% vs 58%、77.16% vs 63%)和OS(85.16% vs 66%、85.16% vs 72%)均显著提升,且P值均小于0.001,具有显著统计学意义。
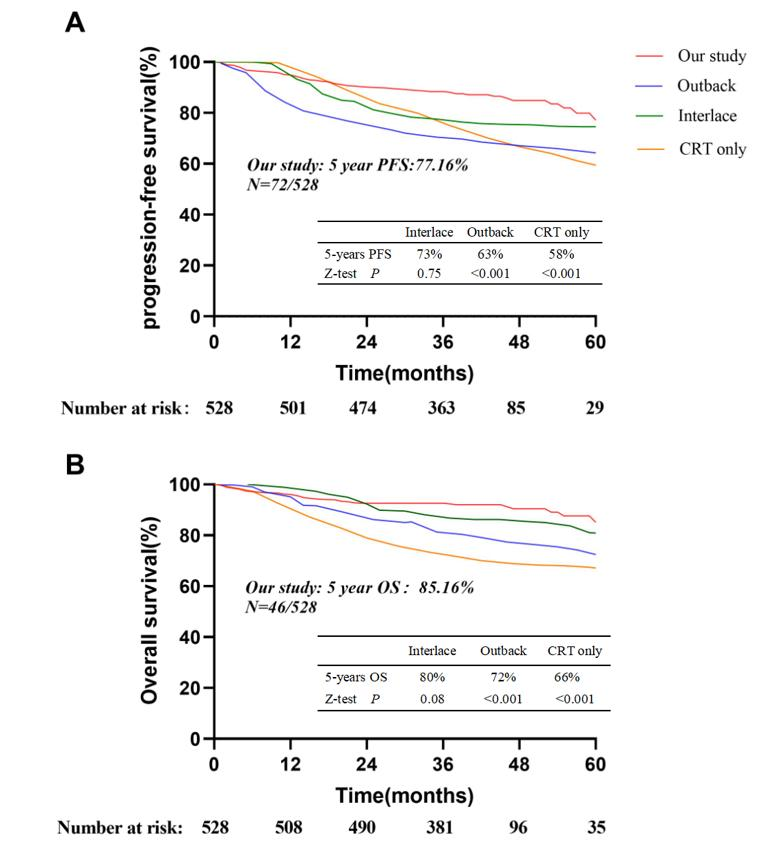
在所有接受NACT和CRT的患者中,77.7%仅接受了一个周期的NACT(1-5个周期)。CRT后,70.3%的患者接受了一个周期以上的AC。
分层分析NACT/AC方案后发现,与多西他赛组相比,紫杉醇组的5年PFS(92.3% vs 73.5%;HR=1.98,95%CI:1.18-3.31,P=0.028)和5年OS(95.5% vs 82.5%;HR=2.2,95%CI:1.15-4.19,P=0.048)均有显著提升。在安全性方面,91例患者(17%)发生了严重不良事件,最常见的是骨髓抑制。尽管存在一定的毒性反应,但这些反应在可接受范围内,且没有发生治疗相关死亡。
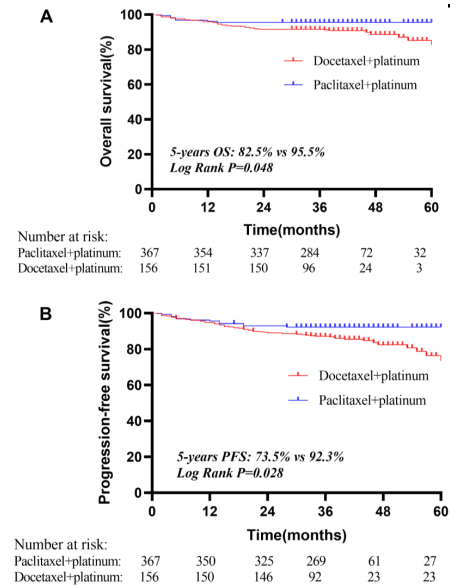
图5 基于NACT/AC方案的分层分析后的生存结果(A. OS B.PFS)
总之,对于局部晚期宫颈癌患者,NACT联合CRT及AC,较单独CRT或CRT联合AC,可显著提高长期生存率,且安全性可控。推荐在NACT和AC中采用紫杉醇联合铂类方案。本研究基于大规模真实数据,为局部晚期宫颈癌治疗提供了新思路,但需进一步前瞻性研究以证实这些发现。
新疗法和生物标志物探索,妇科肿瘤精准治疗的发展方向
肿瘤资讯:在妇瘤领域,免疫或靶向药物与传统治疗的联合应用逐渐成为趋势。您认为未来还有哪些有潜力的研究方向?
唐洁教授:近年来,宫颈癌免疫治疗展现出广阔前景。而卵巢癌治疗领域则以靶向治疗为核心突破方向,抗血管生成药物与PARPi凭借精准作用机制成为重要治疗手段,通过抑制血管生成或阻断DNA修复通路显著提升疗效,同时降低对正常组织的毒性。尽管ICIs在卵巢癌中尚未获批,但约50%患者携带的BRCA1/2突变或同源重组缺陷(HRD)提示潜在治疗机会——此类肿瘤因新抗原负荷升高及肿瘤浸润淋巴细胞(TILs)富集可能形成免疫敏感微环境,然而目前缺乏有效生物标志物来预测ICIs的反应,仍待进一步探索。
此外,免疫联合抗血管生成药物及化疗的协同策略已显现增效潜力,PD-1/VEGF双抗、靶向FRα/HER2/TROP2的抗体偶联药物(ADC)等创新疗法亦在临床试验中崭露头角。未来需进一步整合多组学技术与大数据分析,构建涵盖基因组特征(如HRD)、免疫微环境及治疗响应的动态预测模型,推动个体化治疗体系的完善,最终实现生存获益与生活质量的同步提升。
专家介绍
湖南省肿瘤医院妇瘤中心技术总监,妇瘤一科主任 、主任医师、 教授
博士、硕士生导师、留美博士、博士后
中国抗癌协会卵巢癌专委会委员
中国医师协会医学机器人医师分会委员
中国临床肿瘤学会(CSCO)妇科肿瘤委员会委员
国家癌症中心卵巢癌质控专家委员会委员
中国抗癌协会多学科专委会(MDT)委员
中国优生优育妇产科专业委员会委员
中国研究型医院妇瘤专委会委员
湖南省抗癌协会妇瘤专委会主任委员
湖南省高层次卫生人才“225”工程妇科恶性肿瘤学科带头人
美国妇科肿瘤协会会员
美国临床肿瘤杂志(CLINICAL CANCER RESEARCH)特邀审稿人
获得美国执业医师证,在美国THOMAS JEFFERSON大学医院学习和从事妇科临床工作多年
获得和主持多个美国卫生部、国家级及省级自然科学基金课题,在国际一流的医学杂志上发表第一或通讯作者的SCI论文30多篇
[1] Jie Tang, Wenfang Tian, Si Huang, Jun Yang, Chenge Zhang, Hongying Yang. (ENCORE) An open-label, prospective phase II study of cadonilimab in combination with neoadjuvant chemotherapy for patients diagnosed with advanced ovarian cancer (AK104-IIT-003)
[2] Chenge Zhang, Lesai Li, Wenfang Tian, Jun Yang, Si Huang, Jie Tang. Neoadjuvant Chemotherapy Followed by Chemoradiation Plus Adjuvant Chemotherapy for Locally Advanced Cervical Cancer: A Real-World Study with 10 Years Experience.
[3] Park J, Lee JB, Lim MC, Kim BG, Kim JW, Kim S, Choi CH, Kim HS, Park SY, Lee JY; KGOG investigators. Phase II study of durvalumab and tremelimumab with front-line neoadjuvant chemotherapy in patients with advanced-stage ovarian cancer: primary analysis in the original cohort of KGOG3046/TRU-D. J Immunother Cancer. 2023 Oct;11(10):e007444.
[4] Pang X, Huang Z, Zhong T, Zhang P, Wang ZM, Xia M, Li B. Cadonilimab, a tetravalent PD-1/CTLA-4 bispecific antibody with trans-binding and enhanced target binding avidity. MAbs. 2023 Jan-Dec;15(1):2180794.
[5] Mileshkin LR, Moore KN, Barnes EH, et al. Adjuvant chemotherapy following chemoradiotherapy as primary treatment for locally advanced cervical cancer versus chemoradiotherapy alone (OUTBACK): an international, open-label, randomised, phase 3 trial. Lancet Oncol. 2023 May;24(5):468-482.
[6] McCormack M, Eminowicz G, Gallardo D, et al. Induction chemotherapy followed by standard chemoradiotherapy versus standard chemoradiotherapy alone in patients with locally advanced cervical cancer (GCIG INTERLACE): an international, multicentre, randomised phase 3 trial. Lancet. 2024 Oct 19;404(10462):1525-1535. doi: 10.1016/S0140-6736(24)01438-7IF: 98.4 Q1 .
排版编辑:肿瘤资讯-Jina












 苏公网安备32059002004080号
苏公网安备32059002004080号


