2025年2月13日,南方医科大学南方医院石敏教授团队在Journal for Immunotherapy of Cancer上发表了题为“Targeting adenosine enhances immunotherapy in MSS colorectal cancer with EGFRvIII mutation”的重要研究成果。该研究深入剖析了EGFRvIII突变在微卫星稳定型(MSS)结直肠癌(CRC)中的作用机制,并创新性地评估了靶向腺苷(ADO)代谢的治疗策略,旨在改善肿瘤微环境(TME),显著提升免疫疗法的治疗效果。【肿瘤资讯】特此对该研究进行整理提炼,以飨读者。

程序性细胞死亡蛋白 1 (PD-1) 和程序性死亡配体 1 (PD-L1) 的免疫疗法已经彻底改变了恶性肿瘤的治疗,但由于约95%的错配修复功能正常/微卫星稳定 (MSS) 结直肠癌 (CRC) 患者对免疫检查点抑制剂 (ICI) 单药疗法存在固有耐药性,免疫治疗在此类肿瘤中的应用仍然具有挑战性。近年来,利用组合策略重建肿瘤微环境 (TME),例如将分子靶向药物与免疫疗法结合,已成为研究热点。西妥昔单抗 (CET),作为一种靶向表皮生长因子受体 (EGFR) 的抗体,在转移性结直肠癌 (mCRC) 的一线及后续治疗中表现出良好的疗效。不同于传统抗癌药物,CET通过调节免疫反应增强了免疫细胞的浸润和免疫原性。然而,尽管组合治疗展现了初步的潜力,临床中仅观察到适度的改善,这提示还需探索新的联合治疗策略。最近的研究表明,针对特定基因突变进行分层治疗可能为治疗MSS CRC患者提供了新的希望,特别是BRAF突变和EGFRvIII突变的研究,均揭示了新的免疫微环境特征和潜在的治疗靶点。
研究方法
本研究共纳入五个患者队列,所有样本收集与分析符合伦理要求,并获得参与者知情同意。队列1包含79例未经治疗的CRC患者的原发部位石蜡包埋样本,用于IHC分析。队列2由115例MSS CRC患者组成,使用外周血样本进行CTC分析。队列4包括40例接受CET治疗的pMMR CRC患者,石蜡包埋肿瘤标本用于IHC及IF分析,以评估EGFRvIII、CD39、CD73、CD8及PD-L1的表达。队列5包含80例MSS mCRC患者,均接受CET治疗,并通过IHC确认pMMR/MSS状态,同时进行CTC检测以评估EGFRvIII的表达,其中32例患者记录了TTP数据,25例患者在治疗过程中接受动态CTC检测。
动物实验采用皮下肿瘤移植模型,研究EGFRvIII对CET疗效的影响及不同联合治疗策略的效果,采用流式细胞术和IHC分析免疫细胞浸润。细胞实验使用HCA7、DIFI、MC38及CT26细胞株,定期进行支原体检测,并通过短串联重复测序进行鉴定。
研究结果
1. EGFRvIII突变与不良预后及免疫抑制TME相关
研究结果表明,EGFRvIII 突变在结直肠癌 (CRC) 中与不良预后及免疫抑制性TME)密切相关。对79名新诊断、未经治疗的CRC患者样本进行IHC 分析发现,大约10% (8/79) 的患者存在EGFRvIII 突变,其表达仅定位于肿瘤细胞的细胞质和质膜,而在肿瘤周围基质或正常粘膜中未检测到。进一步对115名未经治疗的 MSS CRC 患者的外周血样本中CTC 进行 RNA 荧光原位杂交分析,发现12% (14/115) 的患者存在强EGFRvIII 荧光信号(表1)。临床分析显示,EGFRvIII 突变与肿瘤分化、淋巴结转移及远处转移密切相关,且 EGFRvIII 阳性 CRC 患者的预后明显较差(图1)。
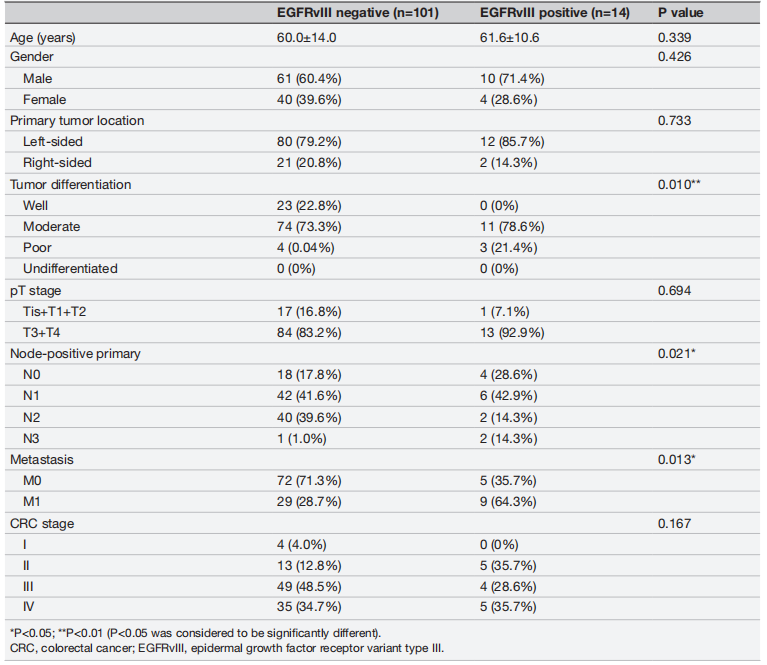
通过基于基因集变异分析的 TME 研究发现,EGFRvIII 阳性 CRC 样本主要表现为“免疫沙漠”表型,表现出较低的免疫浸润水平(图1)。IF和IHC结果表明,EGFRvIII 阳性 CRC 中的 T 细胞浸润显著减少,且浸润 T 细胞产生的效应细胞因子也受到抑制。共培养实验进一步表明,EGFRvIII 表达会抑制 CD8+ T 细胞的浸润及活性。综上所述,这些结果强烈提示 EGFRvIII 突变在 CRC 中与肿瘤的免疫抑制微环境和不良临床预后密切相关。
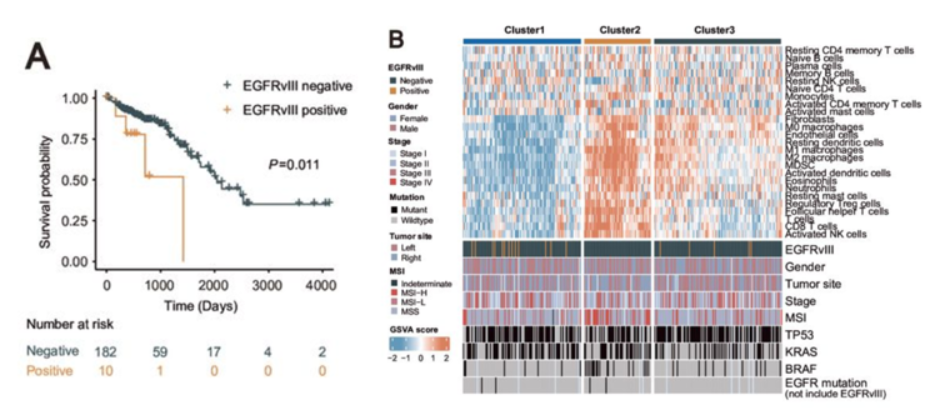
2.EGFRvIII突变导致MSS CRC对CET耐药
临床CTC检测发现,EGFRvIII阳性患者对CET治疗反应较差,进展时间缩短。治疗后,患者CTC中EGFRvIII评分普遍升高,提示EGFRvIII与CET疗效负相关(图2)。动物实验也证实,EGFRvIII阳性肿瘤对CET治疗不敏感,而对免疫缺陷小鼠的实验表明,耐药性与肿瘤细胞自身无关,而与免疫抑制相关。
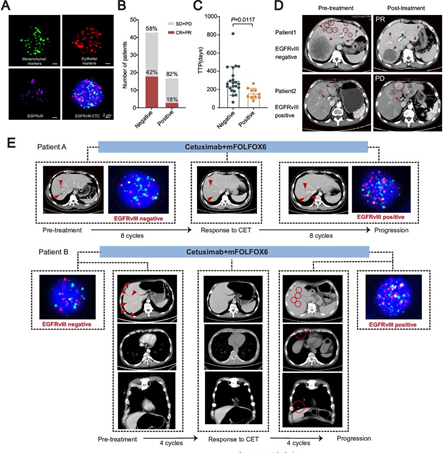
3.肿瘤衍生腺苷(ADO)抑制T细胞浸润和功能
体外实验发现,EGFRvIII肿瘤细胞上清液可抑制CD8+ T细胞功能,表明存在可溶性免疫抑制因子。分离小分子后发现,EGFRvIII肿瘤细胞产生高水平ADO,外源性ADO或A2AR激动剂均可抑制T细胞功能,提示EGFRvIII肿瘤通过ADO逃避T细胞介导的免疫攻击。
4.EGFRvIII肿瘤细胞通过CD39/CD73通路促进ATP转化为ADO
EGFRvIII细胞中CD39和CD73表达水平升高,临床样本证实二者与EGFRvIII共表达。抑制CD39可降低ADO生成,恢复T细胞功能。动物实验也证实,CD39/CD73抑制剂可增强CET疗效,促进T细胞浸润。
5.磷酸化STAT3上调EGFRvIII阳性CRC中的CD39/CD73表达
基因集富集分析提示STAT3通路与EGFRvIII相关。EGFRvIII细胞中磷酸化STAT3 (p-STAT3) 升高,抑制STAT3可降低CD39/CD73表达,减少ADO生成,恢复T细胞功能。ChIP-qPCR证实STAT3可直接结合CD39/CD73启动子。
6.阻断ADO生成与免疫疗法产生协同作用
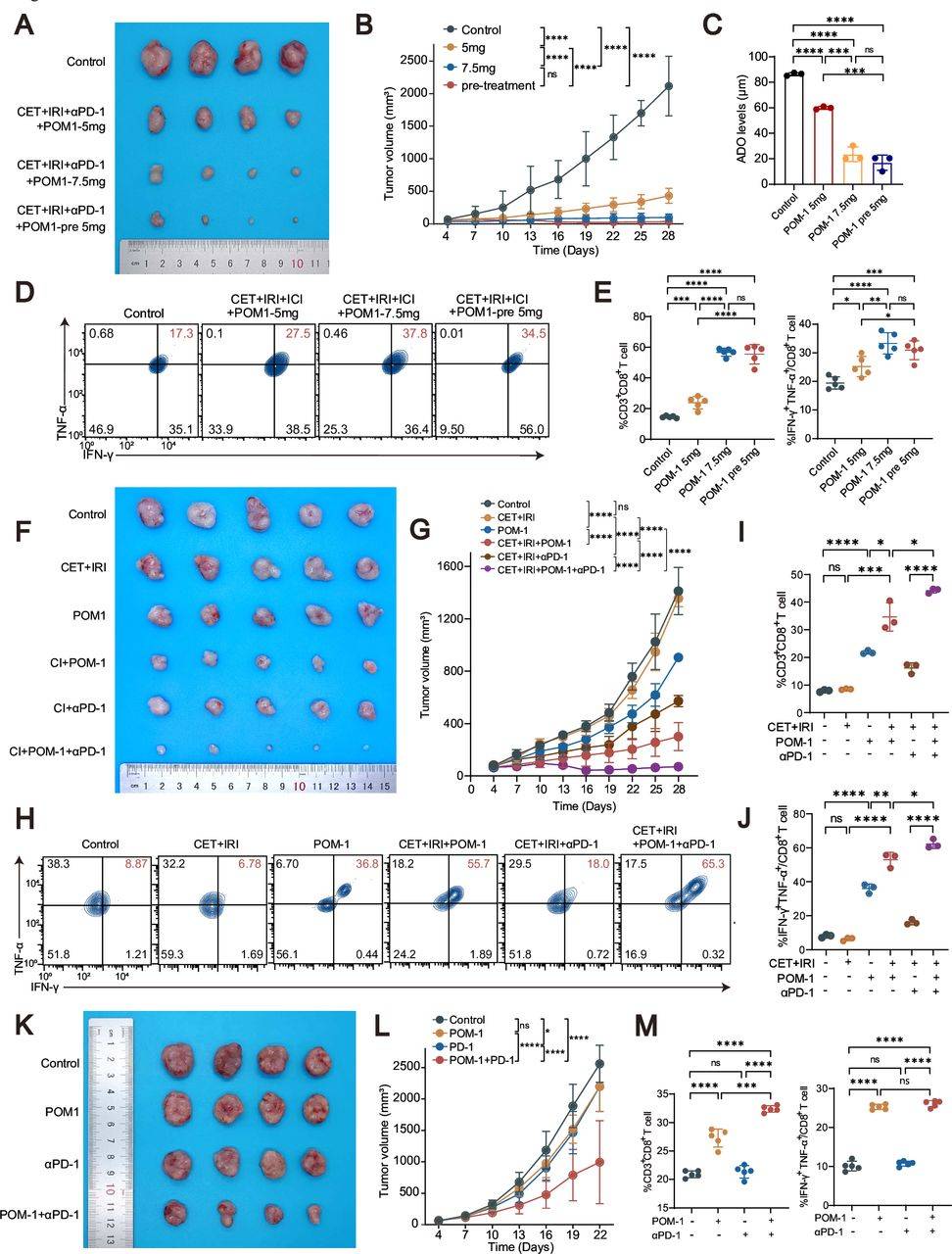
本研究结果表明,源自EGFRvIII阳性CRC的细胞外腺苷(ADO)通过抑制T细胞浸润和活性,导致对CET和免疫疗法联合治疗的耐药性。通过体内实验,发现三联治疗(CET+IRI+POM-1)能够显著促进TME中CD8+ T细胞的浸润,从而延缓肿瘤进展,而四联治疗(CET+IRI+POM-1+抗PD-1)在改善T细胞浸润方面效果最佳,显示了针对ADO生成的抑制可能提高EGFRvIII阳性CRC对CET和免疫疗法的敏感性。
进一步优化POM-1治疗方案,通过调整剂量或提前预处理,显著改善了治疗效果。特别是POM-1预处理方案促进了CD8+ T细胞的浸润和活性,从而提高了抗肿瘤效果。这些数据表明,POM-1诱导的TME重塑为CET和抗PD-1治疗提供了更有利的免疫激活环境。
此外,靶向ADO代谢的联合治疗(POM-1与抗PD-1联合使用)在CT26小鼠模型中有效克服了抗PD-1耐药性,显著抑制了肿瘤生长,并增强了T细胞浸润和细胞因子的分泌(图3)。这些结果表明,CD39抑制剂在EGFRvIII阳性MSS CRC免疫治疗中具有强大的潜力,且EGFRvIII作为新的生物标志物在免疫治疗中的应用具有重要价值。
讨论
本研究揭示了EGFRvIII突变在CRC中的关键作用,特别是在免疫抑制性TME形成和耐药性机制中的影响。研究发现,EGFRvIII阳性CRC通过由肿瘤衍生的腺苷(ADO)介导的免疫抑制性TME,导致抗EGFR疗法(如CET)与免疫治疗的联合效果下降。但通过抑制CD39,免疫细胞浸润得到了改善,耐药性得以逆转,为开发EGFRvIII阳性MSS CRC的新免疫疗法提供了突破。
此外,研究还表明CET耐药性不仅与信号通路改变相关,还与免疫微环境的重塑密切相关。EGFRvIII突变通过上调PD-L1表达,促进免疫逃逸。ADO代谢抑制剂(如CD39和CD73的抑制)显示了在逆转免疫逃逸和增强免疫疗效方面的潜力,尤其在MSI-H和MSS CRC肿瘤中。
EGFRvIII突变还通过激活STAT3通路调控CD39和CD73的表达,进一步深化了对ADO代谢途径的理解。这些结果为将ADO代谢作为联合免疫治疗的靶点提供了理论基础,尤其是在“冷肿瘤”转变为“热肿瘤”并提高免疫反应的潜力。尽管研究存在局限,但为EGFRvIII在CRC中的分层诊断和个性化治疗提供了重要启示。
Sun F, Yao F, et. al. Targeting adenosine enhances immunotherapy in MSS colorectal cancer with EGFRvIII mutation. J Immunother Cancer. 2025 Feb 13;13(2):e010126.
排版编辑:肿瘤资讯-Kingsley











 苏公网安备32059002004080号
苏公网安备32059002004080号


