
重型再生障碍性贫血(SAA)作为一种重度骨髓衰竭性疾病,虽然经典免疫抑制治疗(IST)方案已显著改善了SAA患者的生存率,但仍面临着高复发率、缓解率低以及潜在的克隆转变风险等挑战。艾曲泊帕作为一种口服、小分子血小板生成素受体激动剂(TPO-RA),通过与人血小板生成素受体(TPO-R)的相互作用,诱导骨髓祖细胞增殖和分化,增加血小板的生成,为SAA患者提供了新的治疗选择。然而,艾曲泊帕的潜在肝毒性风险一直是临床应用中需要关注的问题。基于此背景,江苏省人民医院何广胜教授及其团队开展了一项关于“中国SAA患者接受IST联合低剂量艾曲泊帕治疗:肝损伤轻微加重”的研究,旨在评估中国SAA患者在接受低剂量艾曲泊帕联合标准IST治疗时肝损伤的真实发生率和严重程度。【肿瘤资讯】特别邀请何广胜教授接受采访,围绕该研究的背景、设计、结果及其对临床实践的启示进行详细解读,详情如下。

专家简介
江苏省人民医院 南京医科大学第一附属医院
血液科副主任 造血功能衰竭症首席专家
江苏省预防医学会血液病预防与控制专业委员会主任委员
江苏省研究型医院学会贫血分会主任委员
江苏省成人罕见病治疗控制中心PNH质量控制组组长
Blood Adv, Ann Hematol, Cell Transplant, Hematol审稿专家
《中国实用内科杂志》常务编委
国家卫健委本科生“规划教材-内科学”编委
中华医学奖二等奖
苏州大学“陈金荣生命科学英才奖”
至2024年被引用4092次,H指数31
SAA治疗的挑战与机遇:突破瓶颈的迫切需求
何广胜教授:SAA是一种重度骨髓造血功能衰竭综合征,其治疗策略主要包括异基因造血干细胞移植(allo-HSCT)和强化IST。对于不适合进行allo-HSCT的患者,临床普遍采用强化IST方案。然而,强化IST在有效率提升以及远期克隆演变控制方面,始终面临着巨大挑战。艾曲泊帕作为一种口服、合成非肽类小分子药物,能够有效促进造血干/祖细胞的增殖。已有多项临床试验证实,艾曲泊帕与强化IST联合应用可显著提高SAA患者的治疗有效率以及生存率。
艾曲泊帕的代谢过程主要依赖肝细胞色素P450(CYP)1A2、CYP2C9同工酶、二磷酸尿苷-葡萄糖醛酸转移酶(UGT)1A1和UGT1A3,这使得其存在潜在的肝毒性风险。在早期应用于免疫性血小板减少症(ITP)患者时,艾曲泊帕的肝毒性问题已被发现,美国食品药品监督管理局(FDA)因此在其说明书中增加了黑框警告。在既往临床试验中,欧美患者使用的艾曲泊帕剂量较大,同样出现了不同程度的肝毒性问题。然而,由于亚洲人群对艾曲泊帕的代谢比例低于欧美人群,实际亚洲人群(包括中国人)使用的艾曲泊帕剂量仅为欧美人群的一半。因此,探究中国人群使用较低剂量艾曲泊帕时的肝毒性状况显得尤为重要。此外,肝毒性的严重程度直接关系到患者每日艾曲泊帕的服用剂量以及用药时长。有鉴于此,本研究团队开展了一项前瞻性注册研究,旨在观察较低剂量(75 mg/天)的艾曲泊帕联合强化IST治疗,在中国SAA患者中的治疗效果及肝毒性反应情况,以期为临床医生提供更准确的用药指导,优化治疗方案,更好地平衡治疗效果与安全性。
研究设计与结果:低剂量艾曲泊帕联合IST方案的安全性验证、
何广胜教授:这是一项前瞻性注册研究,从2014年10月至2023年9月共纳入了145例成人SAA患者。根据治疗方案,将患者分为IST+艾曲泊帕组(63例患者)和IST单药组(82例患者),且两组患者基线临床特征平衡。在r-ATG给药后6个月内动态监测肝功能指标,如丙氨酸氨基转移酶(ALT)、天门冬氨酸氨基转移酶(AST)、碱性磷酸酶(ALP)、γ-谷氨酰转肽酶(GGT)和总胆红素(TBIL)。
研究结果显示,ALT、AST、ALP、GGT和TBIL的升高主要发生在r-ATG治疗后1个月内。经过治疗,肝损伤逐渐好转。两组中ALT、AST、ALP、GGT和TBIL水平升高的中位持续时间为:分别为1.5(1~3)vs 2.5(1~5)周、2(1~4)vs 2.5(1~5)周、3(2~8)vs 4.5(1~8)周、5(1~8)vs 4(1~12)周和4(1~9)vs 4.5(1~7)周。 治疗后6个月内,两组肝功能损害发生率及持续时间无显著性差异。
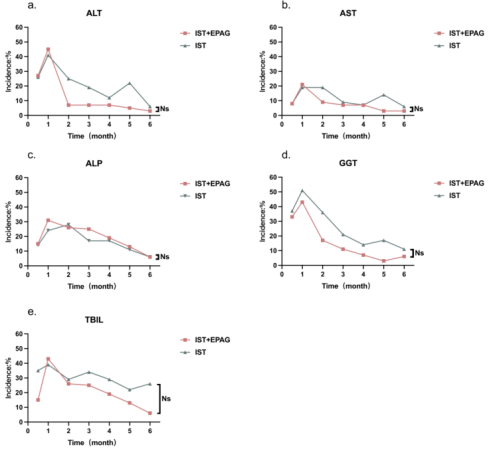
和TBIL(1-e)的异常情况
表1.IST+艾曲泊帕组和IST单药组肝功能指标异常的发生率和持续时间
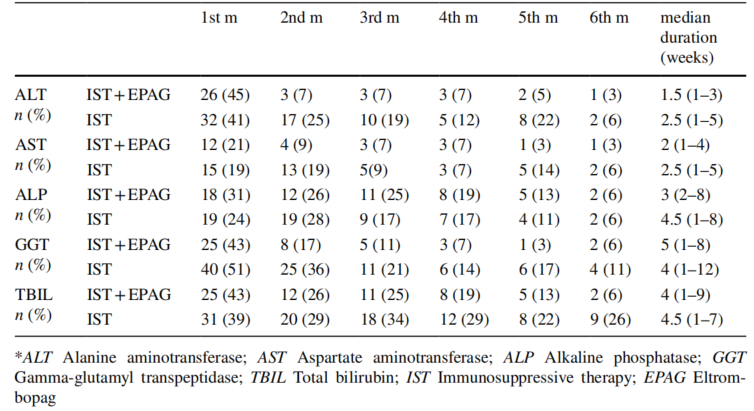
此外,在IST+艾曲泊帕组中,所有肝细胞型和胆汁淤积型药物性肝损伤(DILI)事件均发生在r-ATG后的4个月内。在IST组中,r-ATG后2个月内观察到DILI事件,包括肝细胞型、胆汁淤积型和混合型。在第1个月,肝细胞型DILI是主要类型。在第1个月和第2个月,IST+艾曲泊帕组的DILI发生率略高于IST组,但无统计学显著差异:6(10%)vs 4(5%)(P=0.400),4(9%)vs 6(8%)(P=1.000)。在第3个月(3例患者)(7% vs 0%,P=0.088)和第4个月(1例患者)(2% vs 0%,P=1.000),IST+艾曲泊帕组仍有DILI发生,均为胆汁淤积型。
研究还进一步观察了艾曲泊帕与环孢素联合应用的情况。环孢素作为一种免疫抑制剂,本身对肝细胞和胆红素代谢具有潜在影响。结果显示,在艾曲泊帕联合治疗组中,部分患者因DILI导致环孢素减量或停用。然而,这一现象在单用免疫抑制治疗组中也有所出现,且两组的总体发生率并不高。因此,目前看来,艾曲泊帕并未显著增加DILI的发生率,对环孢素的广泛应用影响有限。
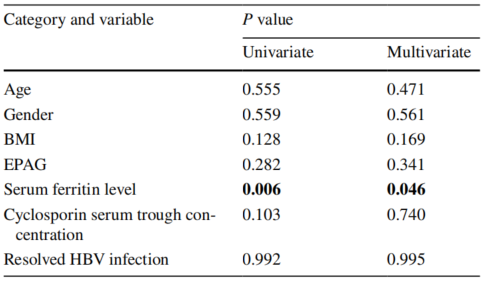
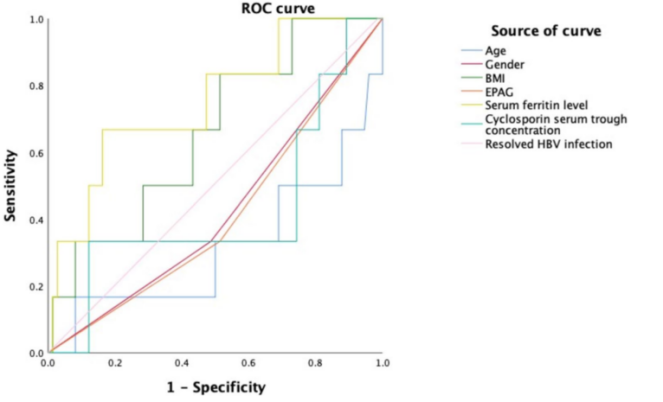
此外,研究对145例SAA患者治疗1个月后发生DILI的危险因素进行了分析。单变量和多变量logistic分析显示,血清铁蛋白水平是DILI的影响因素。发生DILI的患者血清铁蛋白水平较高(中位数:1329.30 ng/ml vs 678.75 ng/ml)。使用ROC曲线评估第1个月时DILI的预测因素。年龄、性别、BMI、艾曲泊帕、已清除的乙型肝炎感染和血清铁蛋白水平的曲线下面积(AUC)分别为0.316、0.423、0.658、0.410、0.529和0.752。在约登指数最大值时,血清铁蛋白水平的最佳阈值为1204.45ng/ml。血清铁蛋白水平的敏感性和特异性分别为66.7%和83.8%。未发现治疗前因素(包括年龄、性别、BMI、艾曲泊帕、环孢素血清谷浓度和已清除的HBV感染)可预测第1个月的DILI。
表2. 第1个月DILI发生率的单因素和多因素分析
临床指导意义:打破肝毒性顾虑,优化治疗策略
何广胜教授:低剂量艾曲泊帕联合IST方案未显著加重SAA患者的肝损伤,这一发现具有重要的临床意义。首先,合理控制药物剂量是至关重要的。鉴于亚洲人群的药物清除率比其他人群低33%~52%,本研究采用了75 mg/天的较低剂量。这一策略有效减轻了药物代谢负担,减少了肝脏的代谢压力,从而降低肝毒性风险。尽管研究结果显示,肝毒性事件的发生率有所上升,但总体程度并不严重。因此,在应用艾曲泊帕的过程中,仍需严密监测肝功能指标的变化,以确保治疗的安全性。
其次,艾曲泊帕具有独特的铁螯合作用。如前所述,血清铁蛋白水平与肝损伤存在一定相关性。铁蛋白主要在肝脏中合成并贮存,其水平升高会增加肝毒性风险。艾曲泊帕通过螯合体内铁离子,能够减轻铁蛋白对肝脏的潜在损害。因此,尽管艾曲泊帕可能在一定程度上增加了肝脏的代谢负担,但其铁螯合作用却有助于缓解肝脏损伤。
此外,研究发现,主要的肝损伤事件多发生在治疗后的第一个月内,这可能与强化免疫抑制治疗初期使用的药物种类较多有关。例如,抗真菌药物的预防性使用以及更频繁的血细胞输注,均可能增加肝损伤的风险。红细胞输注会增加铁蛋白在肝脏的沉积,进而加重肝损伤。因此,这些因素可能是导致肝损伤的主要机制。通过使用较低剂量的艾曲泊帕,患者能够更长时间地接受这一促血小板生成药物的治疗,包括与环孢素的联合应用,从而实现更好的治疗效果。同时,通过动态且严格的监测肝细胞损伤的发生,并及时进行药物干预或调整艾曲泊帕及环孢素的剂量,能够有效减少肝损伤的发生。
综上所述,优化药物剂量和制定更个体化的治疗方案是未来研究的重要方向。一方面,这将有助于显著改善患者的病情;另一方面,通过降低肝毒性等不良反应的发生率,进一步提升治疗的安全性和有效性。
未来展望:SAA治疗将朝着精准医疗和个体化治疗大步迈进
何广胜教授:未来SAA治疗领域的研究将更加注重精准医疗和个体化治疗。首先,我们将通过新的检测手段,如基因检测,更精准地识别患者的不同亚群,以实现个体化治疗。例如,针对适合异基因造血干细胞移植或脐血移植的患者,我们可以制定相应的移植策略;而对于不适合移植的患者,则可以在强化IST方案的基础上,联合使用不同的TPO-RA。鉴于各TPO-RA均有其独特的优势与不足,我们将致力于优化组合方案,以发挥其最大疗效。
其次,在艾曲泊帕的应用方面,目前的临床试验通常在6个月后停止治疗方案。然而,本研究表明,较低剂量的艾曲泊帕具有良好的安全性,这为延长其用药时间提供了可能性。事实上,更长时间和足剂量的艾曲泊帕应用已被证实能够显著提高IST的疗效,因此,延长艾曲泊帕治疗时间将是未来重要的策略方向。
再次,本研究已经揭示了血清铁蛋白水平与肝毒性之间的相关性。艾曲泊帕具有铁螯合作用,不仅有助于减轻肝损伤,还能在造血微环境中减少铁沉积,从而促进造血恢复。目前,艾曲泊帕的使用剂量为75mg/天,未来是否可以增加至100mg/天,以在不显著增加肝毒性的情况下进一步提高疗效。这将是未来值得深入研究的方向。
此外,近年来,随着部分新型免疫抑制剂和促血小板生成药物的陆续上市。我们期待这些药物能够与现有治疗方案形成更优化的联合治疗策略,从而进一步改善SAA的整体疗效和预后。
综上所述,本研究表明,低剂量艾曲泊帕联合IST在中国SAA患者中未显著增加肝毒性损伤。这一发现为临床治疗提供了新的思路和依据。未来,我们将继续探索个体化治疗、药物剂量优化以及新型联合治疗方案,以期为SAA患者带来更好的治疗效果和生活质量。
Chen X, Yu Q, Qin C T, et al. Combining immunosuppressive therapy with low dosage eltrombopag in Chinese patients with severe aplastic anemia: mild aggravation of hepatic injury[J]. Annals of Hematology, 2025: 1-8.
关于【凝血TALK】专栏
【凝血TALK】专栏聚焦出凝血相关疾病的前沿进展、临床实践与热点问题,旨在进一步推动出凝血疾病的精准治疗与患者管理。每期【凝血 TALK】将邀请领域内知名专家,探讨出凝血疾病治疗的最新进展,分享研究数据、临床经验和治疗策略,促进学术交流,推动规范化诊疗。
排版编辑:Zika












 苏公网安备32059002004080号
苏公网安备32059002004080号


