神经营养性酪氨酸受体激酶(neurotrophic receptor tyrosine kinase,NTRK)基因融合是婴儿纤维肉瘤(IFS)及其他多种儿童肉瘤的关键驱动因素【1】。此外,NTRK基因融合还涉及多种儿童肿瘤类型,包括胶质瘤、甲状腺癌、先天性中胚层肾母细胞瘤(CMN),以及2020年世界卫生组织最新分类的NTRK重排梭形细胞肿瘤【2】。IFS是一种罕见的软组织肉瘤,普遍存在激酶激活突变,其中大约85%的患者存在ETV6-NTRK3融合【3】。临床上,IFS 多表现为局部单发无痛性肿块,不过也有少数转移病例的相关报道【4】 。尽管手术切除通常可以治愈,但婴儿常常出现快速生长且无法切除的肿瘤,需要全身治疗【5】。除了甲状腺癌和CMN之外,其他携带NTRK融合的儿童患者的治疗和结果数据仍非常有限【6】。
拉罗替尼是一种同类首个、高度选择性、与肿瘤类型无关的原肌球蛋白受体激酶(TRK)抑制剂,已获得美国食品药品监督管理局批准,用于治疗缺乏其他满意治疗方案或在治疗后病情进展的NTRK基因融合阳性实体瘤患者【7】。该批准基于在儿童和成人中广泛的NTRK基因融合阳性癌症中75%的缓解率【8】。然而,这些试验中的大多数患者都有复发或难治性疾病,拉罗替尼作为一线治疗的系统性评估尚未进行【9】。此外,目前对于拉罗替尼在儿童患者中的最佳治疗持续时间以及可能的长期不良反应还不明确【7】。
儿童NTRK基因融合肿瘤的治疗正迎来精准医疗时代的重大突破。随着两项关键临床研究ADVL1823和SCOUT/NAVIGATE的发布,拉罗替尼作为高选择性TRK抑制剂在儿童肿瘤治疗中展现出卓越的疗效和安全性。本期特邀中国医科大学附属盛京医院肿瘤中心蔡炜嵩教授,从临床实践、治疗策略及患者管理等多维度,深入解读拉罗替尼在儿童NTRK基因融合肿瘤中的应用价值。
CSCO血管靶向委员会委员
辽宁省抗癌协会血管靶向专委会副主委
第五肿瘤病房负责人
美国南加州大学血液肿瘤专业博土后出站,曾在香港大学研修主持国家自然科学基金、辽宁省重大科技专项等多项课题
中华医学会小儿外科分会小儿肿瘤学组委员
中国抗癌协会小儿肿瘤专委会内科学组委员
中国抗癌协会肿瘤心理专委会青委
中国研究型医院协会胶质瘤专委会委员
美国癌症协会会员
国际小儿神经母细胞瘤研究进展委员会常委
辽宁省生命关怀协会肿瘤专业委员会副主委、秘书长等
ADVL1823:一线治疗的突破【10】
ADLV1823研究是一项临床2期研究,纳入了33例儿童患者,其中18例为IFS,15例为其他实体瘤患者。根据治疗缓解和手术可切除性,患者接受6-26个周期的拉罗替尼治疗(每日2次,28天为1个周期)。研究旨在评估拉罗替尼用于新确诊NTRK基因融合阳性肿瘤患者时,基于治疗反应调整治疗时长以及结合局部控制的效果。研究的主要终点是评估儿童IFS患者在6个治疗周期内达到的客观缓解率(ORR)以及其他组织学类型确诊患者的疗效,次要终点是无时间生存期(EFS)和总生存期(OS)。
缓解
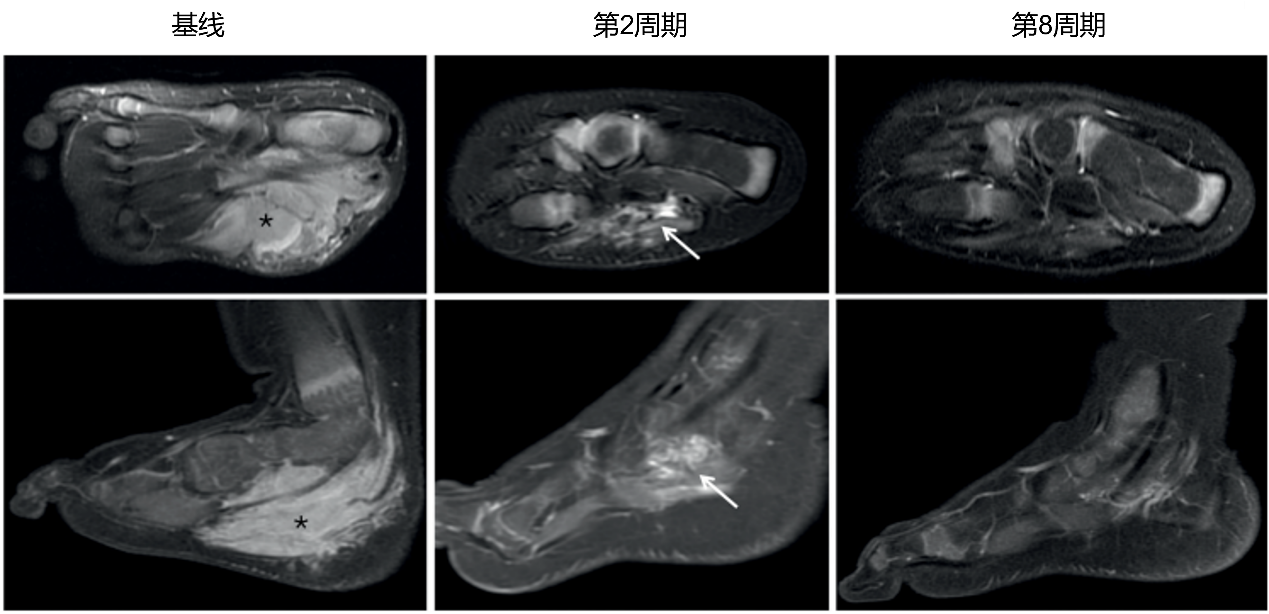
队列A在6个周期内的ORR为94%。在第1至6个周期内部分缓解(PR)的4例患者在第6个周期后确认为完全缓解(CR),因此治疗的ORR为100%。队列B在6个周期内的ORR为60%。在第1至6个周期内疾病稳定(SD)的2例患者在第6个周期后确认为缓解,因此治疗的ORR为73%。其中,NTRK重排的梭形细胞肿瘤患者ORR为71%,CMN患者ORR为100%,低级别胶质瘤患者ORR为33%,炎性肌纤维母细胞瘤患者ORR为100%。(图1)图2展示了一例IFS患者的影像学表现。
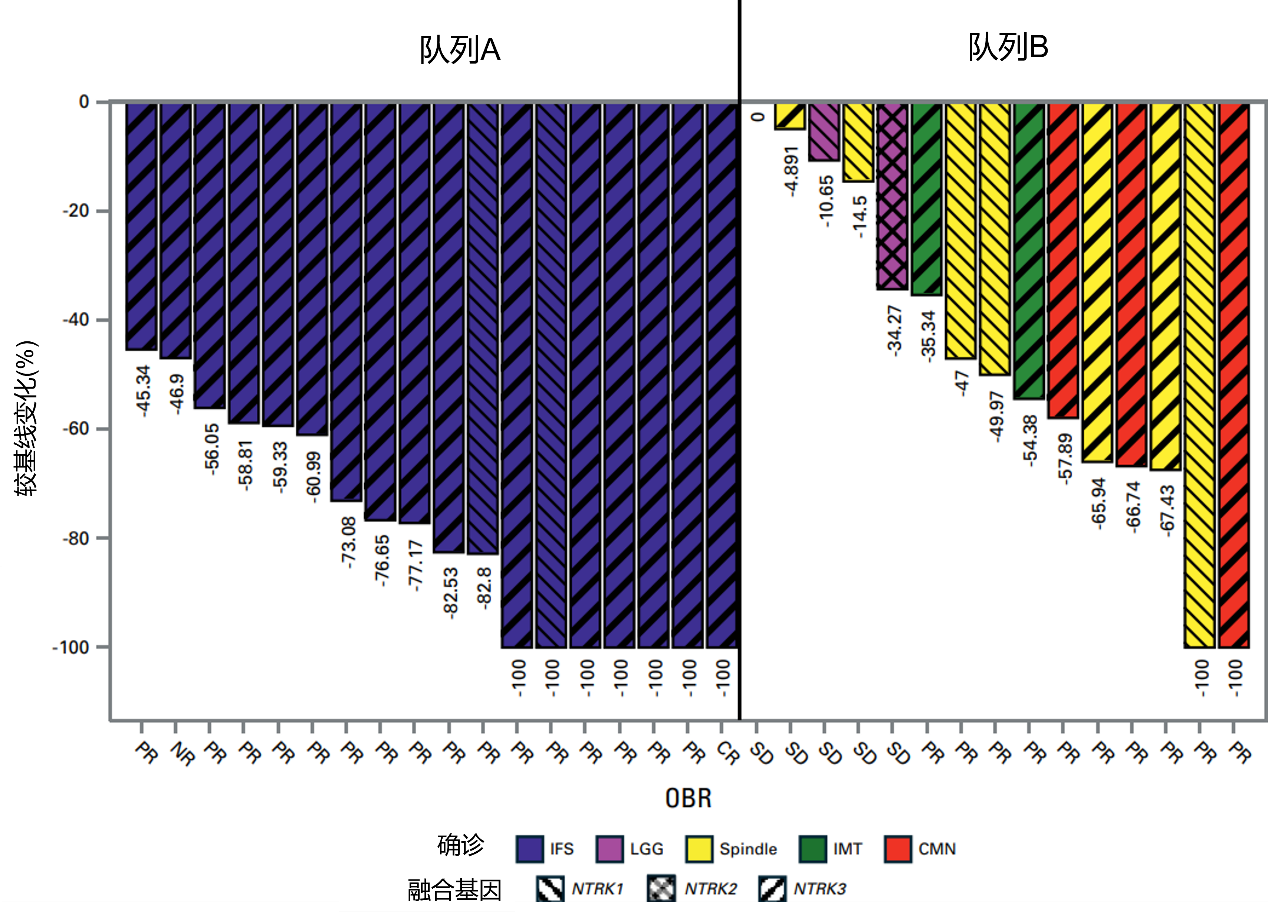
将所有IFS患者和7例NRTK重排的梭形细胞肿瘤患者作为一个亚组,ORR为92%。其中,48%患者在研究期间接受手术切除;除1例完全切除患者外,所有患者均在手术时停药。在停药后中位随访时间18个月后仍无事件发生。
生存结局
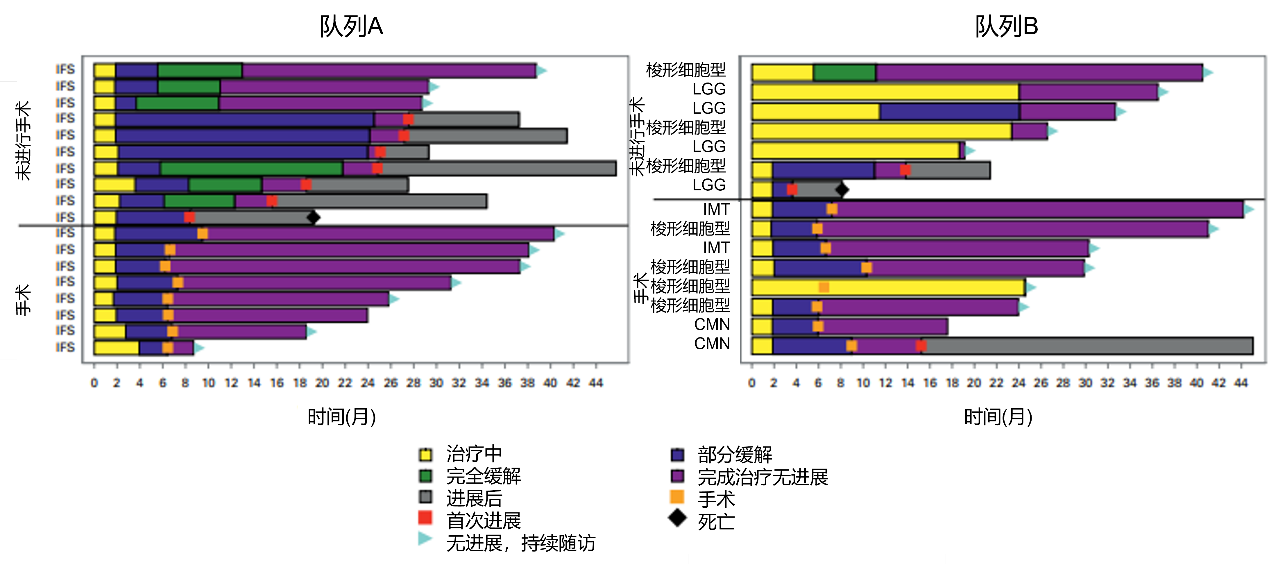
队列A的2年EFS率和OS率分别为82.2%和93.8%,队列B的2年EFS率和OS率分别为80.0%和93.3%(图3)。治疗期间,33例患者中有2例患者经历疾病进展,最后死于疾病。

在因无疾病进展而停药的患者中,接受手术的患者在治疗结束后的EFS率更高(P=0.002)。在队列A中,8例(47%)患者在经过7个治疗周期后,对最初不可切除的肿瘤进行手术,并且在中位随访21个月时未出现疾病进展。其余患者未进行手术。在未进行手术的患者中,3例在中位随访时间18个月时仍无事件发生,而6例患者在停药后4个月内原发部位出现疾病进展。在队列B中,57%患者在7个治疗周期后对最初不可切除的肿瘤进行手术,其中仅1例患者在停药后约6个月原发部位出现疾病进展;其余患者未进行手术。在未进行手术的患者中,各有2例患者评估为完全缓解、部分缓解、疾病稳定。(图4)
安全性
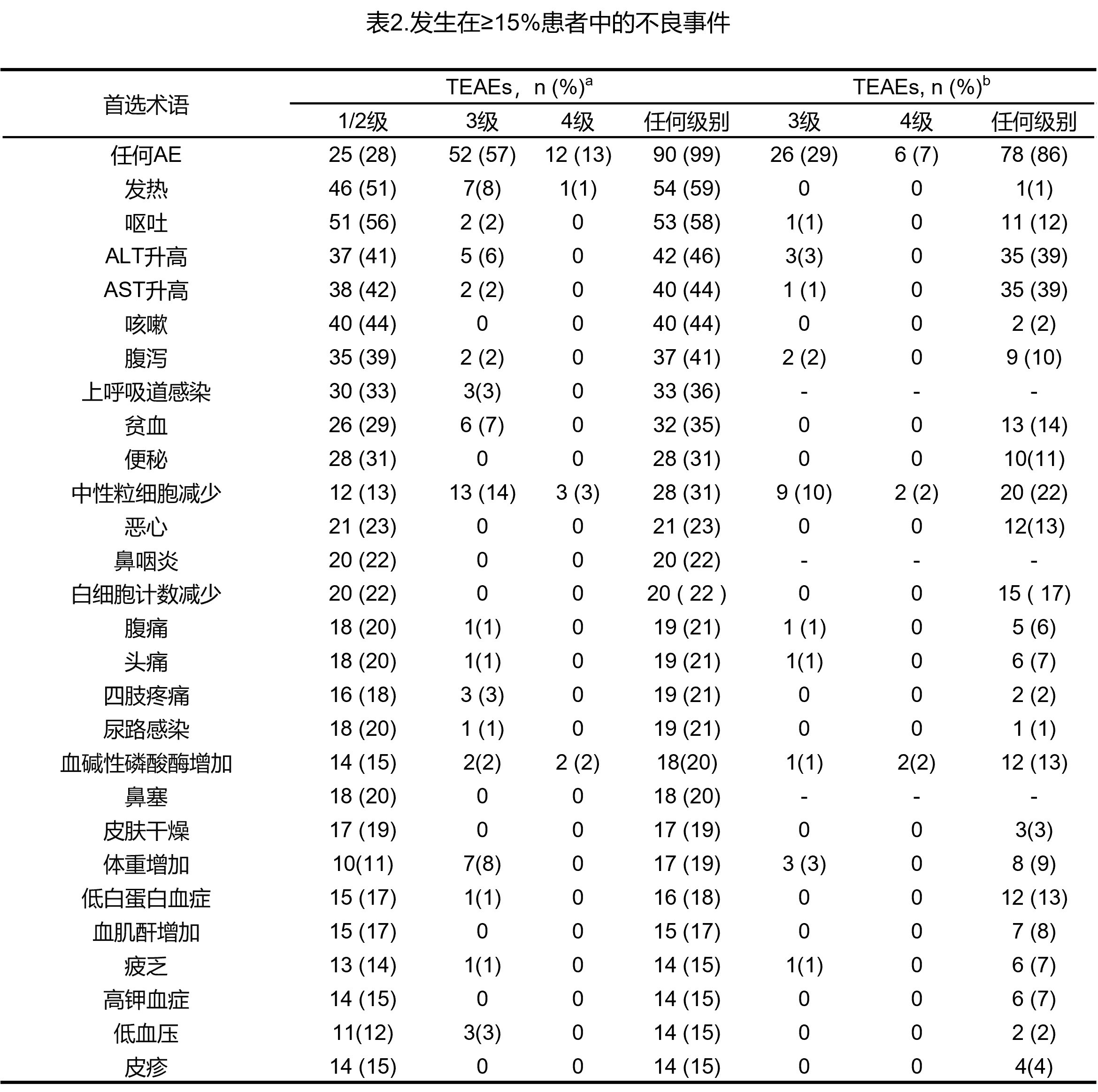
共有11例患者发生≥CTCAE 3级不良事件(表1)。仅在≥1例患者中发生≥3级治疗相关不良事件是中性粒细胞计数减少,共发生6起。4例不良事件(2例中性粒细胞减少症、1例天冬氨酸氨基转移酶[AST]升高和1例体重减轻)是剂量限制性毒性,并导致剂量中断和减少。所有患者均恢复治疗,同时没有患者因不良事件而停药。
发生≥3级治疗相关不良事件的所有患者,其首次发生相应不良事件的时间均在治疗的前4个周期内,除1例患者是在第8个周期出现3级体重增加。未报告其他≥3级体重增加情况。在中位12个治疗周期内未观察到其他累积毒性。

手术结局
在16例既往未发生疾病进展且在中位7个周期治疗后进行手术切除的患者中,15例(队列A:8例,队列B:7例)报告切缘阴性(R0),1例(队列B)患者切缘阳性(R1)。所有R0患者在手术时停药,而R1切除的NTRK重排的梭形细胞瘤患者恢复了治疗,并根据方案完成26个周期的治疗。1例患者在术后出现神经功能障碍。未报告其他手术并发症或伤口并发症。
在6例接受研究期间手术切除的患者中评估切缘状态。与机构审查相反,中心审查显示,他们的手术切面均存在接受治疗的肿瘤床,其中5例未发现存活或TRK免疫组化阳性的肿瘤细胞。尽管达到R1切除,但在停药后(中位随访21个月),这6例患者均无事件发生且未进一步治疗。
治疗缓解
在8例拉罗替尼治疗后进展再次接受治疗的患者中,6例报告再次接受治疗的缓解情况。3例CR,2例PR,1例SD,1例因在复发时先进行手术而无法评估,1例未报告后续影像学数据。除拉罗替尼和/或手术切除之外,停药后出现疾病进展的患者无需接受其他后续治疗,所有患者都存活并在随访中。
小结
拉罗替尼在新诊断的NTRK基因融合阳性实体瘤患者中具有高度抗肿瘤活性。对于IFS及其他NTRK基因融合阳性实体瘤的患者,拉罗替尼应作为一线治疗选择。对于IFS患者而言,通过手术切除实现局部控制仍然至关重要。
SCOUT/NAVIGATE:治疗中断与再治疗的探索【7】
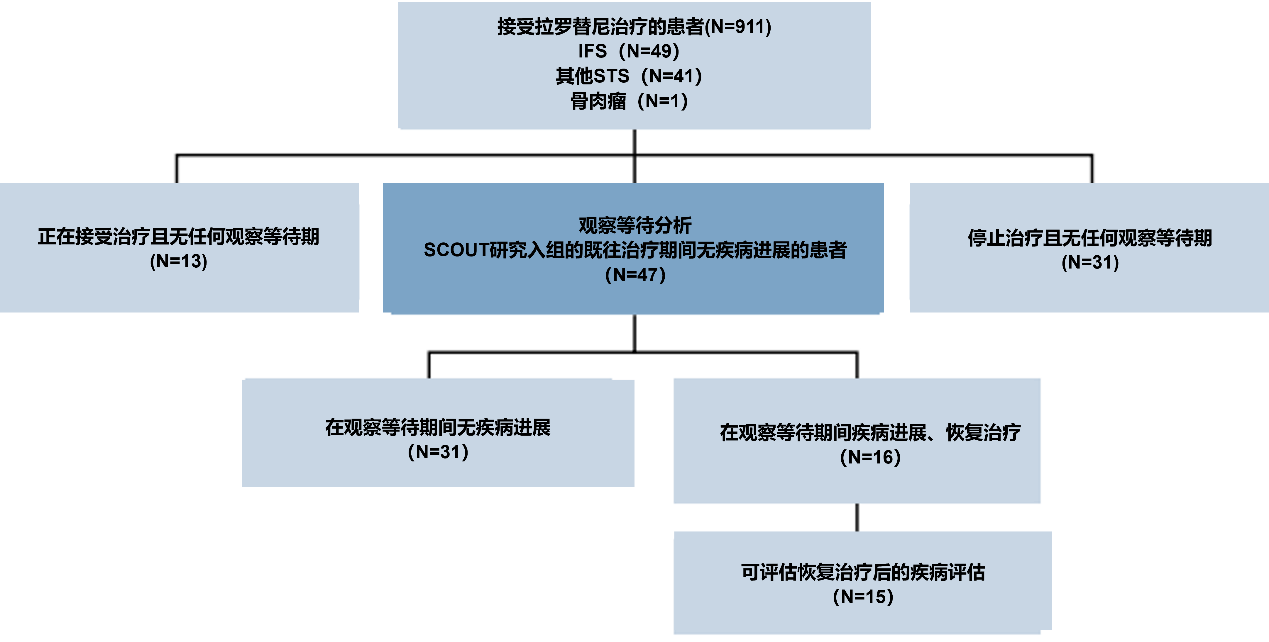
Mascarenhas L等人评估了两项临床试验(SCOUT和NAVIGATE)中拉罗替尼治疗TRK融合肉瘤及相关儿童的安全性和有效性,以及在疾病无进展时选择停药的患者结局。研究共纳入91例儿童患者,其中49例为IFS,41例为各种其他软组织肉瘤/相关间叶组织肿瘤(STS),和1例骨肉瘤。
安全性和耐药性
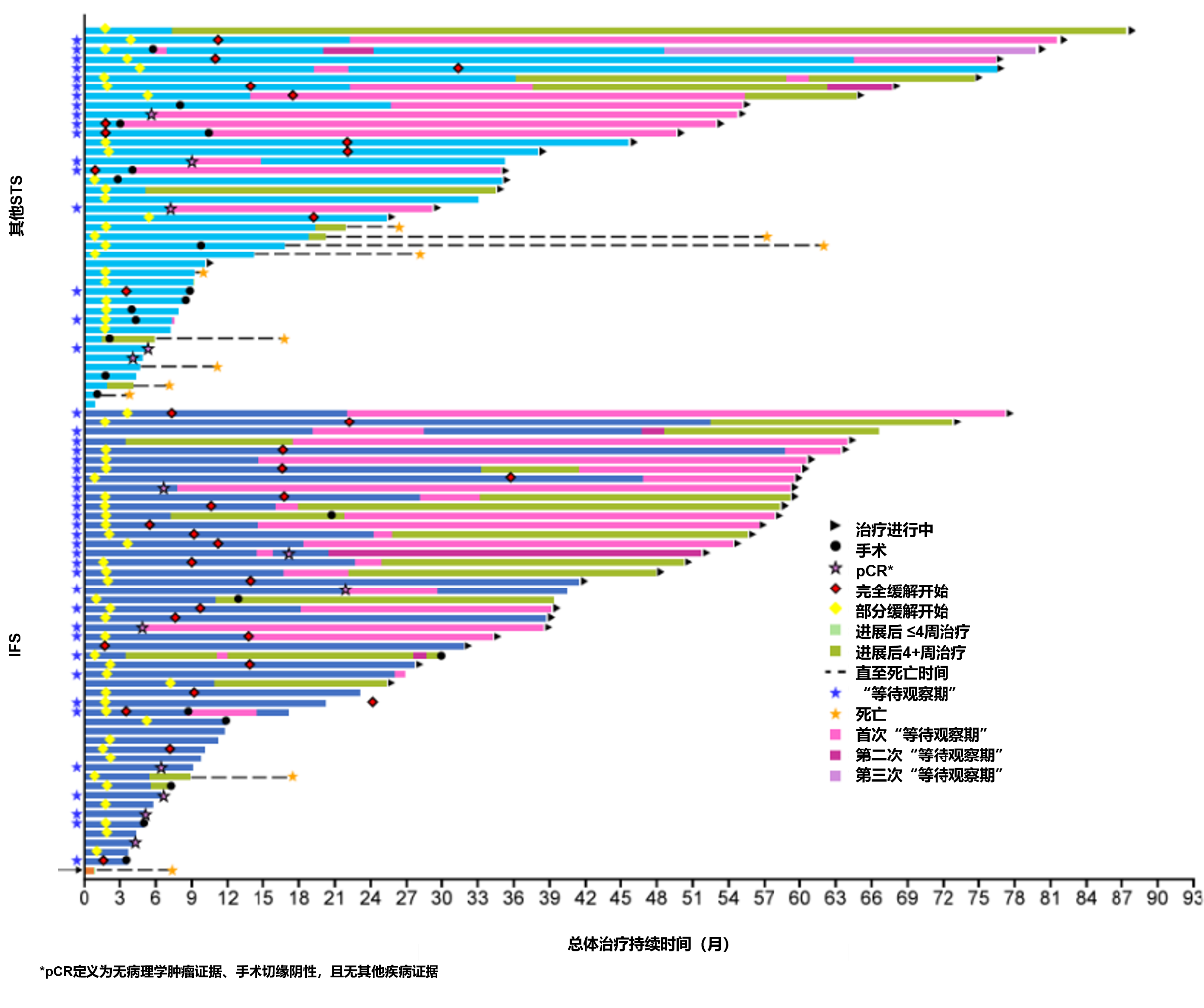
91例患者的治疗持续时间为1-87+个月(图5)。分别有23例(25%)和23例(25%)患者的治疗相关不良事件最高为1级或2级(表2)。
疗效结局
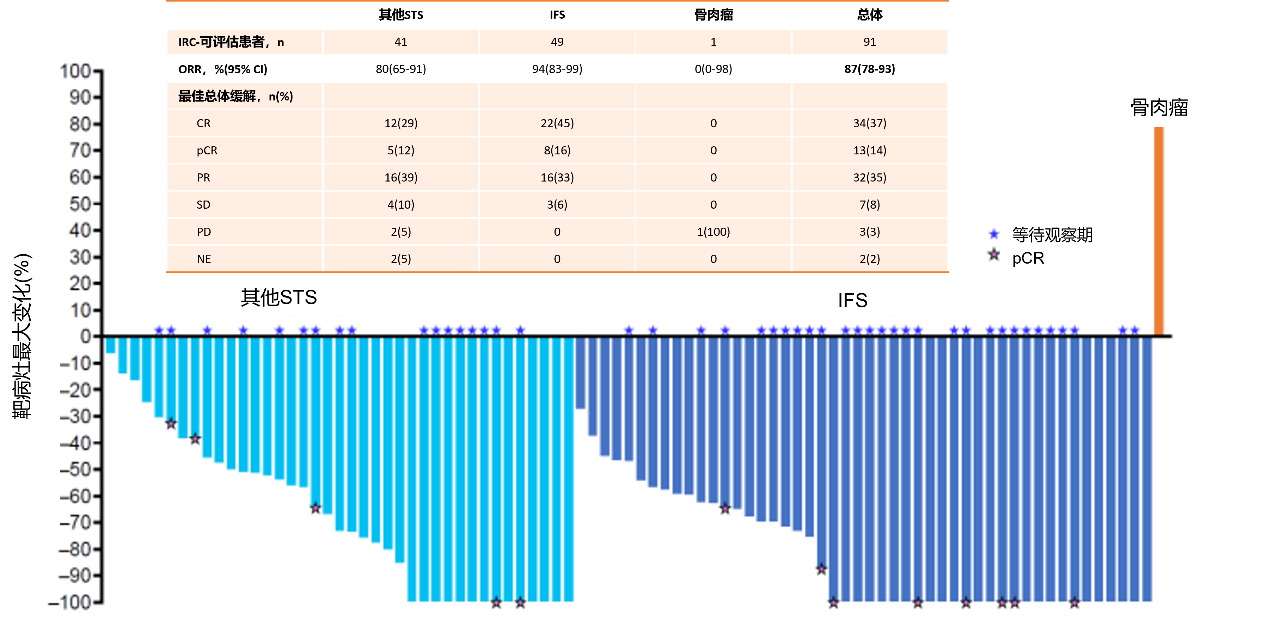
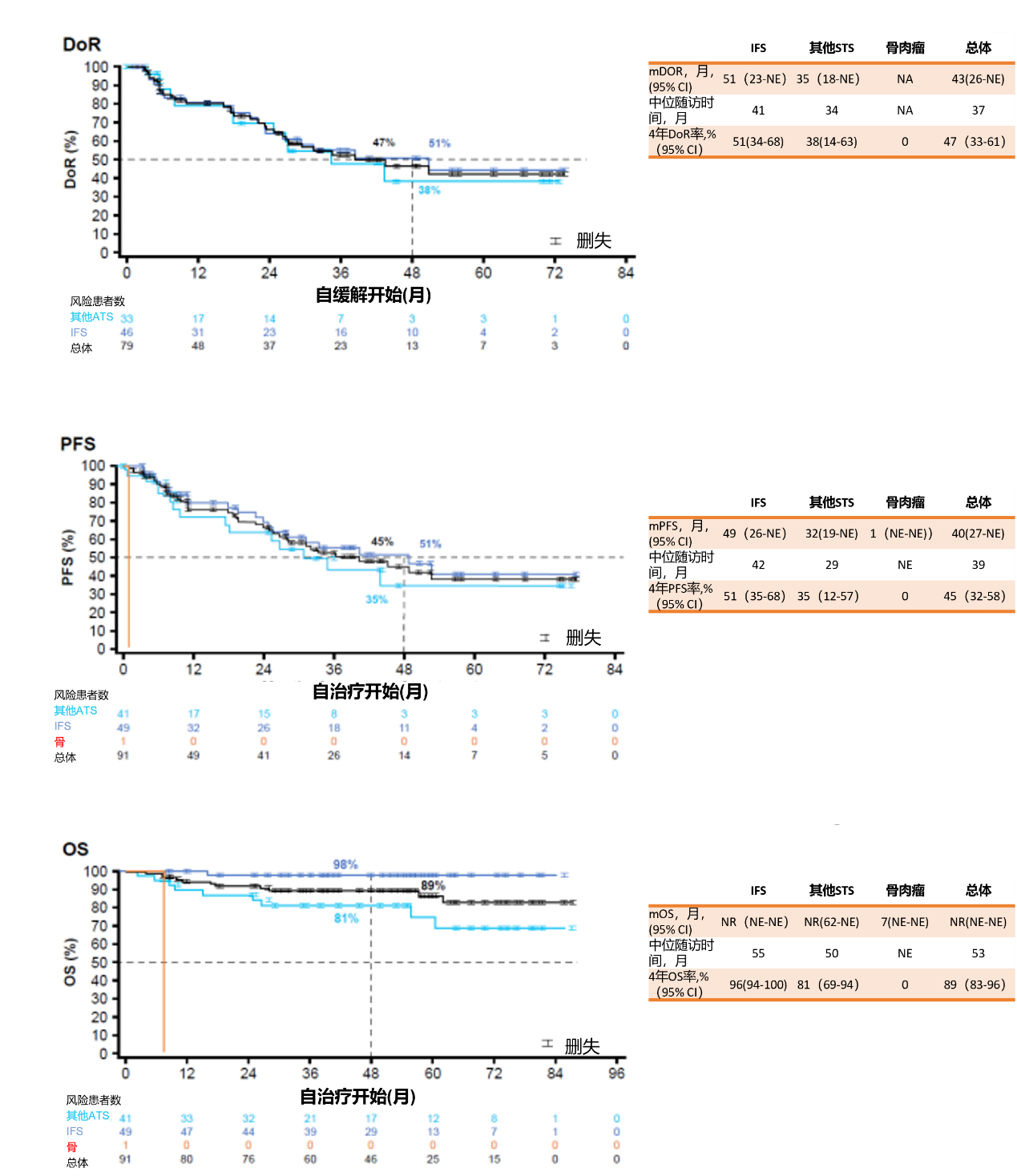
总体ORR为87%(CR:47%,PR:32%,PD:3%,SD:8%,未评估:2%),中位持续缓解时间(mDoR)、中位无进展生存期(mPFS)分别为43个月、40个月,中位总生存期(mOS)未达到。IFS患者的mDoR、mPFS分别为51个月、49个月,mOS未达到,4年OS率为96%;其他STS患者mDOR、mPFS分别为35个月、32个月,mOS未达到,4年OS率为81%;骨肉瘤患者的mPFS和mOS分别为1个月、7个月。(图6-7)
等待观察分析
47例患者进入等待观察期;30例(64%)患IFS,17例(36%)患其他STS(图8);8例(17%)转移性疾病患者,39例(83%)局部晚期疾病患者。所有患者从拉罗替尼初始治疗至停药的中位时间为14.7个月,IFS患者为17.2个月,其他STS患者为9.0个月。21例(45%)患者在肿瘤切除术后停药。其中,11例为R0切除(包括10例病理学完全缓解[pCR])、8例为R1切除(显微镜下残留肿瘤)、1例为R2切除(肉眼下残留肿瘤)和1例手术结局不详。这21例手术患者从初始治疗开始至停药的中位时间为6.9个月。26例(55%)未进行手术的患者在达到CR(n=15)、PR(n=10)或SD(n=1)后中位至停药时间为19.8个月。
16例(34%)患者在停药后记录到疾病进展,从拉罗替尼停药至疾病进展的时间为<3个月(9例)、3-<6个月(3例)、6-<12个月(2例)、12-<18个月(1例)和≥24个月(1例)。中位随访41.3个月,在47例患者中,中位进展时间尚未达到(图9)。

21例接受手术的患者和未接受手术的患者从停药至疾病进展的中位时间均未达到,IFS或其他STS患者中位时间相似(图10)。
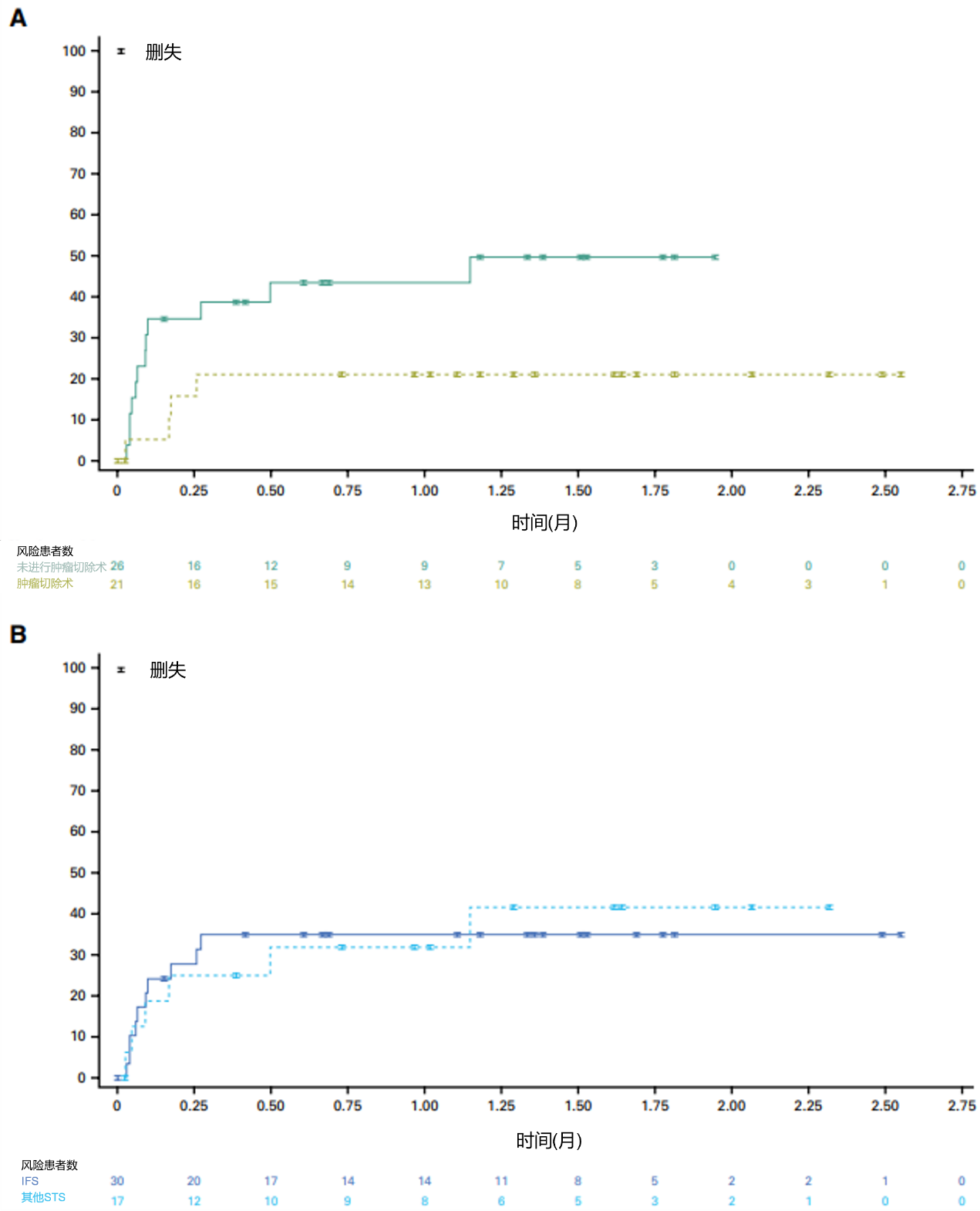
图10. 等待观察分析中,根据手术状态、组织学类型分类的患者从停药到疾病进展的时间
16例进展/复发的患者在等待观察期间恢复拉罗替尼单药治疗后,11例患者(69%)达到客观缓解(5例CR和6例PR[2例待确认]),4例患者为SD。1例患者重新开始治疗,随后进行手术,因此未确定最佳总体缓解。在数据截止时,观察队列中的所有47例患者均存活。
小结
拉罗替尼在患有TRK融合肉瘤的儿童中显示出持久的疗效和良好的安全性。对于达到客观缓解的患者中,停药是可行的,且在选择停药后出现疾病进展的患者中也观察到了临床益处。
专家点评
NTRK基因融合是多种儿童肿瘤的关键的致癌驱动因素【1】。传统上,IFS患者多采用长春新碱和放线菌素为基础的化疗方案【11】。然而,这种治疗方式存在诸多问题,在一项大型前瞻性研究中,27 例不可切除的IFS患者ORR为62.9%,但治疗负担沉重,有患者死于毒性反应,部分出现严重并发症,如静脉闭塞性疾病、肢体截肢等【5】。对于其他NTRK基因融合阳性的儿童肿瘤,除甲状腺癌和CMN外,已发表的治疗和预后数据非常有限。
在这两项全球多中心临床试验中,拉罗替尼在儿童肿瘤治疗领域展现出了独特的优势与潜力,同时也揭示了当前研究的成果、局限以及未来的研究方向。
从治疗效果和安全性来看,拉罗替尼表现出色。在针对新诊断IFS及其他NTRK基因融合阳性实体瘤的ADVL1823研究中,其在IFS患者中的ORR高达100%,这一数据远超欧洲儿科软组织肉瘤研究组报道的长春新碱-放线菌素化疗疗效(ORR为62.9%),且起效迅速【5,10】。同时,该疗法耐受性良好,3级及以上不良事件发生率较低,主要为实验室指标异常,且均可逆,除体重增加外未观察到累积毒性【10】。在另一项关于拉罗替尼停药观察的研究中,ORR达到87%,进一步证明了其有效性【7】。在安全性方面,大部分治疗相关不良事件为1-2级,常见的3级及以上不良事件如肝酶升高多为1/2级,与已知的拉罗替尼安全性特征相符,且未出现新的安全信号【7】。
在停药策略和局部控制方面,两项研究均有所探索。ADVL1823 研究强调了局部控制对IFS的重要性,多数未进行局部控制就停药的患者在治疗后出现疾病进展【10】。但同时也发现,部分NTRK重排的梭形细胞瘤患者,包括IFS患者,在接受拉罗替尼治疗后,即使没有局部控制也能维持持久缓解【10】。在停药观察分析中,约三分之一选择性停药的患者出现疾病进展,但16例进展或复发患者中,15例(94%)在再次使用拉罗替尼后实现了疾病控制,其中11例(69%)实现客观缓解【7】。这表明对于局部肿瘤完全切除的患者,可考虑停药;对于部分经过长时间疾病缓解的患者,即使没有手术局部控制,在密切监测下选择性停药也具有一定的可行性,但还需要更长时间的随访来确定最佳治疗时长【7】。
然而,这两项研究也存在一定的局限性。样本量方面,由于相关肿瘤的罕见性,患者数量较少,可能影响研究结果的普遍性。随访时间上,目前缺乏长期数据,难以确定缓解的持久性和评估晚期毒性。此外,停药决策和停药前治疗时长因研究者的判断而异,存在一定的主观性。
尽管存在局限,拉罗替尼在儿童NTRK基因融合阳性实体瘤治疗中的表现仍值得肯定。它为儿童IFS及相关NTRK重排梭形细胞肿瘤患者提供了一种更优的一线治疗选择,能够促进局部肿瘤的非致残性手术切除。未来,需要开展更多大规模、长期的研究,深入探索预测疗效和耐药的生物标志物,明确最佳治疗持续时间,进一步优化拉罗替尼的临床应用,让更多的儿童肿瘤患者从中受益。
1. Davis JL, et al. Am J Surg Pathol. 2019 Apr;43(4):435-445.
2. Albert CM, et al. J Clin Oncol. 2019 Feb 20;37(6):513-524.
3. van Spronsen R, et al. Ann Diagn Pathol. 2022 Apr;57:151885.
4. Lagree M, et al. Arch Pediatr. 2011 Jan;18(1):28-32. French.
5. Orbach D, et al. Eur J Cancer. 2016 Apr;57:1-9.
6. Gooskens SL, et al. Pediatr Blood Cancer. 2017 Jul;64(7).
7. Mascarenhas L, et al. J Clin Oncol. 2025 Jan 27:JCO2400848.
8. Drilon A, et al. N Engl J Med. 2018 Feb 22;378(8):731-739.
9. Hong DS, et al. Lancet Oncol. 2020 Apr;21(4):531-540.
10. Laetsch TW, et al. J Clin Oncol. 2024 Dec 9:JCO2401854.
11. Orbach D, et al. Eur J Cancer. 2020 Sep;137:183-192.
审核码:MA-LAR-CN-0288-1
排版编辑:肿瘤资讯-jj











 苏公网安备32059002004080号
苏公网安备32059002004080号


