2025 年美国临床肿瘤学会胃肠道肿瘤研讨会(2025 ASCO GI) 于当地时间 1 月 23 日至 25 日在美国旧金山举行。大会传递了全球消化道肿瘤领域的最新临床研究数据,是消化道肿瘤临床诊疗的重要参考和风向标。
特邀上海交通大学医学院附属第一人民医院李琦教授对胰腺癌以及胆囊癌治疗领域重要研究进行深入点评。本次 POST ASCO GI 会议将于 2 月 25 日召开,国内权威专家将齐聚线上,深入解读胰腺癌和胆道肿瘤领域的最新研究进展,分享临床经验,共同探讨未来发展方向。
1、NAPOLI 3 研究两项事后分析有效指导转移性胰腺导管腺癌(mPDAC)患者个体化用药
本次会议报道了两项 NAPOLI 3 研究的事后分析,进一步探讨了 NALIRIFOX 方案(伊立替康脂质体+奥沙利铂+亚叶酸 +5-氟尿嘧啶)临床应用的实际问题。
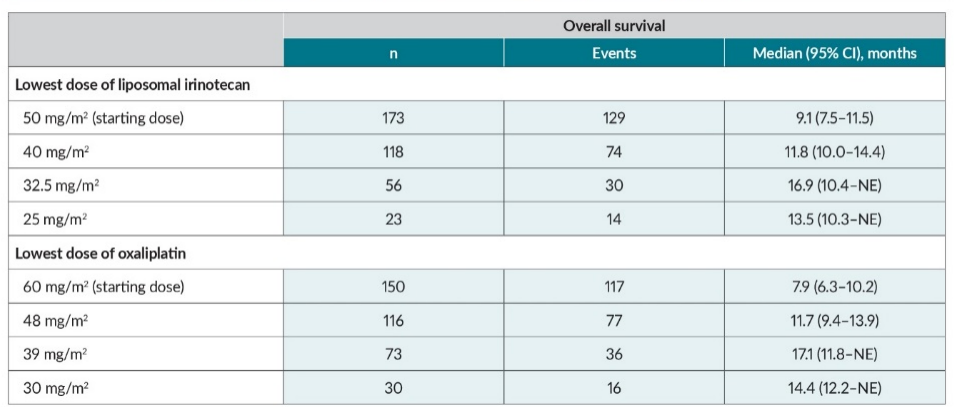
NALIRIFOX 方案剂量调整可助力延长患者生存
一项 NAPOLI 3 研究的探索性事后分析评估了 mPDAC 患者接受 NALIRIFOX 治疗方案时剂量调整对总生存(OS)的影响[1]。
结果显示,伊立替康脂质体或奥沙利铂剂量减少不影响患者的OS,剂量降低的患者具有更长的暴露持续时间和更高的累积剂量,提示 OS 延长可能和更长的治疗持续时间和剂量调整相关。该研究结果为接受 NALIRIFOX 治疗的 mPDAC 患者 OS 的优化提供了潜在路径[1]。
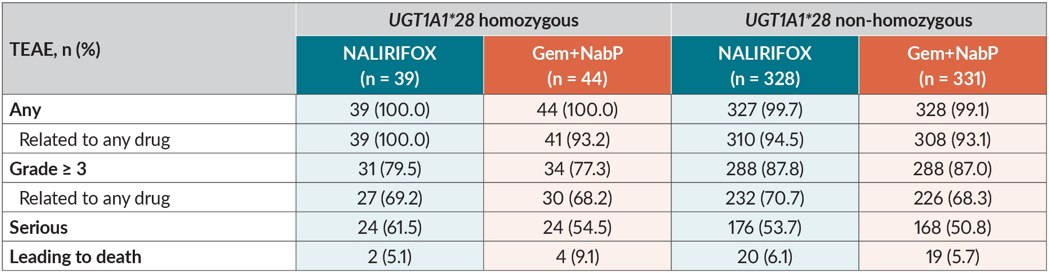
UGT1A1*28 多态性对伊立替康脂质体 TEAE 发生率以及剂量调整无实质性影响
UGT1A1*28(基因型 7/7) 纯合子和 UGT1A1 活性降低相关,纯合型患者接受非脂质体伊立替康治疗需要进行剂量调整。一项 NAPOLI 3 研究事后分析评估了 UGT1A1*28 纯合状态对伊立替康脂质体治疗出现不良事件(TEAEs)的影响。
结果显示 83 例患者(11.0%)为 UGT1A1*28 纯合子,此类患者中 TEAEs 发生率与杂合子患者相似(表 2)。在 NALIRIFOX 治疗组中,纯合子患者腹泻、恶心、呕吐、贫血等常见 TEAEs 发生率和总人群类似。且纯合子和杂合子患者因 TEAEs 停药、减量或剂量中断发生率相似(图 2)。分析证实 UGT1A1*28 多态性对 NALIRIFOX 方案的 TEAE 发生率或剂量调整需求方面没有显著影响[2]。
李琦教授点评:NAPOLI 3 研究是一项对比 NALIRIFOX 和 吉西他滨+白蛋白紫杉醇(Gem+NabP)一线治疗 mPDAC 患者疗效和安全性的 Ⅲ 期研究。结果显示和 Gem+NabP 相比,NALIRIFOX 可带来中位 OS(11.1 个月 vs 9.2 个月,HR 0.83,95%CI 0.70-0.99,P=0.036)和中位无进展生存期(PFS)(7.4 个月 vs 5.6 个月,HR 0.69,95%CI 0.58-0.83,P<0.0001)的显著改善[3]。基于 NAPOLI 3 研究结果,《中国临床肿瘤学会(CSCO)胰腺癌诊疗指南》推荐纳米脂质体伊立替康联合方案为转移性胰腺癌一线(II 级,1A 类)标准方案[4];基于 NAPOLI-1 研究,推荐 NALIRIFOX 方案为转移性胰腺癌二线治疗(I 级,1A 类)标准方案。《美国国家癌症综合网络(NCCN)胰腺癌临床实践指南》也推荐 NALIRIFOX 方案作为一线标准治疗方案[5]。NALIRIFOX 方案为预后极差的 mPDAC 患者带来有效治疗选择。
事后分析显示 NALIRIFOX 剂量调整患者的中位治疗持续时间更长,药物累积剂量更高[1]。因此,个体化剂量和持续治疗或为延长生存的重要策略。尽管该分析为描述性,无法进行统计学检验,但为临床实践中通过剂量优化平衡疗效与毒性,从而实现更佳生存获益的治疗模式提供了证据。
另一项事后分析则聚焦于 UGT1A1*28 多态性对伊立替康脂质体安全性的影响。结果显示,无论 UGT1A1*28 是纯合子还是杂合子,TEAEs 发生率相似,因 TEAEs 导致的剂量调整发生率也类似。此项分析从基因多态性角度再次证实了伊立替康脂质体的良好耐受性,并有助于简化临床流程。
综上,这两项事后分析为 NALIRIFOX 方案用于 mPDAC 患者个体化治疗的优化策略提供指导:通过动态剂量调整有助于最大化生存获益,UGT1A1*28 纯合子患者接受常规剂量伊立替康脂质体治疗同样具有良好耐受性。未来需进一步探索疗效和安全性相关的精准生物标志物,不断改善 mPDAC 患者的生存和生活质量。
2、Zoldonrasib(RMC-9805)治疗 KRAS G12D 突变 PDAC 患者初显活性
本次会议报道了 RMC-9805(一种强效口服 RAS(ON)G12D 选择性抑制剂) 治疗 KRAS G12D 突变 PDAC 患者的 Ⅰ 期研究结果。
截止至 2024 年 9 月 2 日,179 名携带 KRAS G12D 的实体瘤(58% 为 PDAC)患者接受递增剂量的 RMC-9805 治疗(每日 150-1200 mg)。没有剂量限制毒性(DLT)或 4/5 级治疗相关 AE(TRAE)发生。接受 RMC-9805 1200 mg QD 或 600 mg BID 治疗的 PDAC 患者中,客观反应率(ORR)为 30%,疾病控制率(DCR)为 80%(图 3)。在 28 名 基线循环肿瘤 DNA(ctDNA)中检测到 KRAS G12D 突变且治疗期间可评估的患者中,86% 的患者治疗后血浆 KRAS G12D 变异等位基因频率(VAF)下降超 50%,39% 实现完全清除,初步显示出药物可控的安全性和抗肿瘤活性[6]。
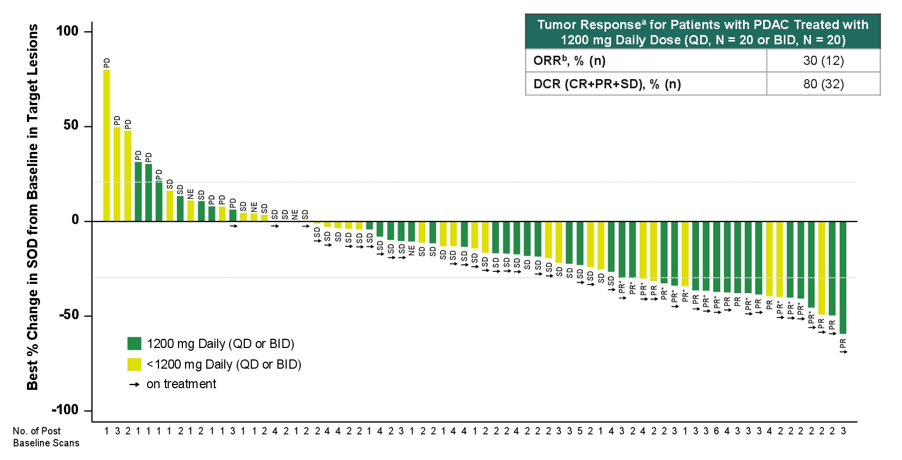
李琦教授点评:PDAC 整体预后差,二线化疗的中位 OS 仅为 6~7 个月。PDAC 是一种 RAS 驱动肿瘤,约 40% 的 PDAC 患者携带 RAS G12D 突变,因此针对这一靶点的精准治疗药物是目前探索热点。RMC-9805 是一种强力的 RAS G12D 选择性共价三复合体抑制剂,可靶向癌基因 RAS G12D 异构体的活化 GTP 结合状态。此次公布的 Ⅰ 期研究中,RMC-9805 显示出良好耐受性,没有 4/5 级 AE 或严重 AE 发生。发生率超过 10% 的常见 TRAEs 包括胃肠道相关毒性(恶心、腹泻和呕吐)和皮疹。在可评估的经治 PDAC 患者中,ORR 达 30%,DCR 为 80%,初步显示出令人鼓舞的抗肿瘤活性。大多数患者出现 ctDNA KRAS G12D VAF 下降,也可证实药物的强力作用。后续进一步随访的药物长期疗效值得期待。
3、Pamrevlumab 联合化疗治疗转移性/局部晚期胰腺癌研究失败
Pamrevlumab 是一种针对结缔组织生长因子的全人源重组单克隆抗体。早期临床数据显示Pamrevlumab 联合化疗在 PDAC 中具有良好耐受性和潜在疗效。本次会议中的两项研究进一步探索了 Pamrevlumab 联合化疗在转移性和局部晚期胰腺癌患者中的疗效。
在 mPDAC 的 Ⅱ/Ⅲ 期试验中,共有 317 例患者入组,其中 213 例患者接受 Pamrevlumab + Gem + NabP 治疗(102 例为一线,111 例为二线),45 例患者接受 Gem + NabP 治疗(23 例为一线,22 例为二线),31 例患者接受 mFOLFIRINOX 治疗,28 例患者接受了其他试验药物治疗。最终分析中,Pamrevlumab + Gem + NabP 未达到 OS 主要终点(模型估计 HR 1.18,95% CI 0.88-1.56,后验 Pr[HR < 1] = 0.14,未达到预设的≥ 0.98),且无显著 PFS 或 ORR 获益[7]。
在 LAPC 的 Ⅰ/Ⅱ 期临床试验中,Pamrevlumab 联合化疗可改善患者的缓解率、手术可行性和切除率。LAPIS 研究作为一项全球、双盲、安慰剂对照 Ⅲ 期研究,评估了 Pamrevlumab 联合化疗治疗初治不可切除 LAPC 患者的疗效和耐受性。结果显示 Pamrevlumab 组和安慰剂组生存结果无差异,两组 TEAE 发生率类似。因此,Pamrevlumab 加入化疗未能改善不可切除 LAPC 患者的生存结局[8]。
李琦教授点评:本次大会上公布了两项关于 Pamrevlumab 联合化疗用于胰腺癌治疗的研究。在研究设计上,两项研究分别采用了严谨的贝叶斯平台试验和全球性双盲对照试验,具有合理的分组与清晰的终点指标,保证了研究的科学性与可靠性。然而,研究结果显示,Pamrevlumab 联合化疗用于 mPDAC 患者一线和二线治疗以及用于不可切除 LAPC 患者时,尽管未显著增加毒性,但均未改善生存结局。这两项结果一致提示 Pamrevlumab 联合治疗方案在当前研究设定下疗效有限,为后续胰腺癌治疗研究方向调整及新疗法探索提供了参考。
4、可切除胆囊癌患者辅助化疗中加入放疗未能增效
目前尚无前瞻性研究对比单纯化疗和放化疗在胆囊癌辅助治疗中的作用。本次会议公布了 ACCELERATE 研究结果,探讨在单纯化疗基础上联合放化疗是否能改善胆囊癌患者的无复发生存期(RFS)。在这项开放标签、多中心、Ⅲ 期非劣效性研究中,手术切除的胆囊癌患者(R0或R1切除)随机分配至两组:单纯化疗组接受方案为:吉西他滨 + 奥沙利铂 (mGemOx) 或吉西他滨 + 顺铂 (GemCis);放化疗联合组先接受 3 周期上述化疗方案或者放化疗方案,后续再给予 2-3 周期化疗。
结果显示两组中位 RFS 分别是不可评估(NE)vs 34.39 个月(P=0.202),中位 OS 分别是 NE vs 34.56 个月(P=0.123),平均 RFS 分别是 51.96 个月 vs 43.99 个月。单纯化疗组具有更高的腹泻(P=0.021)和周围神经病(P=0.001)发生率。研究提示将放疗加入化疗后不能改善可切除胆囊癌患者结局[9]。
李琦教授点评:ACCELERATE 研究探讨了胆囊癌术后辅助化疗和放化疗的临床价值,为该领域填补了前瞻性循证证据。研究设计采用多中心、开放标签的非劣效性框架,纳入 94 例 R0 切除患者,对比单纯化疗与放化疗的疗效。结果显示放化疗联合组和单纯化疗组的 RFS 和 OS 无显著性差异。值得注意的是,单纯化疗组虽完成治疗周期比例更高(85.7% vs 62.2%),却伴随更高的腹泻和神经病变发生率,提示不同治疗模式的毒性谱差异。研究为胆囊癌辅助治疗模式选择提供了重要参考,同时凸显了精准筛选放疗获益人群的必要性。未来有必要通过细化分层的临床研究进一步探索放疗获益亚组人群。
专家简介
上海交通大学医学院附属第一人民医院
肿瘤内科主任
中国临床肿瘤学会理事
中国临床肿瘤学会胰腺癌专家委员会副主任委员
中华医学会肿瘤学分会胰腺肿瘤学组秘书
中国医师协会全科医师分会全国委员
中国研究型医院学会胰腺疾病专业委员会委员
中国抗癌协会肿瘤肿瘤大数据与真实世界研究专委会委员
中国抗癌协会肿瘤药物临床研究专业委员会委员
上海市医学会肿瘤内科专科分会副主任委员
上海市抗癌协会肿瘤药物临床研究专业委员会副主任委员
上海市抗癌协会疑难肿瘤专业委员会副主任委员
上海市抗癌协会多原发和不明原发肿瘤专委会常委
主持国家自然科学基金面上项目 4 项,入选上海市卫计委优秀学科带头人计划、上海市浦江人才培养计划,上海交通大学高峰高原人才培养计划、上海市卫生系统青年人才最高荣誉奖项「 银蛇奖 」等。
本资料可能会出现某些药品信息,但该药品/适应症可能尚未获得国家药品监督管理局的注册批准。医疗卫生专业人士做出的任何与治疗有关的决定应根据患者的具体情况并应参照国家药品监督管理局批准的药品说明书。对于本资料可能提到的相关诊断、治疗方法,请遵守国家卫生健康委员会以及相关政府部门批准使用的指南或规定。
[1]Effect of dose adjustments on overall survival (OS) in patients with metastatic pancreatic ductal adenocarcinoma (mPDAC) treated with NALIRIFOX: A post hoc analysis of NAPOLI 3.2025 ASCO GI.poster 716
[2]Impact of UGT1A1*28 polymorphism on tolerability in patients with metastatic pancreatic ductal adenocarcinoma (mPDAC) treated with NALIRIFOX in NAPOLI 3.2025 ASCO GI.poster 717.
[3] NALIRIFOX versus nab-paclitaxel and gemcitabine in treatment-naive patients with metastatic pancreatic ductal adenocarcinoma (NAPOLI 3): a randomised, open-label, phase 3 trial.[J].Lancet,2023,10409:1272-1281.
[4]中国临床肿瘤学会(CSCO)胰腺癌诊疗指南2024.
[5]NCCN胰腺癌诊疗指南(2024 V1版).
[6]Preliminary safety, antitumor activity, and circulating tumor DNA (ctDNA) changes with RMC-9805, an oral, RAS(ON) G12D-selective tricomplex inhibitor in patients with KRAS G12D pancreatic ductal adenocarcinoma (PDAC) from a phase 1 study in advanced solid tumors.2025 ASCO GI.poster 724.
[7]Pamrevlumab plus nab-paclitaxel/gemcitabine (Pam + GA) as first- and second-line therapy in metastatic pancreatic cancer (mPDAC): Results from Precision Promise (PrP) Bayesian platform trial.2025 ASCO GI.Oral 673.
[8]Randomized phase 3 trial of chemotherapy (CTX) with and without pamrevlumab (PAM) for locally advanced pancreatic cancer (LAPC).2025 ASCO GI.Oral 675.
[9]Adjuvant chemotherapy or chemo-radiation in gallbladder cancer: A phase Ill randomized controlled study (ACCELERATE trial).2025 ASCO GI.Oral 519.
排版编辑:肿瘤资讯-展思懿











 苏公网安备32059002004080号
苏公网安备32059002004080号


