
胃癌是全球范围内常见的恶性肿瘤之一,其发病率和死亡率均高居不下,给无数患者家庭带来了沉重打击。近期,首个靶向Claudin18.2的单克隆抗体——注射用佐妥昔单抗相继在国内外成功获批上市,标志着胃癌靶向治疗迈入新时代。为精准筛选适合Claudin18.2靶向治疗的患者,多项权威指南陆续对分子生物标志物的检测推荐做出了更新,希望这些指南的变更能推动Claudin18.2检测的标准化。
本期【肿瘤资讯】有幸邀请到北京协和医院病理科周炜洵教授为我们从国内外指南更新的角度,谈一谈Claudin18.2检测推荐变更的意义以及这些变更对临床实践的未来影响。
本期特邀专家——周炜洵 教授
北京协和医院病理科主任医师
中华医学会病理学分会消化系统学组组长
中华医学会消化分会炎症性肠病协作组
中国抗癌协会肿瘤病理委员会胃癌中青年协作组等学术团体的委员
《中华病理学杂志》编委
以消化道病理作为专业方向,对消化道肿瘤及炎症性疾病的诊断有丰富的经验
势不可挡,优异夯实的临床研究数据推动国内外指南的更新
注射用佐妥昔单抗(以下简称佐妥昔单抗)是全球首个获批的靶向Claudin18.2的单克隆抗体,获批适应症为联合含氟尿嘧啶类和铂类药物化疗用于 CLDN18.2 阳性、人表皮生长因子受体 2(HER2)阴性的局部晚期不可切除或转移性胃或胃食管交界处(GEJ)腺癌患者的一线治疗。其全球III期临床研究——SPOTLIGHT和GLOW研究均达成主要研究终点,显著延长了患者的无进展生存期(PFS)和总生存期(OS)[1,2],这是晚期胃癌靶向治疗的巨大进步。基于此,佐妥昔单抗已先后在日本、英国、美国、中国等多个国家和地区获批,为众多胃癌患者带来获益的同时,也极大地推动国内外多项重要临床指南、共识中关于治疗方案和病理诊断的更新。
美国国家综合癌症网络(NCCN)指南是全球肿瘤临床医生普遍认可和遵循的权威指南之一,其更新反映了肿瘤领域的最新进展和诊断治疗方向的权威专家意见,对全球肿瘤的治疗具有重要前瞻和实践性指导意义。2004年,NCCN胃癌指南首次将HER2作为推荐检测的生物标志物,这预示着胃癌分子分型的开始,晚期胃癌的治疗从传统的“一刀切”化疗转变为基于患者分子特征的个体化治疗。随着标志物研发的不断进步,微卫星高度不稳定(MSI-H)、PD-L1等陆续写入指南,胃癌的分子病理学检测更加精细、更加全面。2024年12月,NCCN胃癌指南发布2024 V5,正式将佐妥昔单抗联合化疗纳入一线治疗的优选方案(1类证据),指南明确建议,所有考虑使用佐妥昔单抗治疗的、既往未经治疗的不可手术的局部晚期、复发性或转移性G/GEJC患者都应进行Claudin18.2检测。同时,NCCN指南将Claudin18.2阳性定义为IHC显示≥75%肿瘤细胞有中度至强度Claudin18.2膜染色(图1)[3]。日本胃癌学会2024版指南中也明确指出,Claudin18.2是一种有用的新型胃癌生物标志物,在治疗前需确认其表达(图2)[4]。

 图2. 不可切除的晚期和复发性胃癌生物标志物指南1.1版(日本胃癌学会2024年)
图2. 不可切除的晚期和复发性胃癌生物标志物指南1.1版(日本胃癌学会2024年)
中国临床肿瘤学会(CSCO)胃癌诊疗指南凝结了我国胃癌临床和病理工作者智慧的结晶,编者专家会根据中国的国情进行诊断和治疗意见推荐,在我国胃癌规范化诊疗方面发挥着举足轻重的作用。2024年初,尽管佐妥昔单抗尚未在国内正式获批,但在2024版CSCO胃癌指南讨论、制定、编写时,专家组成员践行“诊断先行”的理念,前瞻性地更新了分子检测部分,以期在国内药物可及前完成靶点检测流程和规范的建立。将“拟针对Claudin18.2靶点治疗建议进行Claudin18.2表达检测(2A类)”的推荐等级由2023年版的III级推荐改为II级推荐(图3)。并新增指南注释:Claudin18.2通过免疫组化(IHC)检测,目前阳性判读标准仅来自临床试验。Claudin18.2阳性由肿瘤细胞完整、基底外侧或外侧膜染色的强度,以及肿瘤细胞膜着色所占百分比两个方面决定[5]。
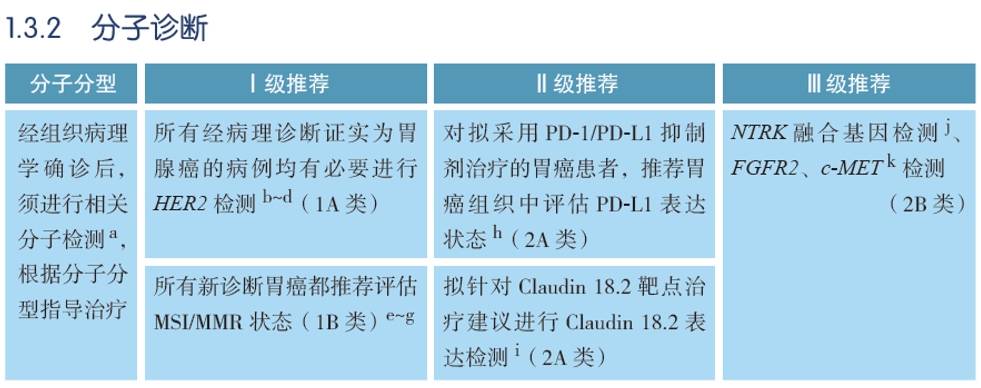 图3. 2024年CSCO胃癌诊疗指南
图3. 2024年CSCO胃癌诊疗指南
另外,由我国外科专家发布的《精准胃癌外科诊疗中国专家共识(2024版)》(图4)[6]也强调了Claudin18.2在胃癌治疗中的意义,强调胃癌分子分型独特的基因特征能够为胃癌的精准治疗提供依据,建议进行完善的病理诊断,临床上针对Claudin18.2表达较为成熟的检测方法是免疫组织化学染色。
 图4. 精准胃癌外科诊疗中国专家共识(2024版)
图4. 精准胃癌外科诊疗中国专家共识(2024版)
以上国内外指南、共识的更新不仅肯定了佐妥昔单抗联合化疗的疗效和临床价值,也充分践行了“精准治疗,诊断先行”的科学理念,以推动Claudin18.2的规范检测。
虽远必达,病理科为Claudin18.2检测的开展落地孜孜努力
Claudin18.2是在正常胃上皮细胞中表达,并在恶性转化过程中保留的紧密连接跨膜蛋白,根据文献报道,在晚期G/GEJC中,Claudin18.2阳性比例约38%[7,8]。IHC染色是评估Claudin18.2表达水平最成熟、最常见的检测手段,但由于注射用佐妥昔单抗在我国获批不久,并非所有医院均常规开展Claudin18.2检测,因此推动Claudin18.2的检测和规范之路并非易事。HER2是胃癌中最成熟、检测最普遍的生物标志物,历经临床和病理科数十年的努力,现已造福众多胃癌患者。而在目前的检测体系下,病理科若要引入Claudin18.2检测项目,往往需要经过抗体选择、抗体引入、平台条件摸索、判读培训、设立收费条目和临床沟通等多个环节,这就要求病理科完成产品性能验证、SOP建立等专业性工作之余,还需加强与医院多科室的沟通和协调。
另外,尽管IHC染色在技术层面并不构成显著挑战,但其检测结果受胃癌异质性、样本质量及处理操作、Claudin18.2检测抗体、分析平台和判读标准等诸多因素的影响和限制,因此Claudin18.2的规范化检测离不开各层级病理医生的共同努力。
随着佐妥昔单抗在中国的获批,临床医生和患者对Claudin18.2检测的需求日益迫切,为了提高Claudin18.2检测的可及性和检测结果的准确性,病理专家们已经在检测落地前做了较为充分的准备。首先,在中国抗癌协会肿瘤病理专业委员会的指导下,病理专家们正在积极编纂关于Claudin18.2检测在晚期胃癌的专家共识,期待该共识的发布能自上而下地推动Claudin18.2检测的普及和规范化水平,为中国医院开展新项目检测提供更细致的规范和落地的指导意见。第二,病理科医生不断加强自身对Claudin18.2的认识,目前很多学术会议内容涵盖了新靶点的讲题,从生物学功能到胃癌中的表达特性,从靶点的成药机制到最新的临床进展,病理医生正通过学习和交流逐步加深对该靶点的认知和检测经验。第三,我们也欣喜地看到,中国病理专家正在不断补充中国胃癌患者的Claudin18.2检测数据,探究中国胃癌Claudin18.2的表达水平[9]、与临床预后的相关性[10]、以及多种生物标志物的共表达情况[11]。
未来可期,临床与病理齐携手,共同推动Claudin18.2检测的规范化
Claudin18.2阳性约占晚期胃癌的38%[12],是HER2阳性的3倍之多,预示着临床上有着巨大未被满足的治疗需求。在佐妥昔单抗的两项全球III期研究中,联合化疗为Claudin18.2阳性、HER2阴性的胃癌患者带来了显著且稳定的临床获益,然而,获益的前提是精准筛选出合适的患者,在国内外指南的推动下,该靶点未来有潜力成为胃癌常规检测的靶点之一。
由于不同病理科可能采用不同克隆号抗体和阳性阈值,因此临床医生可能存在检测结果解读的困扰,这就促使临床医生在治疗决策时,需要与病理医生及时沟通,共同商讨患者的治疗方案。与此同时,病理医生也希望得到来自临床的反馈,对于不同Claudin18.2表达水平的患者,其接受靶向治疗后的疗效(如客观缓解率、缓解时间等)信息也将有助于帮助病理医生优化Claudin18.2检测的流程和判读标准。
未来,晚期胃癌的治疗终将走向精准化、个体化,创新型靶向药物的获批和应用有赖于准确、可信的分子病理检测。希望临床与病理科能密切沟通,共同参与病例讨论,在互相学习和切磋中共同进步,助力患者生活质量的提升和生存时间的延长。
结语
从国内外指南、共识的更新中可以预见,胃癌已步入更精准、更个体化的治疗时代。精准治疗,诊断先行,为迎合胃癌诊疗模式的改变,病理医生正逐步加强对Claudin18.2检测的重视,不断摸索和优化检测流程和判读标准,更规范地开展检测,为临床提供切实可靠的病理结果,助力临床决策,让创新疗法造福更多Claudin18.2阳性的胃癌患者!
1. Shitara K, Lordick F, Bang YJ, et al. Zolbetuximab plus mFOLFOX6 in patients with CLDN18.2-positive, HER2-negative, untreated, locally advanced unresectable or metastatic gastric or gastro-oesophageal junction adenocarcinoma (SPOTLIGHT): a multicentre, randomised, double-blind, phase 3 trial. Lancet. 2023 May 20;401(10389):1655-1668.
2. Shah MA, Shitara K, Ajani JA, et al. Zolbetuximab plus CAPOX in CLDN18.2-positive gastric or gastroesophageal junction adenocarcinoma: the randomized, phase 3 GLOW trial. Nat Med. 2023 Aug;29(8):2133-2141.
3. National Comprehensive Cancer Network (NCCN) guideline Version5.2024 Gastric Cancer.
4. Biomarker Guidelines for Unresectable Advanced and Recurrent Gastric Cancer Version 1.1 (Japan Gastric Cancer Society 2024).
5. 中国临床肿瘤学会(CSCO)胃癌诊疗指南 2024.
6. 中华医学会外科学腹腔镜与内镜外学组,中国医师协会外科医师分会上消化道外科医师专家工作组.精准胃癌外科诊疗中国专家共识(2024版)[J].中国消化外科杂志,2024,23 (3):323-333.
7.Coati I, Lotz G, Fanelli GN, et al. Claudin-18 expression in oesophagogastric adenocarcinomas: a tissue microarray study of 523 molecularly profiled cases. Br J Cancer. 2019 Jul;121(3):257-263.
8.Pellino A, Brignola S, Riello E, et al. Association of CLDN18 Protein Expression with Clinicopathological Features and Prognosis in Advanced Gastric and Gastroesophageal Junction Adenocarcinomas. J Pers Med. 2021 Oct 26;11(11):1095.
9. Dai J, Zheng H, Jin J, et al. Claudin18.2 expression and clinicopathological features in cytology effusion specimens from gastric adenocarcinoma: A comparative study with tissue specimens. Cancer Cytopathol. 2023 Jun;131(6):365-372.
10. Tao D, Guan B, Li Z, et al. Correlation of Claudin18.2 expression with clinicopathological characteristics and prognosis in gastric cancer. Pathol Res Pract. 2023 Aug;248:154699.
11. Chong X, Zhou T, et al. Clinicopathological significance and immunotherapeutic outcome of claudin 18.2 expression in advanced gastric cancer: A retrospective study. Chin J Cancer Res. 2024 Feb 29;36(1):78-89.
12. Shitara K, Xu RH, Ajani JA, et al. Global prevalence of claudin 18 isoform 2 in tumors of patients with locally advanced unresectable or metastatic gastric or gastroesophageal junction adenocarcinoma. Gastric Cancer. 2024 Sep;27(5):1058-1068.
本文由安斯泰来提供,仅供医疗卫生等专业人士参考
过审编号:MAT-CN-VYL-2025-00046
材料准备时间:2025-02-24
有效期:6个月
排版编辑:肿瘤资讯-高惠











 苏公网安备32059002004080号
苏公网安备32059002004080号


