在乳腺癌的众多亚型中,三阴性乳腺癌(TNBC)犹如一座难以攻克的堡垒,因其特殊的生物学特性,长期以来治疗手段有限,预后不佳。然而,近些年来,免疫治疗强势崛起,正逐步重塑着 TNBC 的治疗格局。本文的下篇将依据领域综述1,深入且全面地梳理早期(e) TNBC 免疫治疗的当前状况,以及新兴疗法的研究进展情况。
相关阅读:免疫治疗重塑TNBC治疗格局,背后真相几何?(晚期TNBC篇)
eTNBC的免疫治疗
eTNBC的新辅助治疗旨在减少可手术肿瘤的手术切除范围,或将不可手术的肿瘤转化为可手术的肿瘤。治疗目标是达到病理学完全缓解(pCR),即在手术时彻底清除乳房和淋巴结中的浸润性癌症(ypT0/is,ypN0)。达到pCR的患者无病生存期(DFS)和总生存期(OS)显著改善,因此pCR是新辅助试验中常见的临床终点。未能达到pCR的患者根据残留癌症负担(RCB)的程度进行分类。RCB也具有预后意义,RCB评分越高,无事件生存期(EFS)越差。
与标准新辅助化疗方案相比,化疗联合免疫检查点抑制剂(ICI)提高了TNBC患者的pCR率。与转移性环境中PD-L1预测ICI反应不同,新辅助治疗中预测性生物标志物的开发尚不明确。因此,目前除临床试验外,尚无PD-L1检测的指征,因为现有证据表明,无论PD-L1状态如何,所有eTNBC患者在新辅助治疗中均能从ICI中获益。
新辅助帕博利珠单抗+化疗,术后辅助帕博利珠单抗
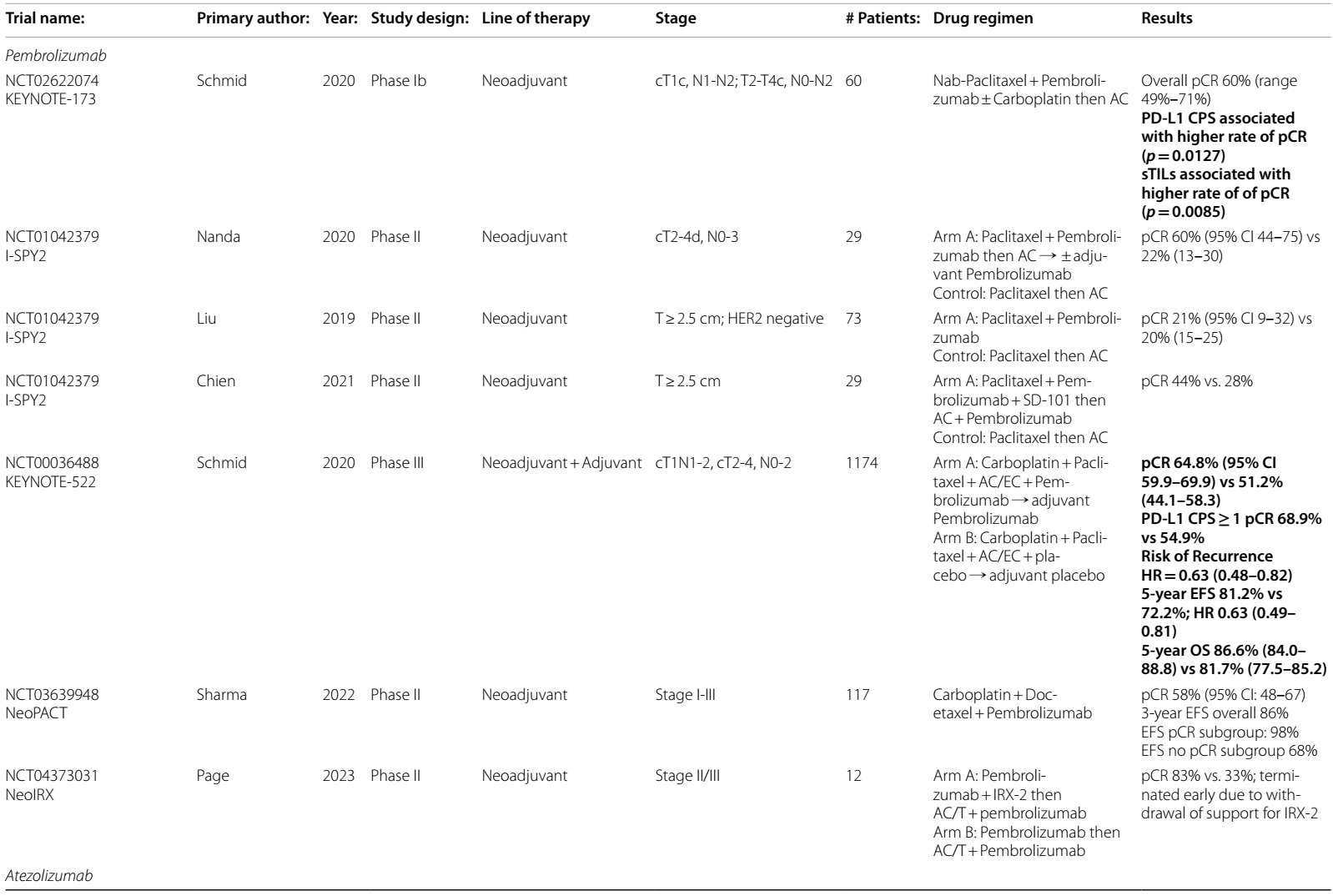
1b期KEYNOTE-173试验证明了新辅助帕博利珠单抗联合化疗一线治疗高风险eTNBC的安全性和初步疗效,PD-L1 CPS和TILs较高的患者pCR率显著提高2,3。II期I-SPY2试验4的数据证实了帕博利珠单抗联合标准新辅助化疗的益处。该试验纳入了29例肿瘤>2.5 cm且淋巴结状态不限的TNBC患者。实验组患者接受帕博利珠单抗联合每周紫杉醇治疗,随后接受剂量密集(dd)多柔比星和环磷酰胺(AC)治疗,pCR率估计为60%,而仅接受紫杉醇联合AC治疗的患者pCR率为22%。另一项I-SPY2方案评估了紫杉醇联合帕博利珠单抗的无蒽环类药物方案,但未达到目标pCR率5。
具有里程碑意义的III期双盲KEYNOTE-522试验6评估了新辅助和辅助帕博利珠单抗用于1174例cT1、N1-2或cT2-4、N0-2 TNBC患者的疗效。患者按2:1随机分组,分别接受新辅助帕博利珠单抗或安慰剂联合紫杉醇和卡铂(PC),随后接受AC或表柔比星和环磷酰胺(EC)治疗(每3周一次)。手术后,研究组患者继续接受帕博利珠单抗辅助治疗,完成总共一年的治疗。帕博利珠单抗方案的pCR率为64.8%,而安慰剂组为51.2%,治疗差异为13.6%。此外,帕博利珠单抗组的复发风险显著降低(HR 0.63),淋巴结阳性患者的获益更大(治疗差异20.6% vs. 6.3%),且反应与PD-L1状态无关。
更新的5年EFS数据显示,帕博利珠单抗持续获益,EFS率为81.2%,安慰剂组为72.2%7。即使在新辅助化疗后达到RCB-I和RCB-II的患者中,EFS也有所改善,但接受帕博利珠单抗新辅助治疗后达到RCB-III的患者的3年EFS比接受安慰剂的患者更差(26.2% vs. 34.6%;HR 1.24,95%CI 0.69-2.23)8,这种生存率的下降主要是由于局部复发率较高。5年OS比例为86.6% vs. 81.7%9。接受帕博利珠单抗治疗的患者中有33.5%出现免疫相关不良反应,最常见的是甲状腺功能减退(15.1%)、皮肤反应(5.7%)和肾上腺功能不全(2.6%)10。基于这项研究, 2021年7月,美国FDA批准了帕博利珠单抗联合化疗用于eTNCB的新辅助治疗,术后继续使用帕博利珠单抗单药作为辅助治疗。KEYNOTE-522方案是目前eTNBC的标准治疗方案。
最佳化疗方案的探索
鉴于帕博利珠单抗联合PC + AC的KEYNOTE-522方案的高pCR率和EFS,NeoPACT试验11评估了在新辅助治疗中减少蒽环类药物使用的效果,以降低蒽环类药物的毒性。在这项II期试验中,接受卡铂联合多西他赛和帕博利珠单抗治疗的患者的pCR率为58%。达到pCR的患者的3年EFS高达98%,总体3年EFS为86%。目前正在进行的III期SWOG2212/SCARLET试验(NCT05929768)将比较KEYNOTE-522方案与NeoPACT方案在T2-4、N0、M0或T1-3、N1-2、M0 TNBC患者中的效果,主要终点为EFS,旨在确定最佳的化疗方案。
阿替利珠单抗
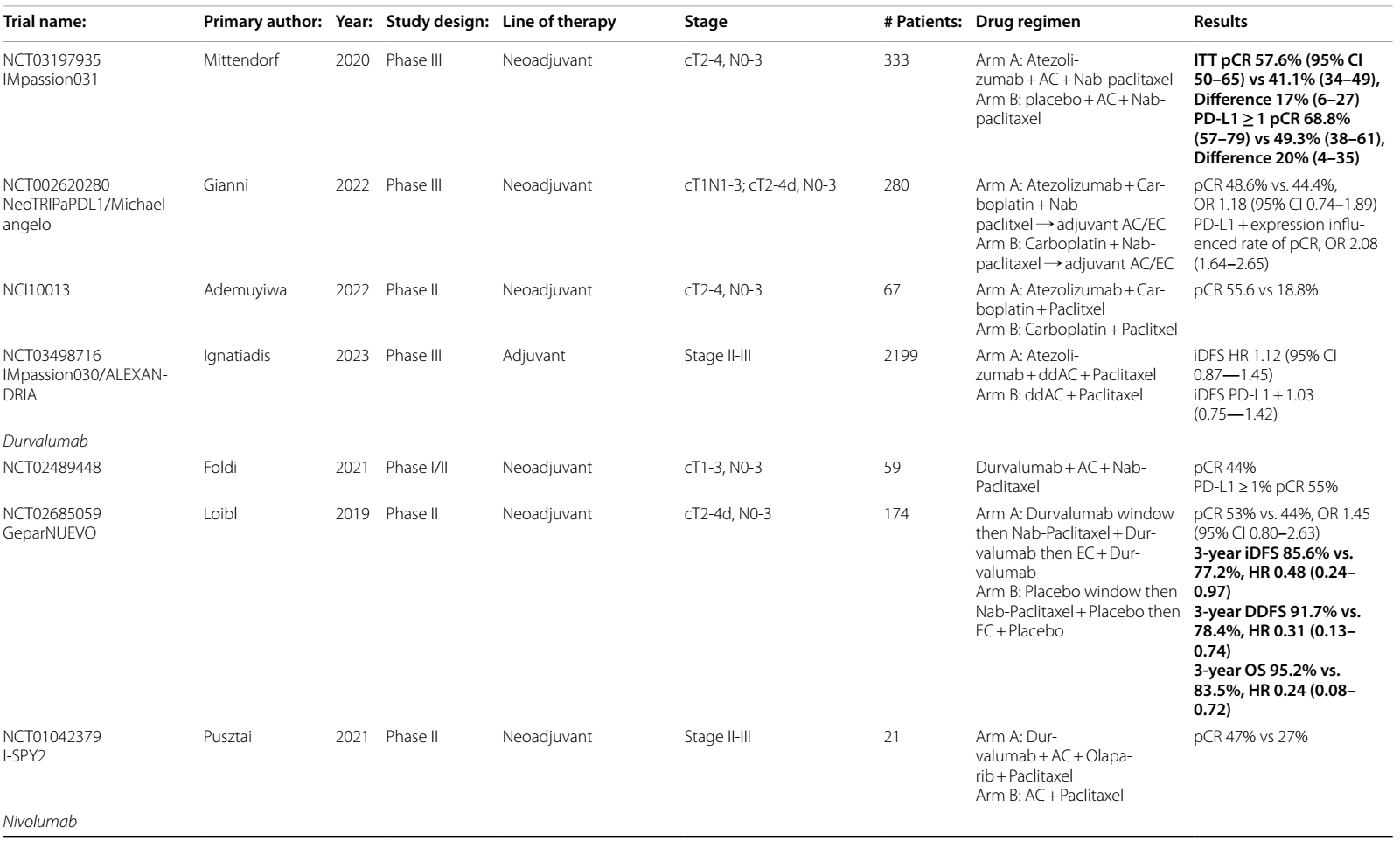
新辅助阿替利珠单抗在TNBC中也显示出潜力。一项II期试验12在67例患者中评估了阿替利珠单抗联合卡铂和紫杉醇的无蒽环类药物方案,显示出pCR的益处。III期IMpassion031研究13纳入了333例cT2-4、N0-3 TNBC患者,发现阿替利珠单抗联合白蛋白结合型紫杉醇随后接受ddAC治疗的pCR显著提高(pCR 58% vs. 41%)。在PD-L1阳性队列中,阿替利珠单抗显著提高了pCR率(68.8% vs. 49.3%)。EFS数据尚未公布。NeoTRIP Michelangelo III期研究14评估了卡铂和白蛋白结合型紫杉醇联合或不联合阿替利珠单抗,随后接受手术和辅助AC治疗的280例患者,阿替利珠单抗组未见pCR获益(48.6% vs. 44.4%)。与KEYNOTE-522研究不同,NeoTRIP研究纳入了N3疾病的患者,88%的患者为淋巴结阳性,这可能解释了总体pCR率较低的原因。多变量分析发现,PD-L1表达显著提高了pCR率(OR 2.08,95% CI 1.64-2.65)。EFS数据尚未公布。
度伐利尤单抗
基于在mTNBC中维持性度伐利尤单抗的OS获益,II期GeparNuevo试验探索了新辅助度伐利尤单抗联合化疗的效果。cT2-4d、N0-3 TNBC患者在化疗前2周接受度伐利尤单抗/安慰剂单药治疗,随后给予度伐利尤单抗/安慰剂+白蛋白紫杉醇,持续12周,然后给予度伐利尤单抗/安慰剂+dd EC,随后手术。术后未继续使用度伐利尤单抗或安慰剂。虽然pCR无显著差异(53% vs. 44%;OR 1.45,95% CI 0.80-2.63),但度伐利尤单抗显著提高了3年DFS(85.6% vs. 77.2%;HR 0.48,95% CI 0.24-0.97),支持了早期使用ICI但不进行辅助 ICI 治疗可带来长期获益的假设15。在亚组分析中,TMB > 10%和TILs的存在预测了治疗反应,高TMB和TILs患者的pCR率为82%,而低TMB和TILs患者的pCR率为28%。I-SPY2的数据支持进一步探究新辅助紫杉醇、度伐利尤单抗和奥拉帕利随后接受AC治疗在eTNBC中的应用,因为该试验发现试验组pCR率为47%,而标准治疗组为27%16。
新辅助免疫治疗标志物
需要生物标志物来识别可能对新辅助免疫治疗有反应的患者。新型生物标志物如DetermaIO利用RNA测序生成评分,预测eTNBC患者接受免疫治疗后的pCR。对I-SPY2试验中5个免疫治疗组的343例患者进行的汇总分析发现了一种称为ImPrintTN的免疫分类器,旨在识别哪些eTNBC患者可能无法从免疫治疗中获益。在28%的ImPrintTN阳性患者中,74%达到了pCR,而ImPrintTN阴性患者中仅有16%达到pCR17。尽管该生物标志物需要进一步验证,但它表明一部分eTNBC患者可能在不具备免疫治疗获益的情况下避免使用免疫治疗。
新辅助ADC
新辅助ADC在eTNBC中的应用是一个活跃的研究领域。II期NeoSTAR试验18发现,SG单药治疗的pCR率为30%。SOLTI TOT-HER3试验19探索了新辅助Patritumab Deruxtecan(HER3-DXd)作为单剂量在机会窗口期I期试验中的效果,ORR为35%。
同步或序贯免疫治疗
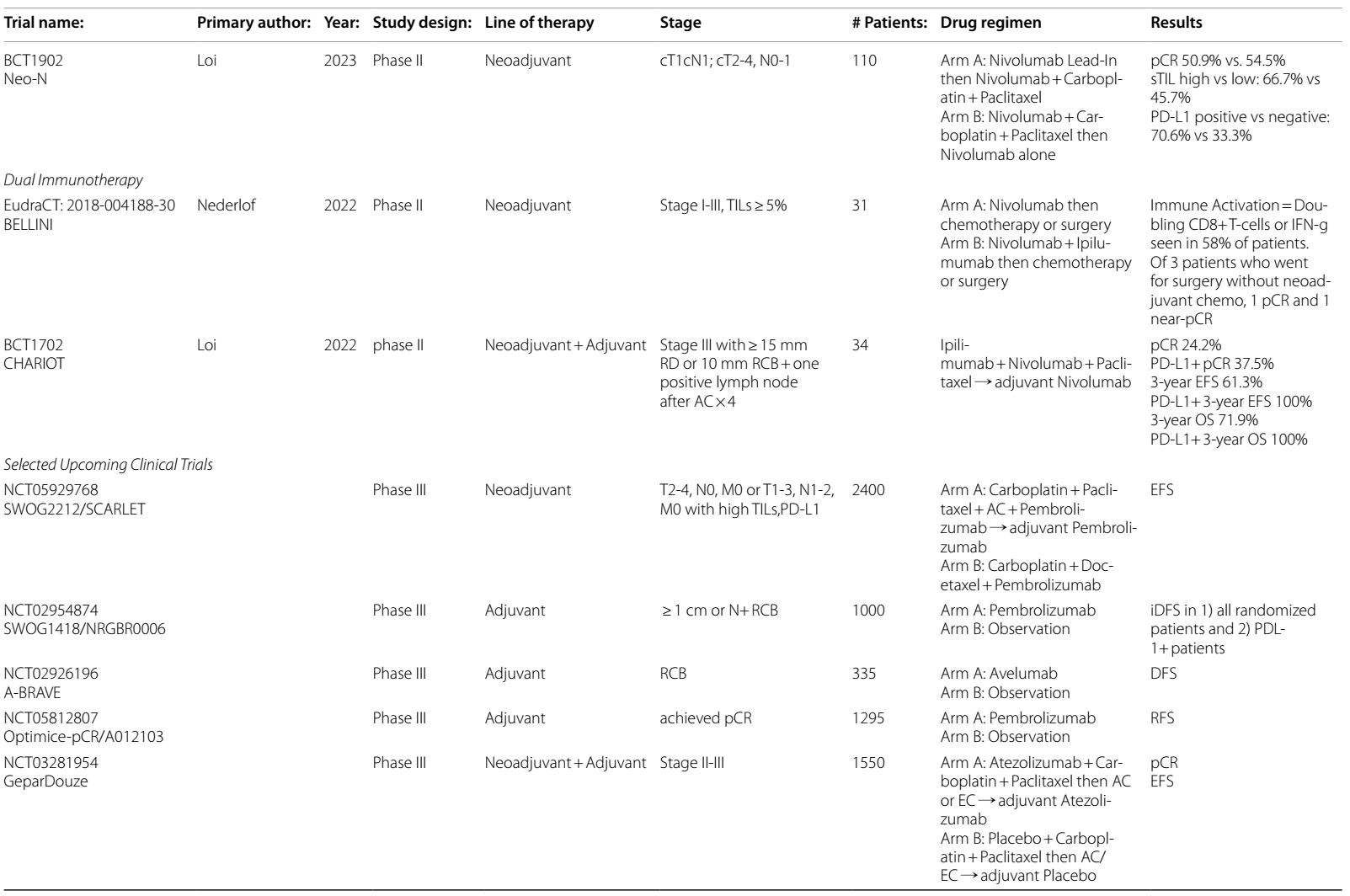
II期BCT1902/IBCSG 61-20 Neo-N试验分析了诱导免疫治疗与同步新辅助免疫治疗的效果。eTNBC患者随机分为A组:先采用纳武利尤单抗随后接受纳武利尤单抗联合卡铂和紫杉醇新辅助治疗,或B组:前期纳武利尤单抗、卡铂和紫杉醇随后接受纳武利尤单抗单药治疗。两组之间的pCR无显著差异(50.9% vs. 54.5%)20。值得注意的是,66.7%的高TILs患者和70.6%的PD-L1阳性患者达到了pCR,表明这可能是一种有效的无蒽环类药物新辅助治疗方案。EFS数据尚未公布。
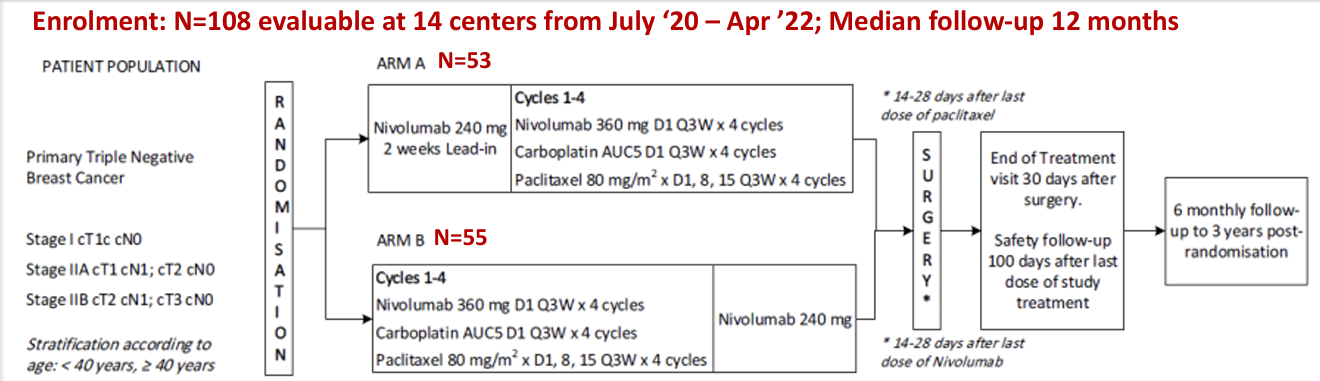
PD-1抑制剂+CTLA-4抑制剂
两项II期试验探索了eTNBC中联合PD-1和CTLA-4抑制剂的双重新辅助ICIs治疗。BELLINI试验21选择了31例TILs ≥ 5%的患者,接受新辅助纳武利尤单抗 ± 伊匹木单抗随后接受化疗或手术。58%的患者显示出免疫激活的证据(定义为CD8+ T细胞或IFN-γ的倍增)。在接受手术而未接受新辅助化疗的3例患者中,1例达到pCR,1例接近pCR。所有有影像学反应的患者TILs > 40%。CHARIOT试验22是一项II期单臂试验,针对新辅助AC治疗后RCB ≥ 15 mm或 ≥ 10 mm且淋巴结阳性的III期TNBC患者。患者接受新辅助紫杉醇、伊匹木单抗和纳武利尤单抗治疗,随后接受辅助纳武利尤单抗治疗。在这一高风险人群中,总体pCR率为24.4%,PD-L1阳性亚组的pCR率为44.4%。最近公布的EFS和OS数据显示,PD-L1阳性和/或高TILs亚组的3年EFS和OS达到了惊人的100%,尽管只有少数患者达到了pCR22,23。
辅助ICI治疗
TNBC辅助ICI的研究成果有限。III期IMpassion030/ALEXANDRIA研究评估了辅助阿替利珠单抗联合化疗在2199例接受前期手术的II-III期TNBC患者中的效果。中位随访25.3个月后,试验因无效分析显示不太可能达到改善无浸润性疾病生存期(iDFS)的主要终点(HR 1.12,95%CI 0.87-1.45)而终止24。在设计该研究时,尚不清楚新辅助与辅助化疗联合免疫治疗哪种方案能为TNBC患者带来更好的结果。现有证据表明,eTNBC应优先考虑包括免疫治疗在内的前期系统治疗,并根据个体情况调整辅助免疫治疗方案。
TNBC及各亚型中的疫苗治疗
大多数乳腺癌疫苗的临床试验聚焦于转移性乳腺癌(mBC)。Theratrope试验25是一项III期临床试验,纳入了1028例任何亚型的mBC患者,分别接受与钥孔戚血蓝蛋白 (KLH) 蛋白结合的Muc1表位唾液酸-TN与KLH单药治疗,主要终点为至疾病进展时间。患者在接种疫苗前 3 天给予环磷酰胺起始剂量。尽管治疗组确实产生了抗粘蛋白抗体,但在至疾病进展时间或OS方面未观察到差异。在一项针对mBC患者的 II 期试验26中,评估了Adagloxad simolenin(由Globo H与载体蛋白KLH共价相连而成)与安慰剂组相比,总体PFS未见差异,不过抗Globo-H 滴度较高的患者 PFS 有所改善。即将开展的 III期 GLORIA试验27(NCT03562637)将在辅助治疗阶段,对表达 Globo-H 的TNBC患者研究该疫苗的疗效。
基于病毒的乳腺癌疫苗也在 I 期和 II 期研究中进行了探索,其目的是感染抗原呈递细胞,以增强针对恶性细胞的免疫反应。PANVAC是一种痘病毒疫苗,编码 Muc-1、癌胚抗原(CEA)和三种共刺激分子的转基因。PANVAC 的 I 期试验28证明了其安全性和免疫反应性,有 1 例mBC患者达到CR。II 期研究29将 PANVAC 与多西他赛联合使用,与单用多西他赛相比,PFS 有接近显著的改善(7.9个月 vs 3.9个月;HR 0.65,P = 0.09)。虽然大多数病毒疫苗聚焦于经过大量预处理的患者,但有两种疫苗已进入新辅助治疗领域。Pelareorep(一种 III 型呼肠孤病毒)与紫杉醇联合使用,被发现可使mBC患者的OS有接近显著的延长(17.4 个月vs 10.4 个月;HR 0.65,P = 0.1)30。目前,正在eTNBC的新辅助治疗中分析Pelareorep的效果,初步数据表明其能有效引发适应性免疫反应31。最近一项针对 II-III 期TNBC的 II 期研究32,采用新辅助瘤内注射 talimogene iaherparepvec(T-VEC)联合紫杉醇,随后给予AC,结果发现pCR率为45.9%,2年DFS率为89%,RCB为 0 或 1 的患者无复发情况。
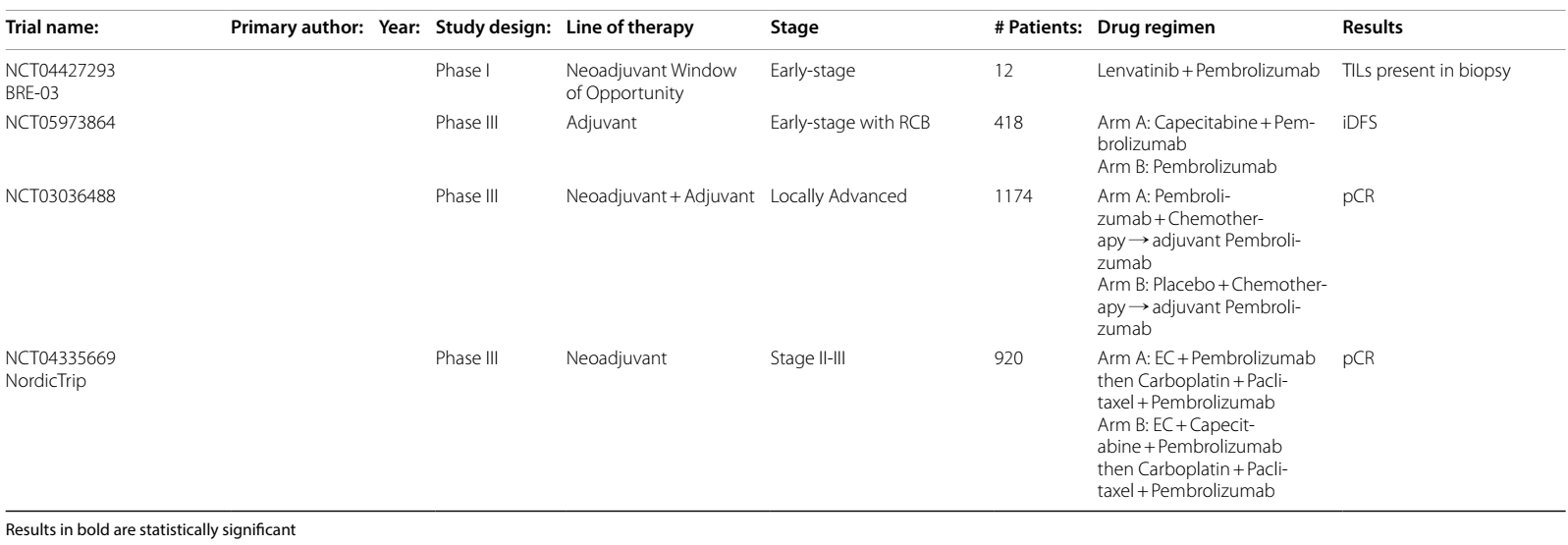
eTNBC正在进行及即将开展的临床试验
基于TILs的治疗方案
即将开展的 II 期 NeoTRACT(NCT05645380)试验,将深入探究基于高TILs水平,在 eTNBC 患者中降低新辅助化疗免疫治疗强度的可行性。具体而言,对于TILs≥5%的患者,将采用卡铂、多西他赛和帕博利珠单抗的治疗方案;而TILs<5%的患者,则会接受标准的 KEYNOTE-522 方案。
辅助ICI的作用
在明确辅助ICI治疗的作用方面,一些试验也即将开展,且重点在于依据新辅助治疗的效果来定制个性化治疗方案。例如,III 期Optimice-pCR(NCT05812807)试验旨在确定达到pCR的患者是否能够避免辅助免疫治疗。对于使用帕博利珠单抗联合化疗后达到 pCR 的 eTNBC 患者,将被随机分配至接受辅助帕博利珠单抗治疗组或观察对照组,该试验的主要研究终点为无复发生存期。
新辅助治疗后存在RCB
对于新辅助治疗后存在RCB的患者,两项 III 期试验也即将开展,旨在评估为期一年的辅助 ICI 治疗相较于仅进行观察的益处。其中,SWOG1418 / NRGBR0006(NCT02954874)试验将着重研究 RCB>1cm 或淋巴结阳性患者使用帕博利珠单抗的疗效,其共同终点为总体iDFS以及PD-L1阳性亚组的iDFS。A-BRAVE(NCT02926196)试验则会在两类患者中研究阿维鲁单抗的疗效:A 类是直接接受手术,随后进行辅助化疗的患者;B 类为新辅助治疗后存在 RCB 的患者。
ICI联合VEGF抑制剂
基于ATRACTIB研究的成功,ICI联合VEGF抑制剂的联合疗法也在进一步深入研究中。BELLA(NCT04739670)II 期试验正在对阿替利珠单抗、贝伐珠单抗、卡铂和吉西他滨的联合方案进行研究,该方案应用于早期复发的 PD-L1 阳性TNBC患者;而 MARIO-3(NCT03961698)II 期试验则在探索阿替利珠单抗、贝伐珠单抗、白蛋白结合型紫杉醇和eganelisib(一种 PI3Kγ 抑制剂)的联合方案,用于a/m TNBC的一线治疗。
ADC±ICIs辅助治疗
在辅助治疗领域,评估ADC±ICIs的临床试验也在有序进行中。SASCIA(NCT04595565)III 期试验正在对比辅助 SG 单药治疗与医生选择治疗在新辅助治疗后复发风险较高的原发性HER2阴性乳腺癌患者中的疗效。同样,ASCENT-05/Optimice-RD(NCT05633654)研究正在测试辅助治疗中 SG 联合帕博利珠单抗与医生选择治疗方案的疗效。TROPION-Breast-03(NCT05629585)试验则在研究辅助治疗中,Dato-DXd 联合或不联合度伐利尤单抗与标准治疗方案相比,对存在 RCB 的患者(包括接受和未接受新辅助免疫治疗的患者)的疗效。鉴于 KEYNOTE-522 研究中 RCB-III 疾病亚组的不良预后情况,这些研究将有助于明确辅助 ICI 对该亚组患者的益处。
ADC±ICIs新辅助治疗
在新辅助治疗方面,TROPION-Breast-04(NCT06112379)试验将在 II-III 期TNBC或 HER2 低表达患者中,比较新辅助治疗中 BEGONIA 方案(Dato-DXd 联合度伐利尤单抗)与 KEYNOTE-522 方案的疗效,期望在治愈性治疗中降低化疗所带来的毒性。NeoSTAR(NCT04230109)试验的第 2 队列将研究 SG 联合帕博利珠单抗的另一种降低强度的新辅助方案。
表1 ICIs在eTNBC中当前和即将进行的临床试验
1. Heater NK, Warrior S, Lu J. Current and future immunotherapy for breast cancer. J Hematol Oncol. 2024 Dec 25;17(1):131. doi: 10.1186/s13045-024-01649-z.
2. Schmid P, Salgado R, Park YH, et al. Pembrolizumab plus chemotherapy as neoadjuvant treatment of high-risk, early-stage triple-negative breast cancer: results from the phase 1b open-label, multicohort KEYNOTE-173 study. Ann Oncol. 2020;31(5):569–81.
3. Denkert C, Loibl S, Noske A, et al. Tumor-associated lymphocytes as an independent predictor of response to neoadjuvant chemotherapy in breast cancer. J Clin Oncol. 2010;28(1):105–13.
4. Nanda R, Liu MC, Yau C, et al. Effect of pembrolizumab plus neoadjuvant chemotherapy on pathologic complete response in women with early-stage breast cancer. JAMA Oncol. 2020;6(5):676.
5. Liu MC, Robinson PA, Yau C, et al. Abstract P3-09-02: Evaluation of a novel agent plus standard neoadjuvant therapy in early stage, high-risk HER2 negative breast cancer: results from the I-SPY 2 TRIAL. Can Res. 2020;80(4_Supplement):P3-09-02-P3-09-02. 10.1158/1538-7445.SABCS19-P3-09-02.
6. Schmid P, Cortes J, Pusztai L, et al. Pembrolizumab for early triple-negative breast cancer. N Engl J Med. 2020;382(9):810–21.
7. Schmid P, Cortés J, Dent R, et al. Abstract LBO1-01: Neoadjuvant pembrolizumab or placebo plus chemotherapy followed by adjuvant pembrolizumab or placebo for early-stage triple-negative breast cancer: Updated event-free survival results from the phase 3 KEYNOTE-522 study. Cancer Res. 2024;84(9_Supplement):LBO1-01-LBO1-01. 10.1158/1538-7445.SABCS23-LBO1-01.
8. Pusztai L, Denkert C, O’Shaughnessy J, et al. Event-free survival by residual cancer burden with pembrolizumab in early-stage TNBC: exploratory analysis from KEYNOTE-522. Ann Oncol. 2024;35(5):429–36.
9. Schmid P, Cortes J, Dent R, (eds) (2024) LBA4: Neoadjuvant pembrolizumab or placebo plus chemotherapy followed by adjuvant pembrolizumab or placebo for high-risk early-stage TNBC: overall survival results from the phase III KEYNOTE-522 study. 2024 ESMO Congress; Barcelona, Spain.
10. Schmid P, Cortes J, Dent R, et al. Event-free survival with pembrolizumab in early triple-negative breast cancer. N Engl J Med. 2022;386(6):556–67.
11. Sharma P, Stecklein SR, Yoder R, et al. Clinical and biomarker findings of neoadjuvant pembrolizumab and carboplatin plus docetaxel in triple-negative breast cancer. JAMA Oncol. 2024;10(2):227.
12. Ademuyiwa FO, Gao F, Street CR, et al. A randomized phase 2 study of neoadjuvant carboplatin and paclitaxel with or without atezolizumab in triple negative breast cancer (TNBC) - NCI 10013. npj Breast Cancer. 2022. 10.1038/s41523-022-00500-3.
13. Mittendorf EA, Zhang H, Barrios CH, et al. Neoadjuvant atezolizumab in combination with sequential nab-paclitaxel and anthracycline-based chemotherapy versus placebo and chemotherapy in patients with early-stage triple-negative breast cancer (IMpassion031): a randomised, double-blind, phase 3 tria. The Lancet. 2020;396(10257):1090–100.
14. Gianni L, Huang CS, Egle D, et al. Pathologic complete response (pCR) to neoadjuvant treatment with or without atezolizumab in triple-negative, early high-risk and locally advanced breast cancer: NeoTRIP Michelangelo randomized study. Ann Oncol. 2022;33(5):534–43.
15. Loibl S, Schneeweiss A, Huober J, et al. Neoadjuvant durvalumab improves survival in early triple-negative breast cancer independent of pathological complete response. Ann Oncol. 2022;33(11):1149–58.
16. Pusztai L, Yau C, Wolf DM, et al. Durvalumab with olaparib and paclitaxel for high-risk HER2-negative stage II/III breast cancer: results from the adaptively randomized I-SPY2 trial. Cancer Cell. 2021;39(7):989-98.e5.
17. Wolf DM, Yau C, Campbell MJ, et al. Biomarkers predicting response to 5 immunotherapy arms in the neoadjuvant I-SPY2 trial for early-stage breast cancer (BC): evaluation of immune subtyping in the response predictive subtypes (RPS). J Clin Oncol. 2023;41(16_suppl):102–102. 10.1200/JCO.2023.41.16_suppl.102.
18. Spring LM, Tolaney SM, Fell G, et al. Response-guided neoadjuvant sacituzumab govitecan for localized triple-negative breast cancer: results from the NeoSTAR trial. Ann Oncol. 2024;35(3):293–301.
19. Oliveira M, Pascual T, Ortega PT, et al. 124O Patritumab deruxtecan (HER3-DXd) in hormonal receptor-positive/HER2-negative (HR+/HER2-) and triple-negative breast cancer (TNBC): results of part B of SOLTI TOT-HER3 window of opportunity trial. ESMO Open. 2023;8(1):101463.
20. Loi S, Niman S, Zdenkowski N, et al. Abstract LBO1-03: randomized phase II study of neoadjuvant nivolumab (N) 2 week lead-in followed by 12 weeks of concurrent N+ carboplatin plus paclitaxel (CbP) vs concurrent N+ CbP in Triple negative breast cancer (TNBC):(BCT1902/IBCSG 61–20 Neo-N). Cancer Res. 2024;84:LBO1-03.
21. Nederlof I, Isaeva OI, Bakker N, et al. LBA13 Nivolumab and ipilimumab in early-stage triple negative breast cancer (TNBC) with tumor-infiltrating lymphocytes (TILs): First results from the BELLINI trial. Ann Oncol. 2022;33:S1382.
22. Loi S, Francis PA, Zdenkowski N, et al. Neoadjuvant ipilimumab and nivolumab in combination with paclitaxel following anthracycline-based chemotherapy in patients with treatment resistant early-stage triple-negative breast cancer (TNBC): A single-arm phase 2 trial. J Clin Oncol. 2022;40:602.
23. Loi S, Francis PA, Zdenkowski N, et al. Phase II study of neoadjuvant ipilimumab and nivolumab in combination with paclitaxel following anthracycline-based chemotherapy in patients with treatment resistant stage III triple negative breast cancer (TNBC): BCT1702—survival results. J Clin Oncol. 2024;42:608.
24. Ignatiadis M, Bailey A, McArthur H, et al. Abstract GS01-03: Adding atezolizumab to adjuvant chemotherapy for stage II and III triple-negative breast cancer is unlikely to improve efficacy: interim analysis of the ALEXANDRA/IMpassion030 phase 3 trial. Cancer Res. 2024;84:GS01-03.
25. Miles D, Roché H, Martin M, et al. Phase III multicenter clinical trial of the sialyl-TN (STn)-keyhole limpet hemocyanin (KLH) vaccine for metastatic breast cancer. oncologist. 2011;16(8):1092–100.
26. Huang C-S, Yu AL, Tseng L-M, et al. Globo H-KLH vaccine adagloxad simolenin (OBI-822)/OBI-821 in patients with metastatic breast cancer: phase II randomized, placebo-controlled study. J Immunother Cancer. 2020;8(2):e000342.
27. Rugo HS, Cortes J, Barrios CH, Cabrera P, et al. GLORIA: phase III, open-label study of adagloxad simolenin/OBI-821 in patients with high-risk triple-negative breast cancer. Future Oncol. 2022;18(34):3801–13.
28. Mohebtash M, Tsang K-Y, Madan RA, et al. A pilot study of MUC-1/CEA/TRICOM poxviral-based vaccine in patients with metastatic breast and ovarian cancer. Clin Cancer Res. 2011;17(22):7164–73.
29. Heery CR, Ibrahim NK, Arlen PM, et al. Docetaxel alone or in combination with a therapeutic cancer vaccine (PANVAC) in patients with metastatic breast cancer. JAMA Oncol. 2015;1(8):1087.
30. Bernstein V, Ellard SL, Dent SF, et al. A randomized phase II study of weekly paclitaxel with or without pelareorep in patients with metastatic breast cancer: final analysis of Canadian Cancer Trials Group IND.213. Breast Cancer Res Treat. 2018;167(2):485–93. 10.1007/s10549-017-4538-4.
31. Manso L, Villagrasa P, Chic N, et al. 41P A window-of-opportunity study with atezolizumab and the oncolityc virus pelareorep in early breast cancer (REO-027, AWARE-1). Ann Oncol. 2020;31:S30.
32. Soliman H, Hogue D, Han H, et al. Oncolytic T-VEC virotherapy plus neoadjuvant chemotherapy in nonmetastatic triple-negative breast cancer: a phase 2 trial. Nat Med. 2023;29(2):450–7.
排版编辑:肿瘤资讯-Jina











 苏公网安备32059002004080号
苏公网安备32059002004080号


