北京大学肿瘤医院沈琳教授团队在BMC Medicine发表了一项研究论文,题为 “Immune microenvironment spatial landscapes of tertiary lymphoid structures in gastric cancer”。该研究通过单细胞测序(scRNA-seq)、空间转录组学(ST)及多重免疫荧光染色(m-IHC)等前沿技术,全面揭示了三级淋巴结构(Tertiary Lymphoid Structures, TLS)在胃癌肿瘤微环境中的作用,并建立了一种新型的预测模型,为精准免疫治疗提供新思路。
 近年来,免疫治疗(如PD-1/PD-L1抑制剂)已成为胃癌的重要治疗手段。然而,胃癌患者对免疫治疗的响应存在较大个体差异,精准预测患者响应并优化个性化治疗方案仍是临床难题。有研究表明,三级淋巴结构与患者的免疫治疗响应及生存相关。然而,目前关于TLS在胃癌中的空间分布及其对免疫微环境的影响仍缺乏系统性研究。因此,本研究通过多组学分析,探索TLS的空间分布、细胞组成及其在免疫治疗中的作用,为优化治疗策略提供新型生物标志物。
近年来,免疫治疗(如PD-1/PD-L1抑制剂)已成为胃癌的重要治疗手段。然而,胃癌患者对免疫治疗的响应存在较大个体差异,精准预测患者响应并优化个性化治疗方案仍是临床难题。有研究表明,三级淋巴结构与患者的免疫治疗响应及生存相关。然而,目前关于TLS在胃癌中的空间分布及其对免疫微环境的影响仍缺乏系统性研究。因此,本研究通过多组学分析,探索TLS的空间分布、细胞组成及其在免疫治疗中的作用,为优化治疗策略提供新型生物标志物。
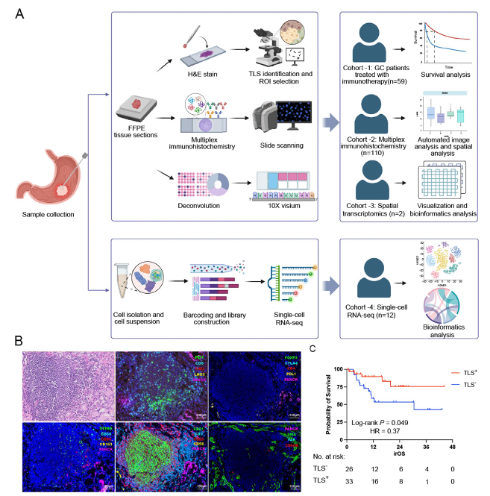
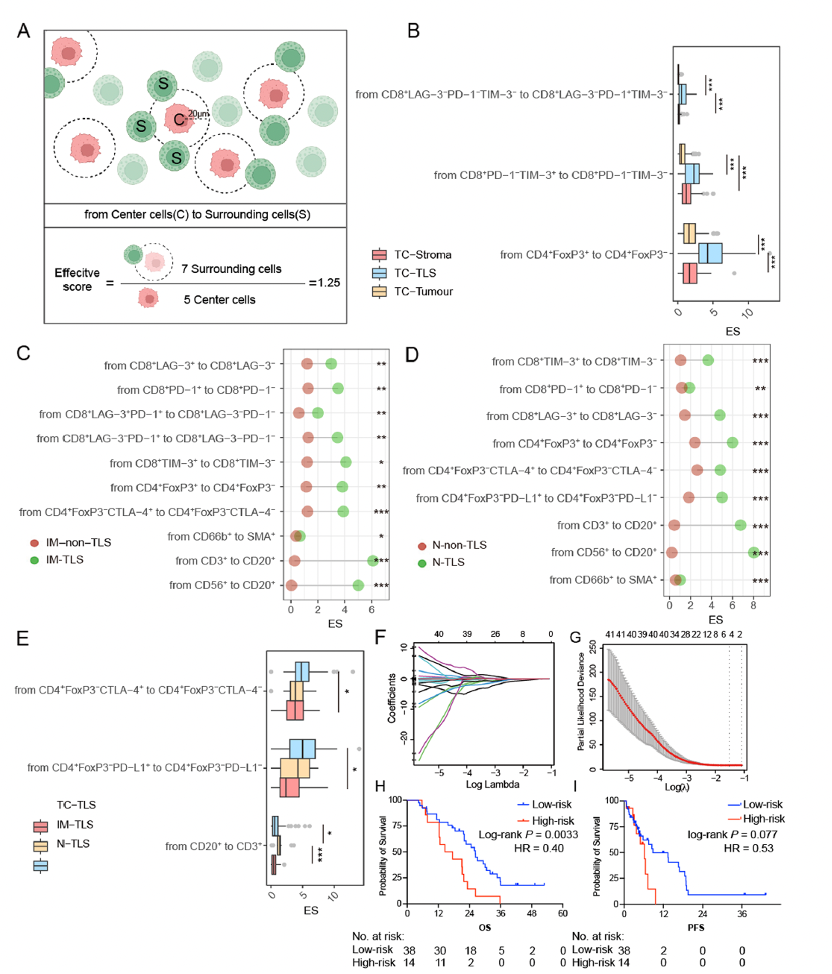
研究团队在接受免疫治疗的胃癌患者中进行了生存分析,肿瘤中心(tumor core, TC)区域存在TLS的患者群体展现了更佳的预后。此外,通过多重免疫荧光染色,分析了各个区域下TLS内部及周围的免疫细胞组成,发现肿瘤中心的TLS区域富含 CD8+LAG-3−PD-1+TIM-3− T细胞、CD4+PD-L1+ T细胞及CD4+FoxP3− T细胞,而这些T细胞亚型的丰度与患者的长期生存呈显著正相关。通过团队前期,建立的空间互作分析评分方法,进行免疫细胞空间互作分析,研究表明TLS内部的免疫细胞之间的距离更近, TLS能够促进免疫细胞之间的相互作用,从而增强抗肿瘤免疫力。
通过肿瘤空间免疫微环境整体景观,研究团队构建了基于免疫细胞密度和空间特征的风险评分模型(DSS模型)。该模型纳入了 CD8+LAG-3+ T细胞、CD4+FoxP3+CTLA-4+ T细胞、CD4+CTLA-4+PD-L1+ T细胞等五种免疫细胞特征,能够有效区分高风险和低风险胃癌患者。临床验证表明,该模型对胃癌患者的总生存期(Overall Survival,OS)和无进展生存期(Progression-Free Survival, PFS)具有较高的预测价值,为个体化免疫治疗提供了科学依据。
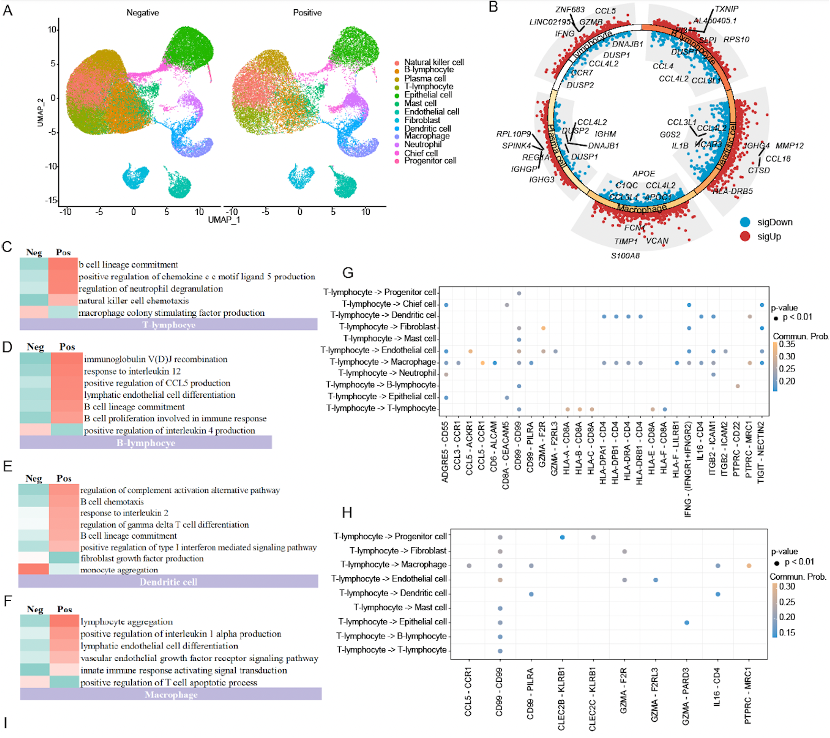
 为进一步探索TLS内部免疫细胞互作机制,团队通过对12例胃癌患者单细胞RNA测序(scRNA-seq)的肿瘤样本进行了深入分析。存在TLS的肿瘤微环境中,巨噬细胞与其他细胞类型之间的相互作用显著增强;CD8+ T细胞表达更多的GZMB和IFNG基因,与抗肿瘤免疫反应密切相关。此外, T细胞能够通过 GZMA-F2R/F2RL3 轴激活肿瘤细胞焦亡(pyroptosis),增强抗肿瘤免疫反应。
为进一步探索TLS内部免疫细胞互作机制,团队通过对12例胃癌患者单细胞RNA测序(scRNA-seq)的肿瘤样本进行了深入分析。存在TLS的肿瘤微环境中,巨噬细胞与其他细胞类型之间的相互作用显著增强;CD8+ T细胞表达更多的GZMB和IFNG基因,与抗肿瘤免疫反应密切相关。此外, T细胞能够通过 GZMA-F2R/F2RL3 轴激活肿瘤细胞焦亡(pyroptosis),增强抗肿瘤免疫反应。
本研究揭示了TLS的空间异质性,并构建了一种新型生存预测风险模型,研究揭示了TLS内部细胞通讯在塑造活跃免疫微环境中发挥的关键作用,同时指出不同细胞类型的组成和相互作用决定了TLS对于肿瘤进展以及治疗反应的能力,研究发现为提升免疫治疗响应提供了潜在策略。本文第一作者为:谢意博士、彭浩欣博士、胡雅洁博士、郏科人博士,通讯作者为:陈杨副教授、孙宇教授和沈琳教授。
此外,近年来随着人工智能(Artificial Intelligence , AI)技术的快速发展,特别是深度学习和大语言模型的应用,极大地推动了胃肠道肿瘤图像研究的最新进展,该团队以题为“Artificial Intelligence in Gastrointestinal Cancer Research: Image Learning Advances and Applications”的综述论文在国际学术期刊Cancer Letters发表。
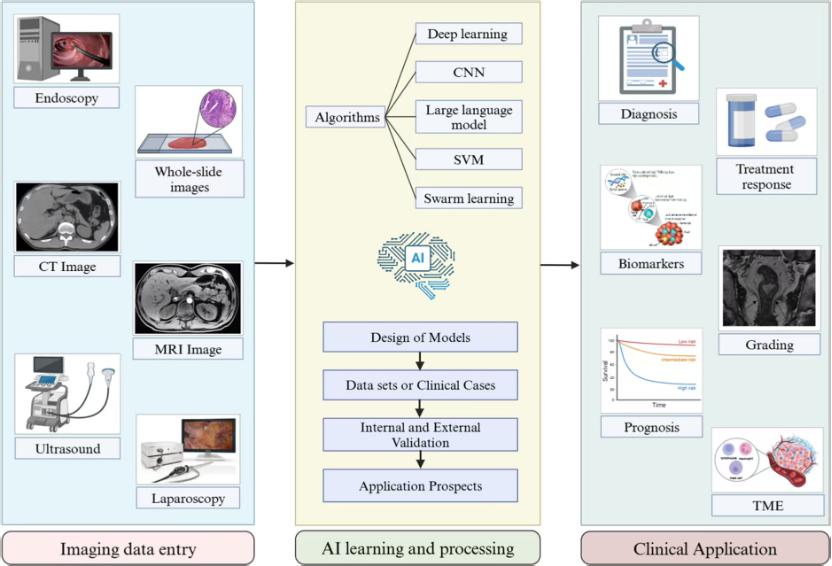
AI在胃肠道肿瘤的早期筛查和诊断中展现了巨大潜力。基于深度学习的计算机辅助诊断系统能够自动分析内镜、CT、MRI等影像数据,提高肿瘤检测的准确率和一致性。AI在组织病理学中的应用也显著增强了肿瘤分级和分期的准确性。该研究还总结了AI在胃肠道癌症的分子标志物识别、治疗方案优化以及预后预测中的作用。AI可用于检测微卫星不稳定性(MSI)和错配修复缺陷(dMMR)等关键生物标志物,为免疫治疗受益人群的筛选提供支持。同时,结合多组学分析,AI在肿瘤微环境的研究中也取得了重要进展,如通过计算病理学方法分析空间蛋白组学数据,预测免疫治疗的反应情况。AI在胃肠道癌症研究中的应用已进入快速发展阶段,未来随着大规模数据整合和算法优化,AI有望进一步提升癌症诊疗的精准度和个性化水平。
第一作者

通讯作者



1. Xie Y, Peng H, Hu Y, et al. Immune microenvironment spatial landscapes of tertiary lymphoid structures in gastric cancer. BMC Med. 2025 Feb 4;23(1):59. doi: 10.1186/ s12916-025-03889-3.
2. Zhou S, Xie Y, Feng X, et al.. Artificial Intelligence in Gastrointestinal Cancer Research: Image Learning Advances and Applications. Cancer Letters. 2025 Feb 217555.https://doi.org/10.1016/j.canlet.2025.217555.
排版编辑:肿瘤资讯-AS











 苏公网安备32059002004080号
苏公网安备32059002004080号


