HER2 阳性,即免疫组化(IHC)检测结果为 3+,这类乳腺癌约占所有乳腺癌病例的 20%,且大多数乳腺癌在一定程度上表达HER2。与HER2阴性患者相比,HER2阳性乳腺癌其肿瘤浸润淋巴细胞(TIL)、肿瘤突变负荷(TMB)和程序性死亡配体1(PD-L1)的表达水平更高。这些特征或许正是 HER2 阳性乳腺癌对免疫治疗反应更为强烈的潜在原因。
然而,尽管免疫治疗为乳腺癌治疗带来了新的希望,截至目前,在随机临床试验中,与标准 HER2靶向治疗方案相比,尚无免疫检查点抑制剂(ICI)能够显著改善治疗结局。不过,早期研究结果也给我们带来了一丝曙光,显示ICI对 PD-L1阳性疾病可能有一定的积极作用。
本文将基于领域综述1,深入梳理 HER2 阳性乳腺癌免疫治疗的现状以及相关研究进展,为读者呈现这一领域的前沿动态与发展趋势。
相关阅读:免疫疗法新征程:解锁乳腺癌治疗的多元密码
HR阳性乳腺癌经历了哪些研究历程?一文带您领略免疫治疗的今朝与未来
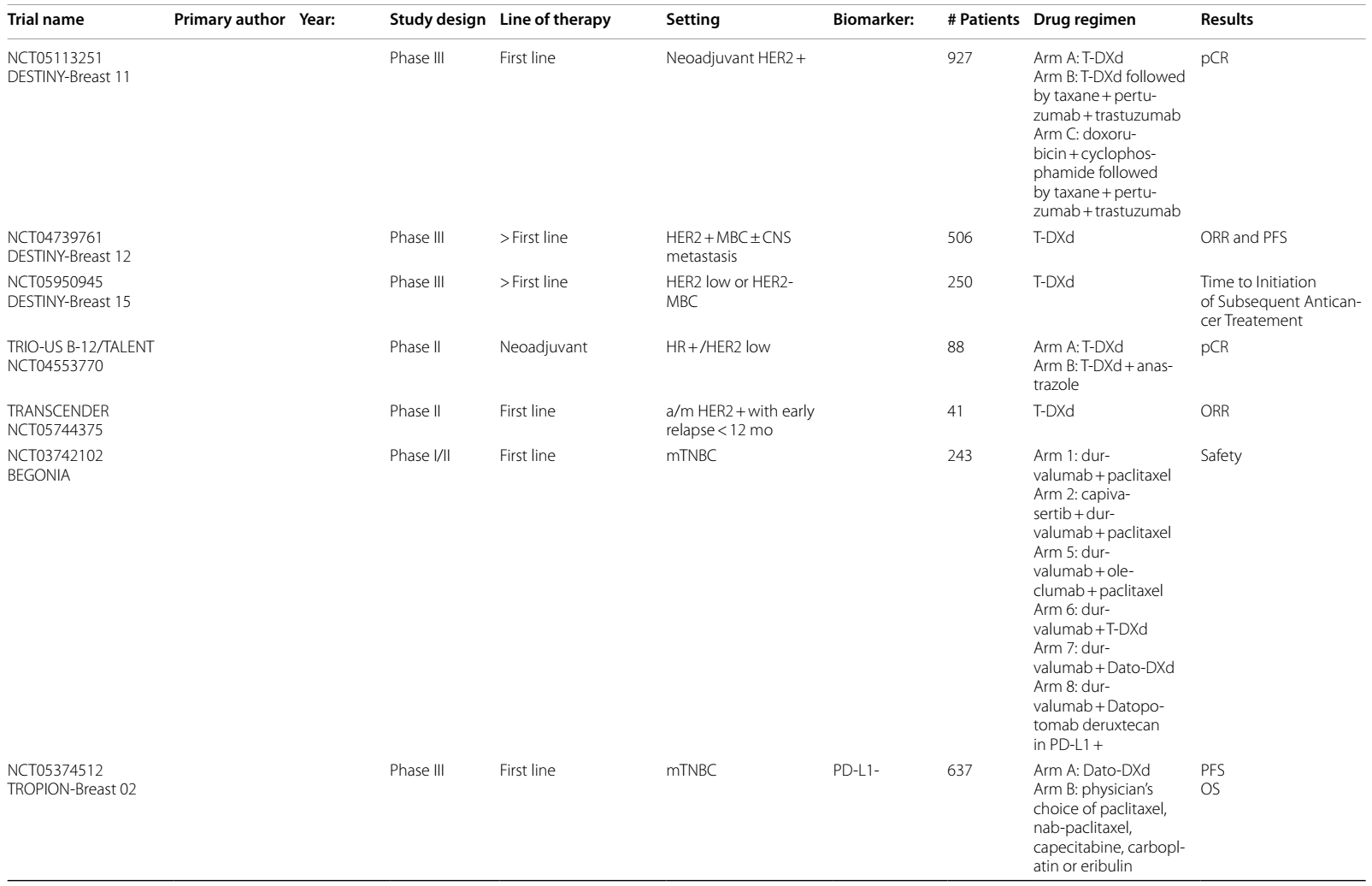
晚期及转移性HR-/HER2+乳腺癌
曲妥珠单抗+帕博利珠单抗
PANACEA Ib/II 期试验在既往接受曲妥珠单抗治疗后进展的晚期/转移性(a/m)HER2阳性乳腺癌患者中评价了曲妥珠单抗和帕博利珠单抗联合治疗。主要终点PD-L1+患者的 ORR为15%,PD-L1- 组无缓解2。不同PD-L1 状态的mPFS无差异(2.7个月vs. 2.5个月),但PD-L1+ 组的12个月OS在数值上更高 (65% vs. 12%)。
ICI+T-DM1
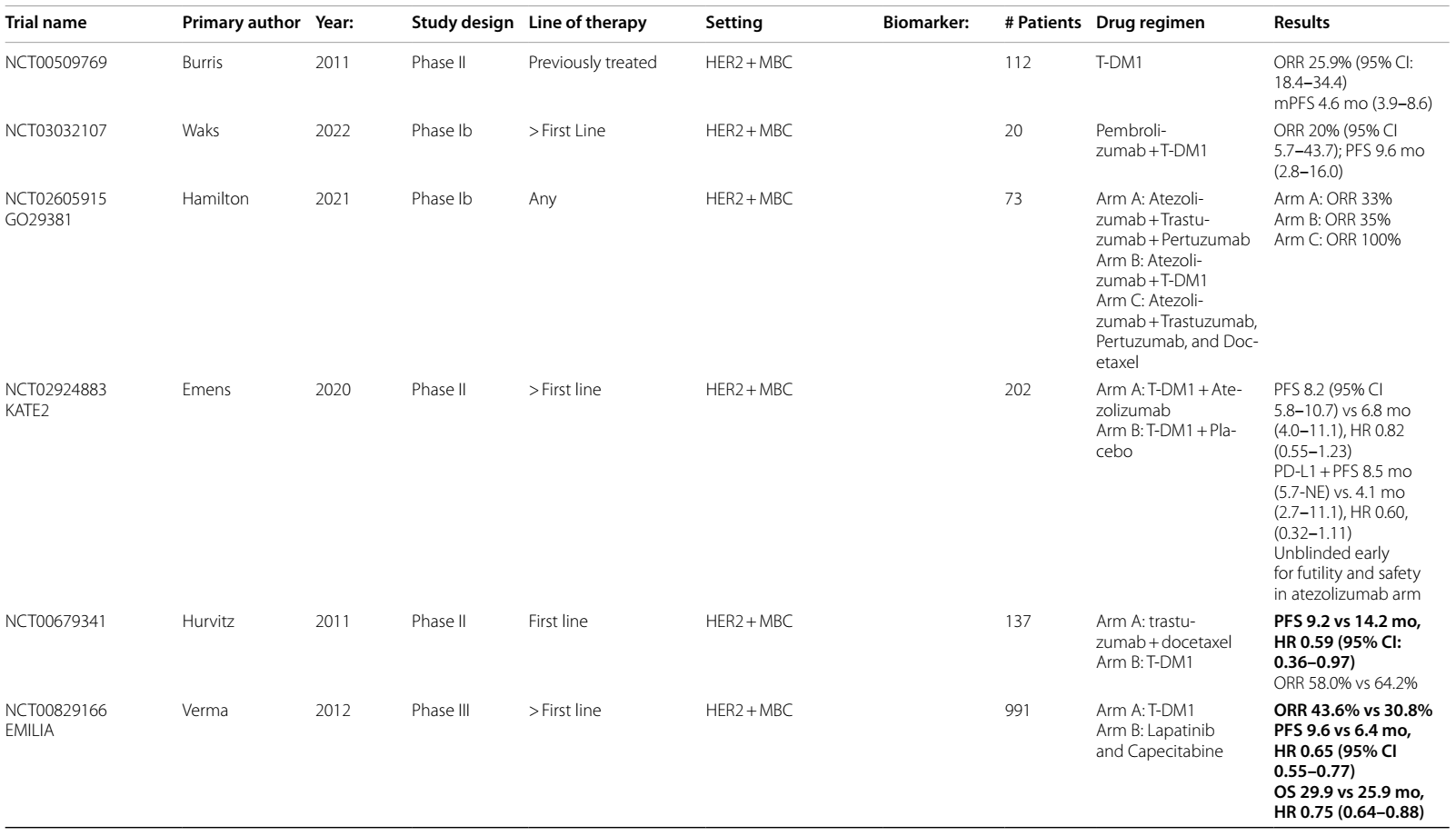
T-DM1是一种ADC,由曲妥珠单抗与细胞毒性微管抑制剂 DM1 连接而成,是新辅助化疗后HER2阳性残留疾病患者的标准治疗3。一项Ib期试验4分析了帕博利珠单抗联合 T-DM1 用于HER2阳性mBC的疗效,ORR为20%。另一项Ib期研究5中,阿替利珠单抗联合T-DM1治疗HER2阳性a/mBC的ORR为 35%,阿替利珠单抗联合曲妥珠单抗、帕妥珠单抗(HP)及多西他赛的ORR达100%。KATE2 II 期研究6在一线治疗后的 a/mBC中对T-DM1±阿替利珠单抗进行了比较,在ITT分析中PFS无显著改善,尽管治疗组中的患者出现了需要提前揭盲的毒性增加。然而,探索性分析发现,PD-L1+ 疾病患者的 PFS 有改善趋势。
T-DXd vs T-DM1
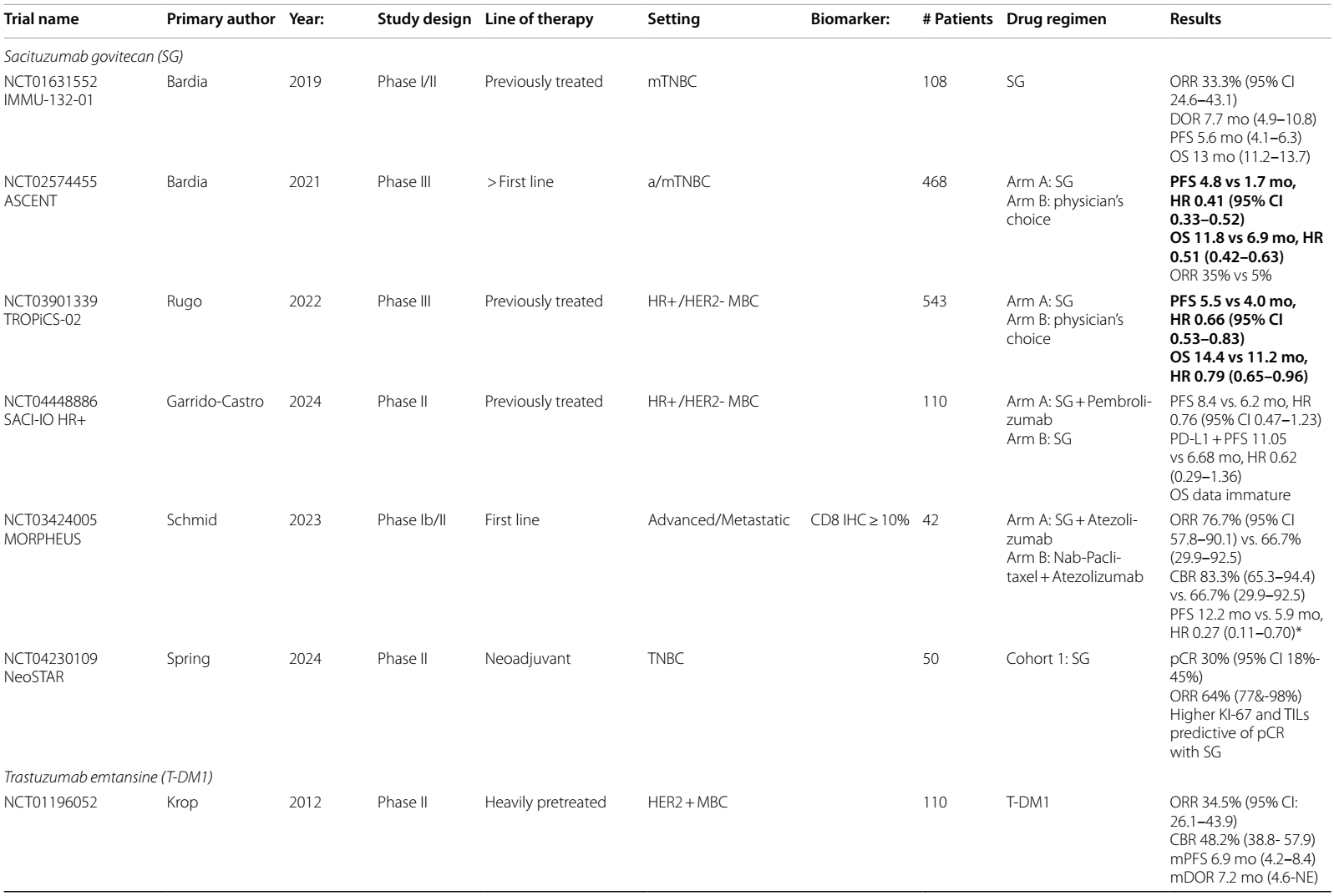
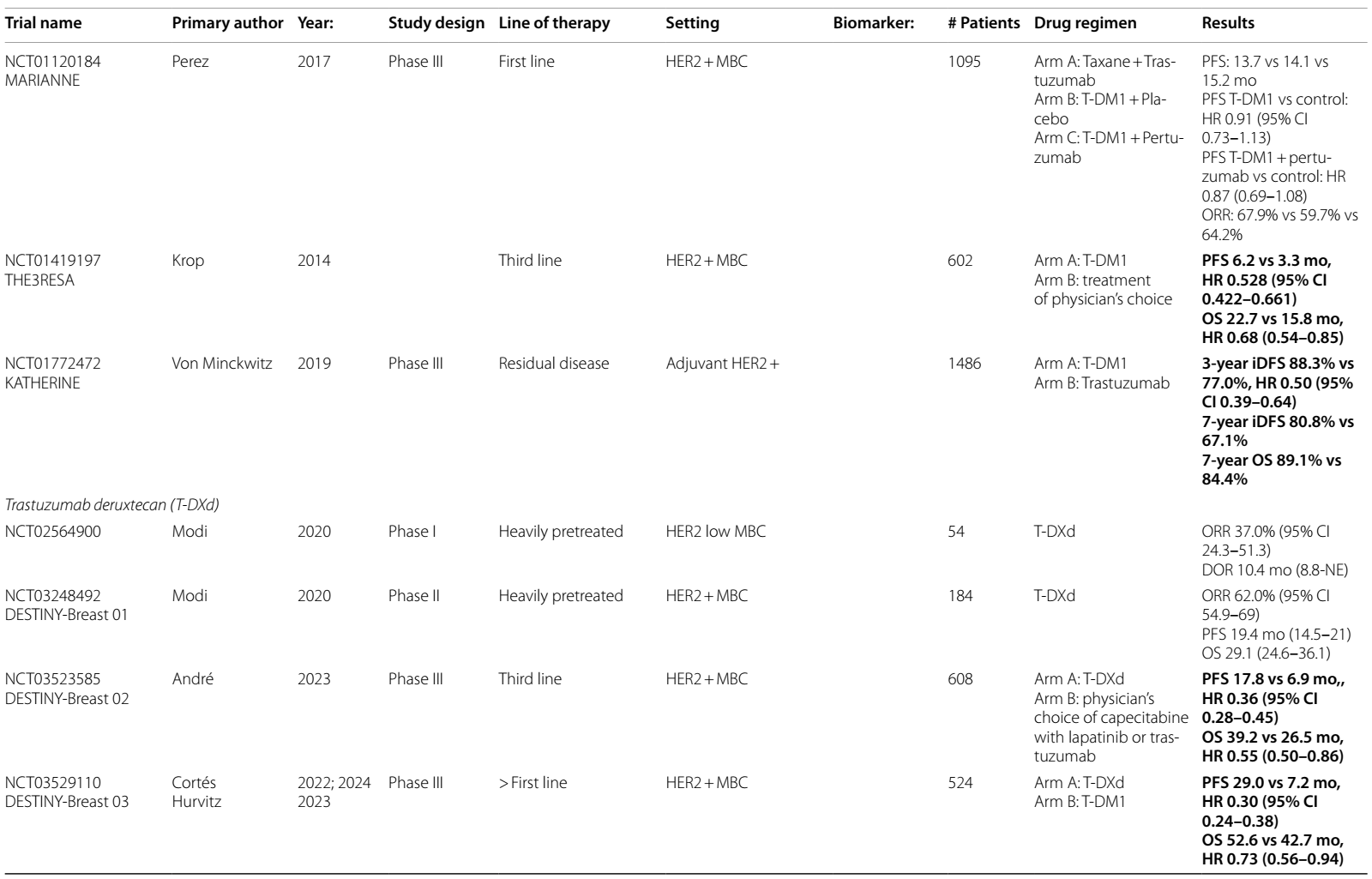
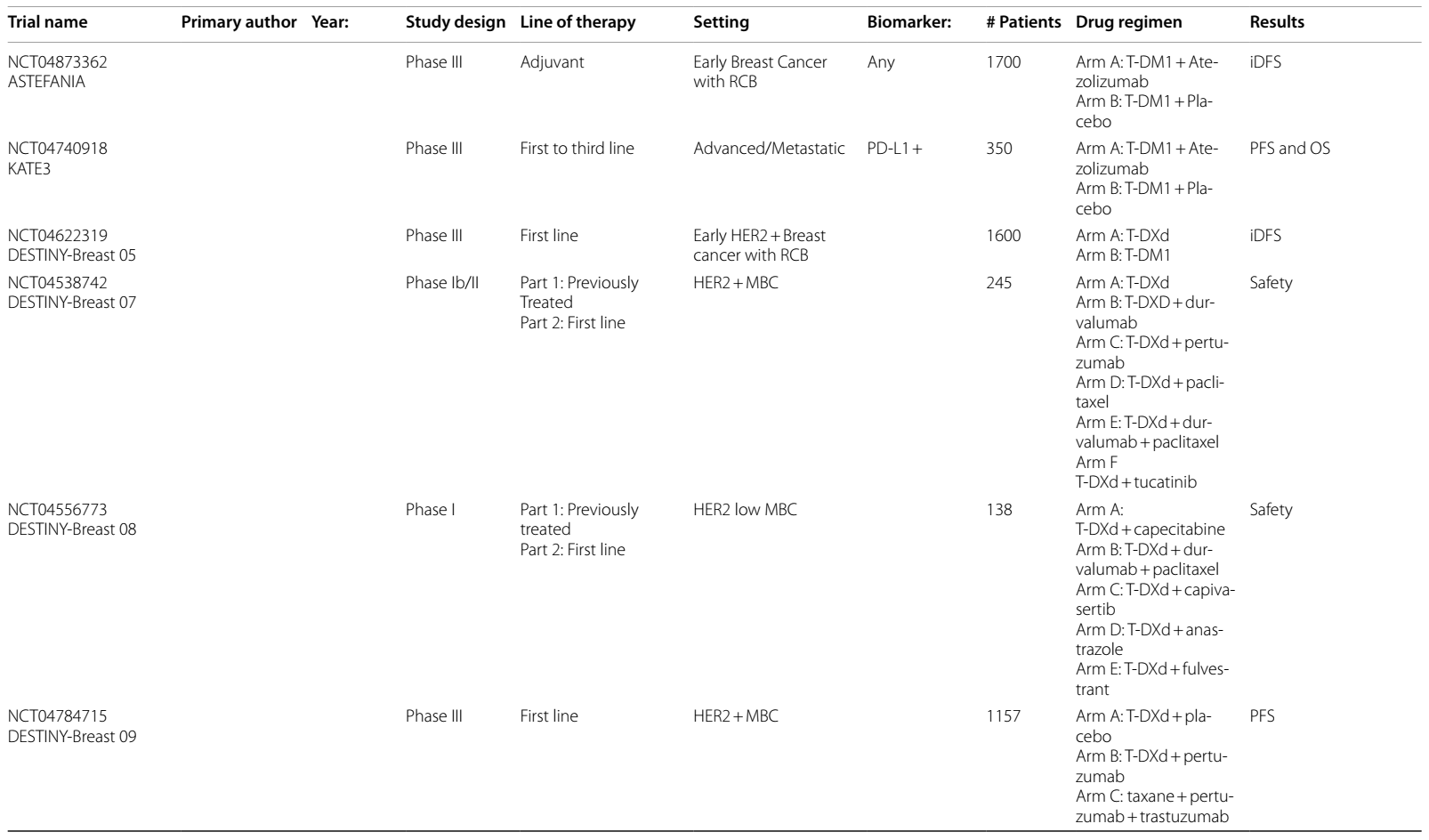
T-DXd是一种 HER2 靶向 ADC,改变了转移性 HER2 表达乳腺癌的治疗格局,并重新定义了 HER2 表达的分类。具有里程碑意义的DESTINY-Breast 03试验7–9表明,在二线治疗中,T-DXd与T-DM1 相比,PFS(29 vs 7.2个月)和OS(39.2 vs 26.5个月)显著改善,T-DXd组21.1%的患者出现完全缓解。脑转移患者的探索性亚组发现颅内ORR为65.7%,相比之下对照组为34.3%10。目前,T-DXd已获批用于二线治疗HER2阳性mBC。
基于这些研究,以及T-DXd 在肺癌和结直肠癌等其他实体瘤中的研究11–13,T-DXd 最近获得FDA全面批准,可用于经一线治疗后的任何HER2阳性晚期/转移性实体瘤。
其他ADC
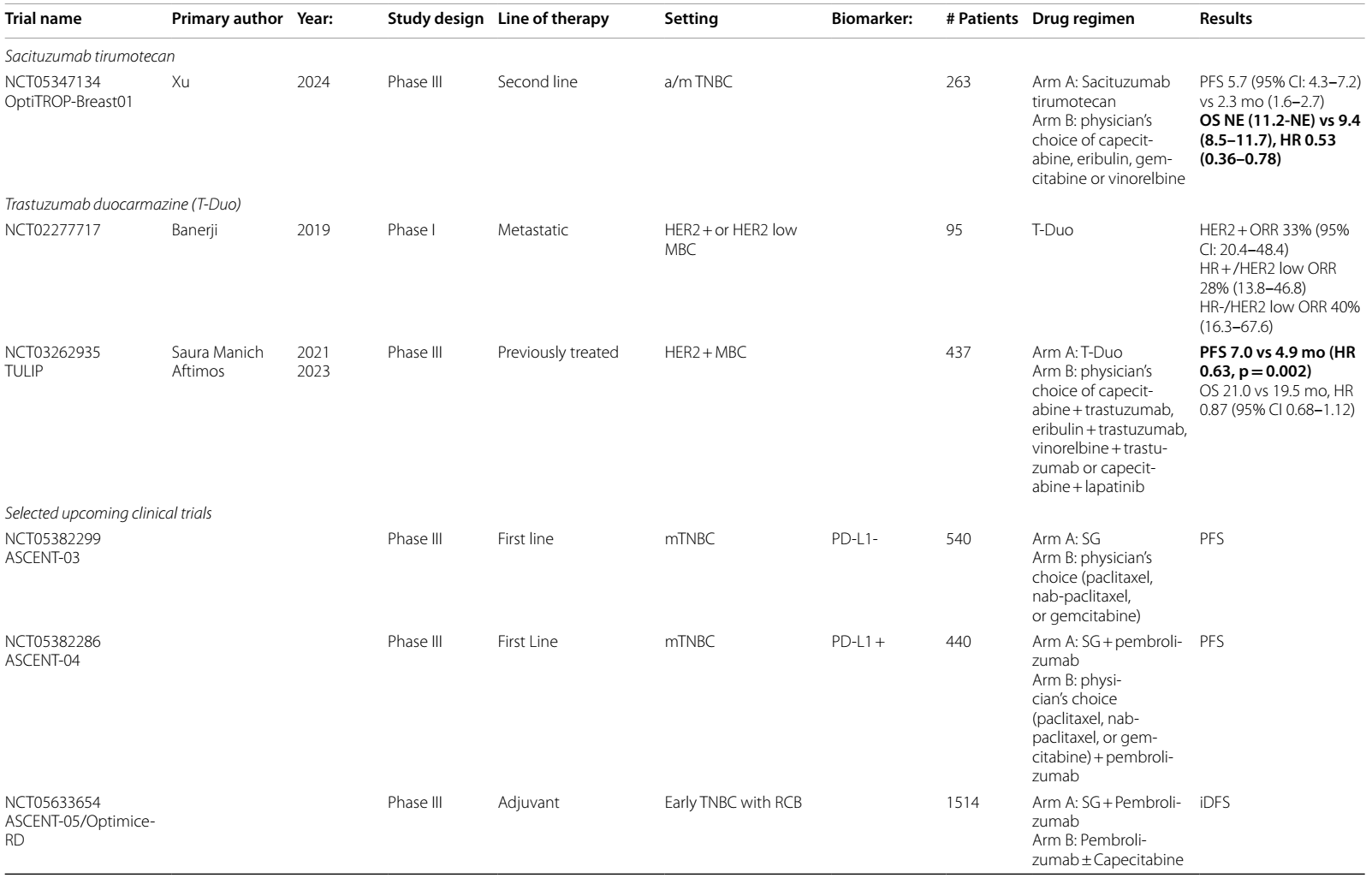
在HER2阳性mBC中研究的其他ADC为trastuzumab duocarmazine(T-Duo)。在 III 期 TULIP 试验14中,对HER2阳性mBC患者,在三线或更后线治疗中,或经T-DM1 预处理后,将其与化疗进行比较。结果观察到PFS改善(7.0 vs 4.9个月;HR 0.63)和 OS 改善趋势(21.0 vs 19.5个月;HR 0.87,95%CI 0.68-1.12)。
HER2低表达a/mBC
研究还发现,T-DXd 在传统上不被认为是 HER2 阳性(IHC 3+)的患者中也具有显著疗效。这将HER2表达谱从二元分类(阳性或阴性)重新定义为包括 HER2 低表达(IHC 1+ 或2+,ISH阴性)和 HER2 超低表达(≥10% 的肿瘤细胞中出现微弱、不完整的膜染色,低于 IHC 1+)。
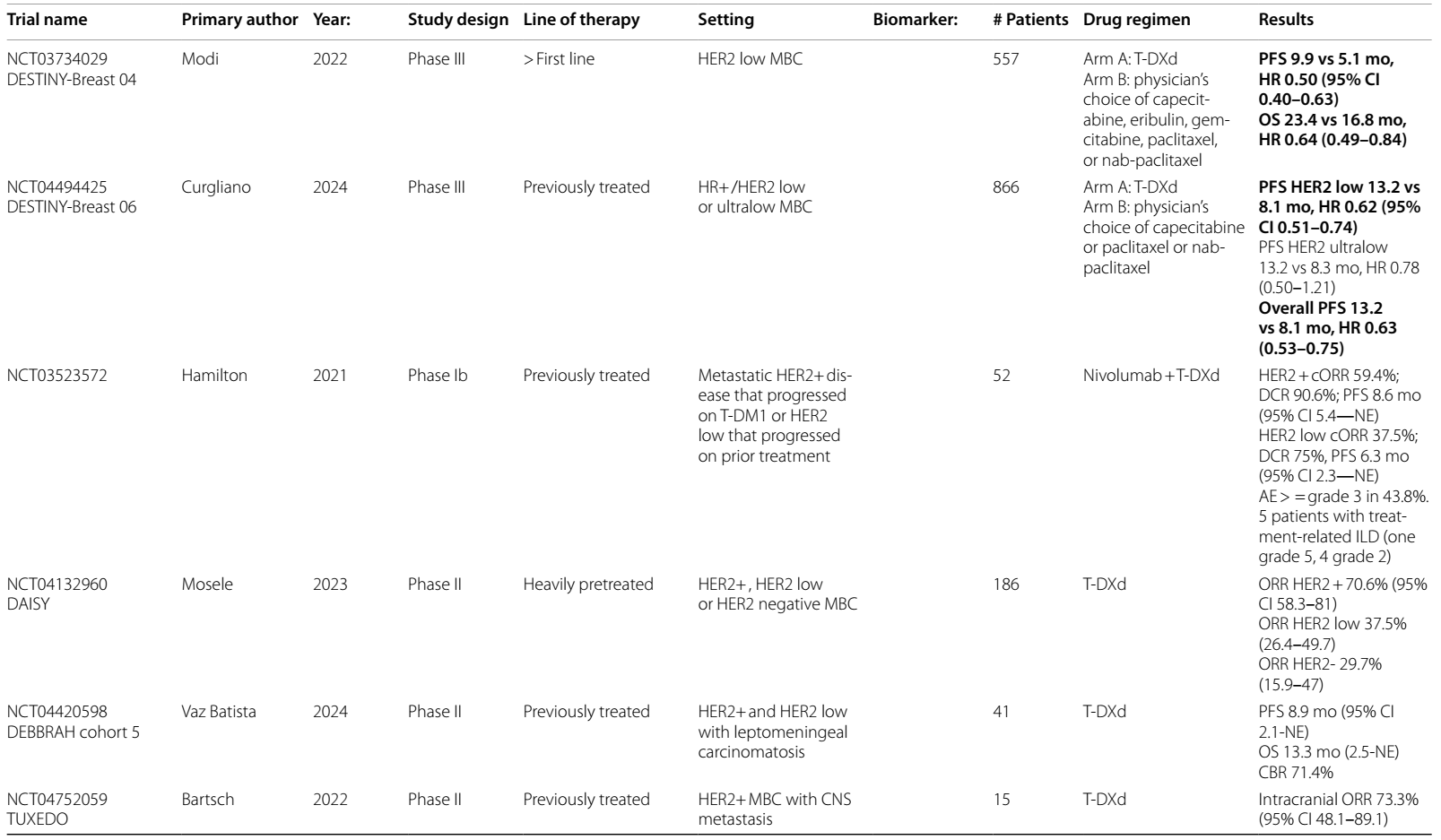
DESTINY-Breast 04 II 期试验15发现,对于二线或三线 HER2低表达mBC 患者,与医生选择的化疗方案相比,T-DXd显著改善了PFS(9.9 vs 5.1个月)和OS(23.4 vs 16.8个月),促使 FDA 批准其用于HER2低表达mBC适应症。DESTINY-Breast 0616的最新结果评估了 T-DXd 用于未接受过化疗的 HER2低表达或 HER2超低表达mBC患者的疗效,发现与标准化疗相比,PFS 有 5 个月的优势(HR 0.63)。BEGONIA 试验的队列617分析了T-DXd 联合度伐利尤单抗用于HER2低表达a/mBC患者的疗效,结果显示ORR为 57%,mPFS 为 12.6 个月。
早期 HR-/HER2+BC
在一项新辅助化疗后使用帕博利珠单抗、HP的 II 期18试验中,pCR率为46%。III 期试验IMPassion05019对 454 例高危 HER2阳性患者展开研究,患者接受新辅助阿替利珠单抗/安慰剂+AC,序贯紫杉醇和PH治疗,辅助治疗阶段采用阿替利珠单抗/安慰剂及HP。ITT 或PD-L1+ 亚组中未观察到 pCR 差异,EFS数据不成熟。不良事件在治疗组中更常见,免疫治疗组中2例死亡(肺泡炎、脓毒性休克)归因于治疗。
HR-/HER2+BC即将开展的临床试验
ASTEFANIA(NCT04873362)III 期试验正在探究,对于新辅助治疗后仍有残留病灶的患者,在辅助治疗阶段使用T-DM1±阿替利珠单抗的疗效,旨在提升目前针对辅助治疗RCB患者的标准治疗效果。KATE3(NCT04740918)是一项III 期试验,将评估 KATE2 方案用于一线至三线a/m PD-L1+疾病患者的疗效。另一项III 期试验(NCT03199885)正在研究,在一线转移性治疗中,紫杉醇联合HP及阿替利珠单抗/安慰剂的疗效,目标是明确ICIs在HER2阳性 a/mBC中的作用。
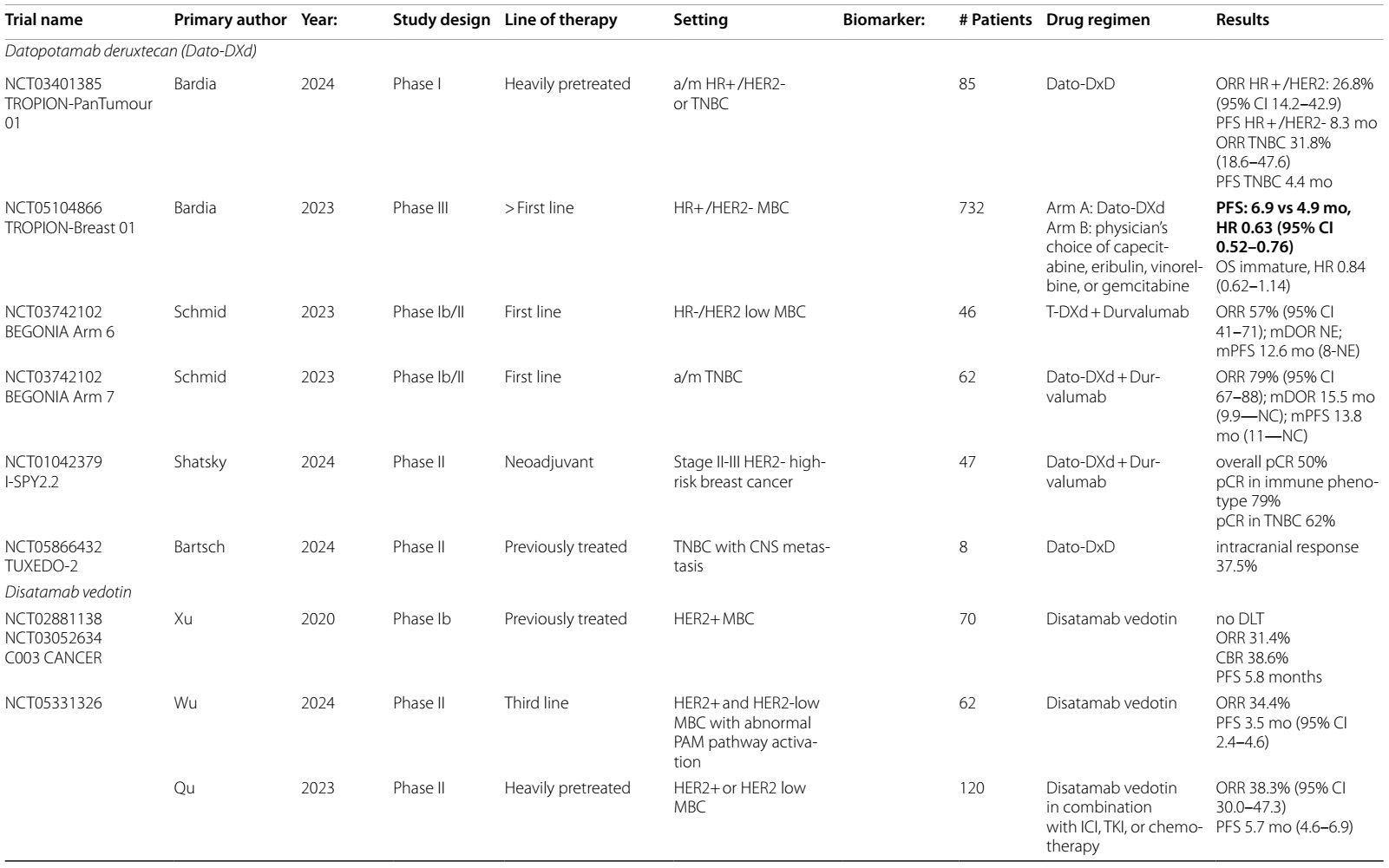
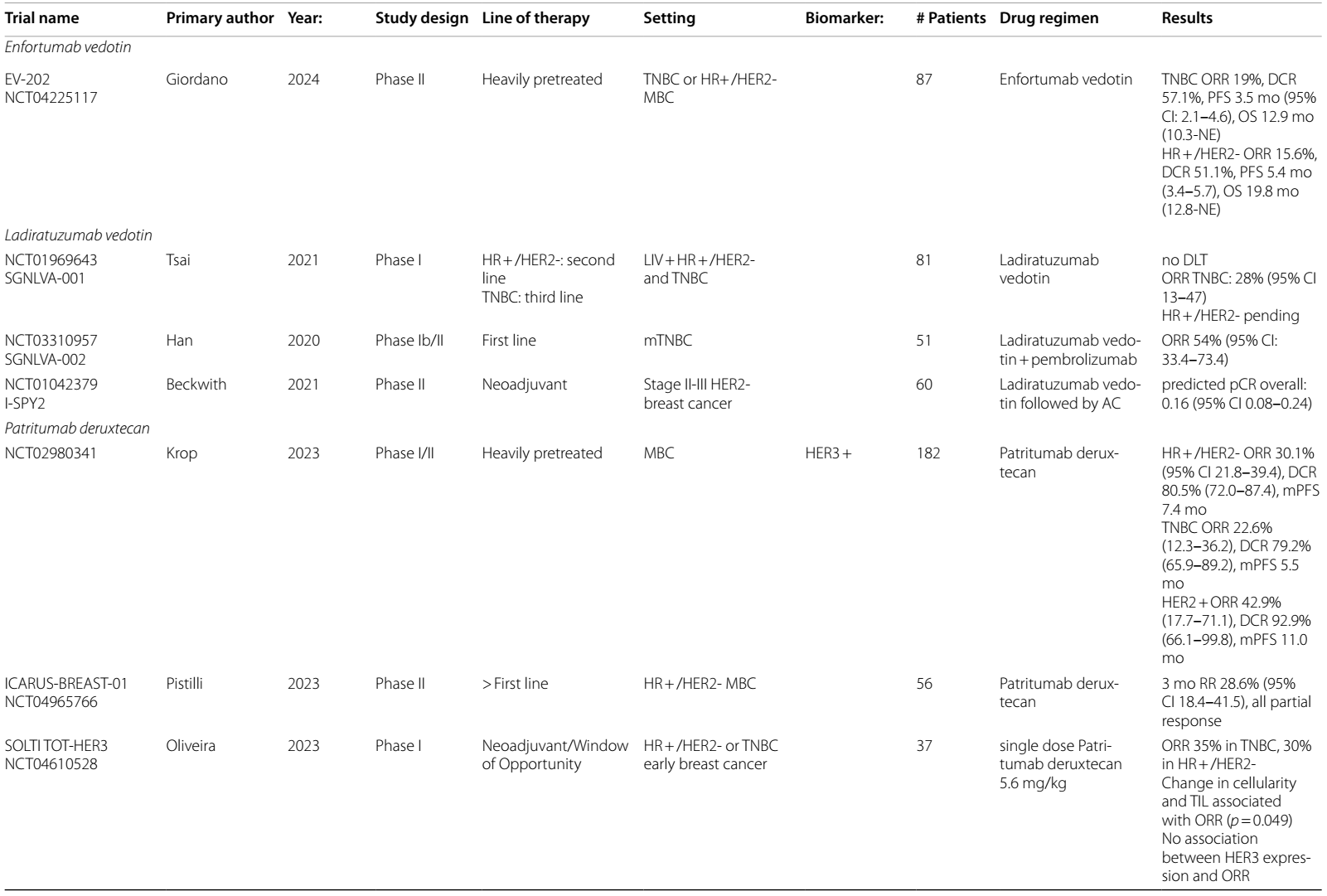
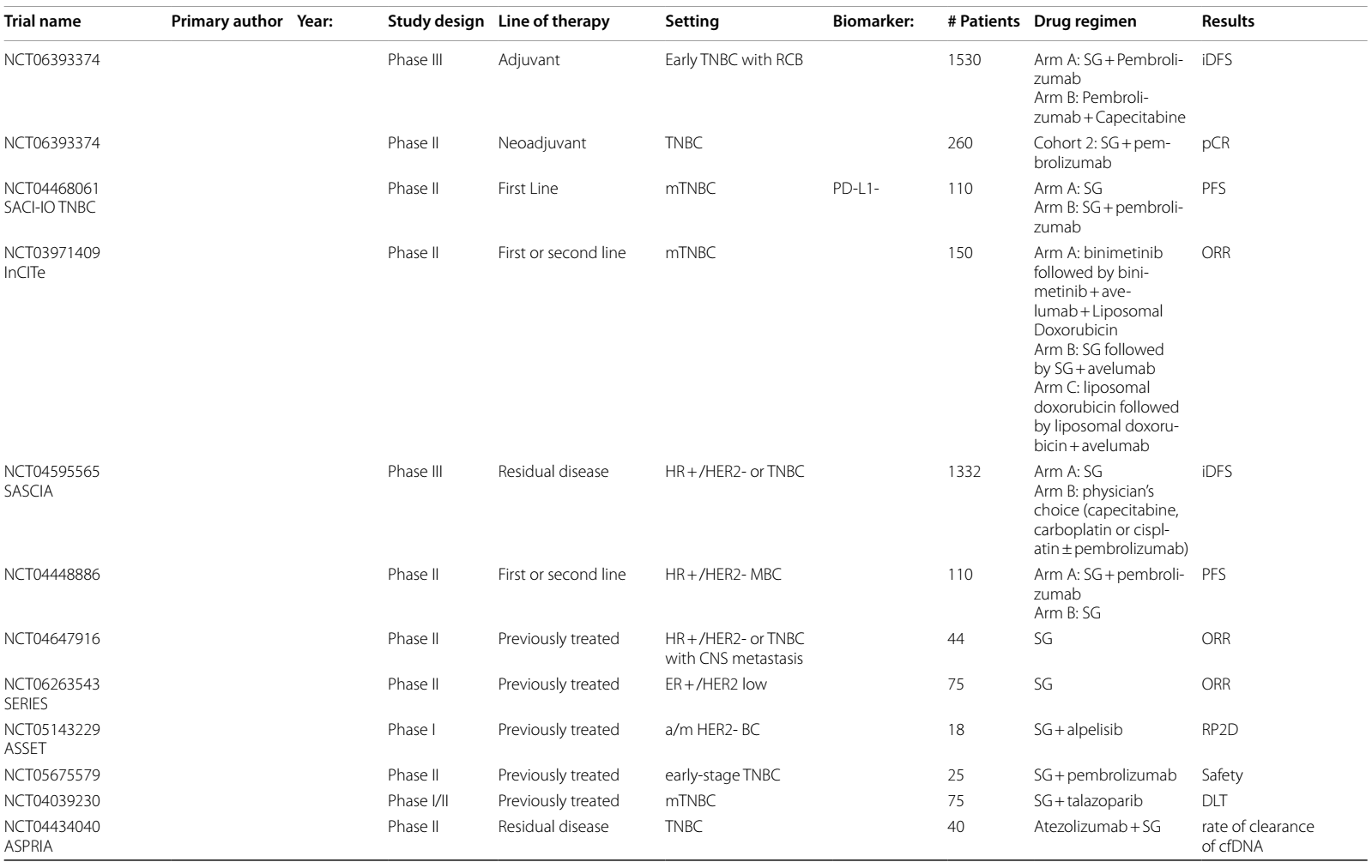
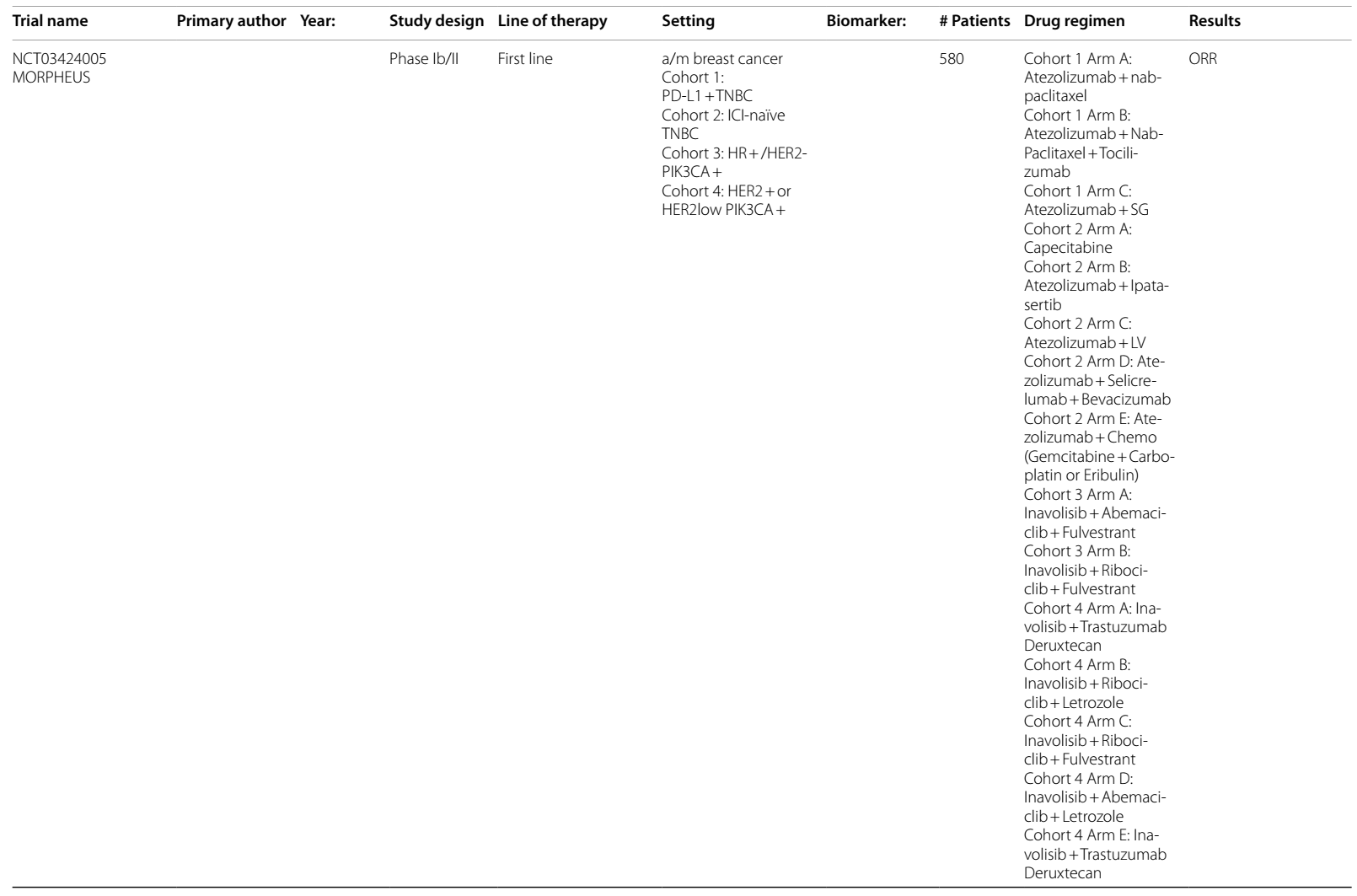
表1 ICIs在HER2阳性乳腺癌中当前和即将进行的临床试验
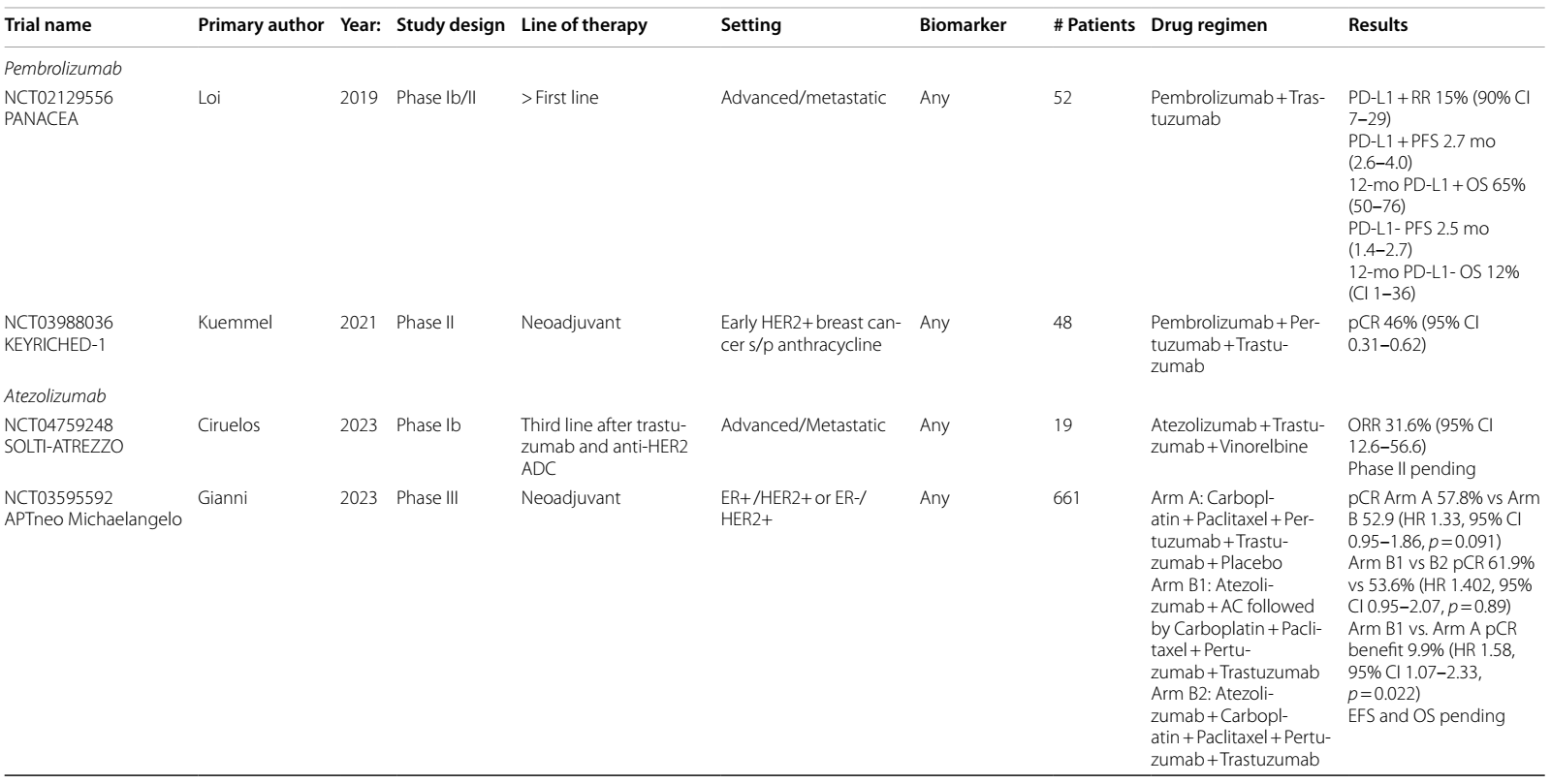
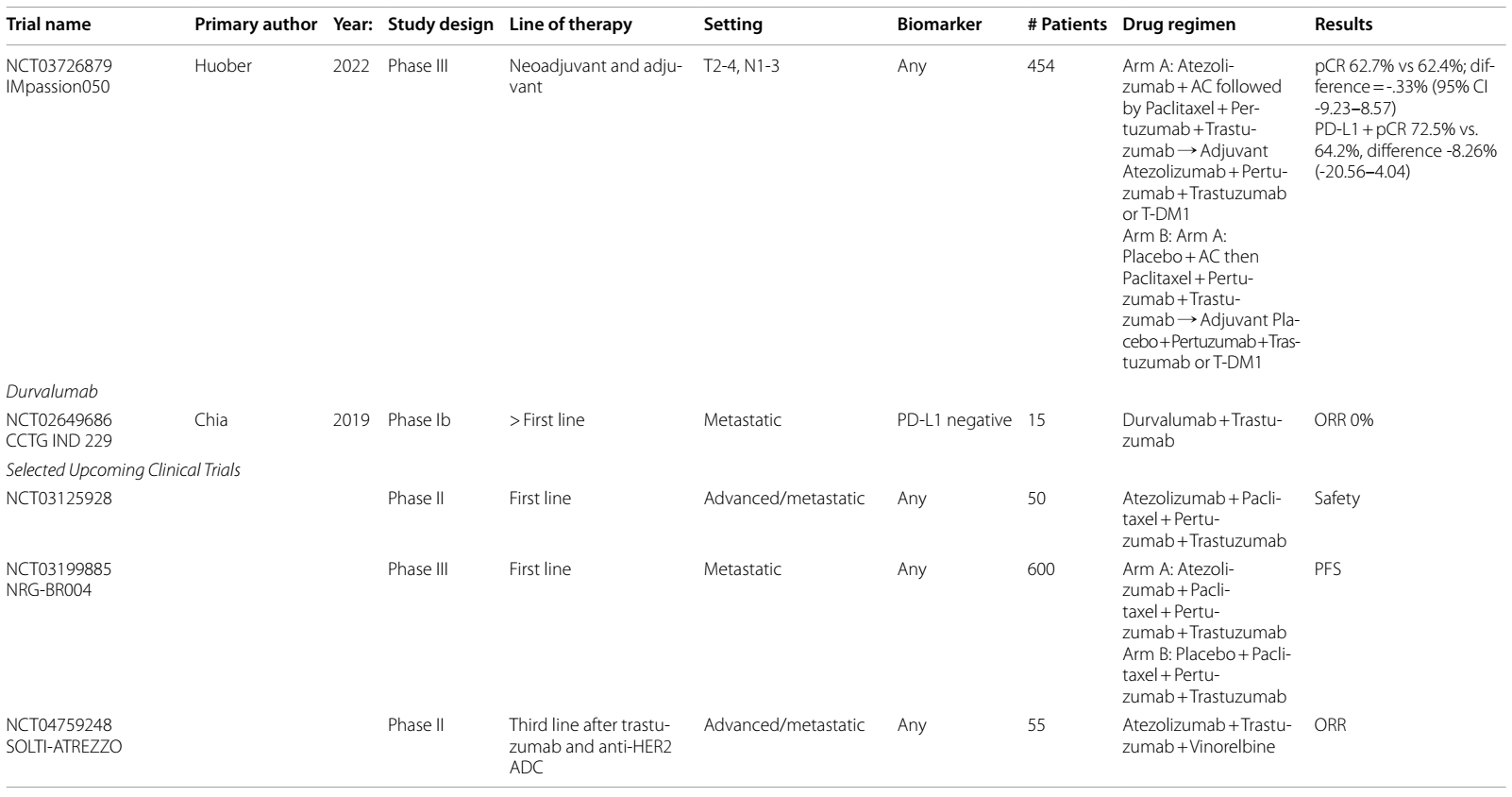
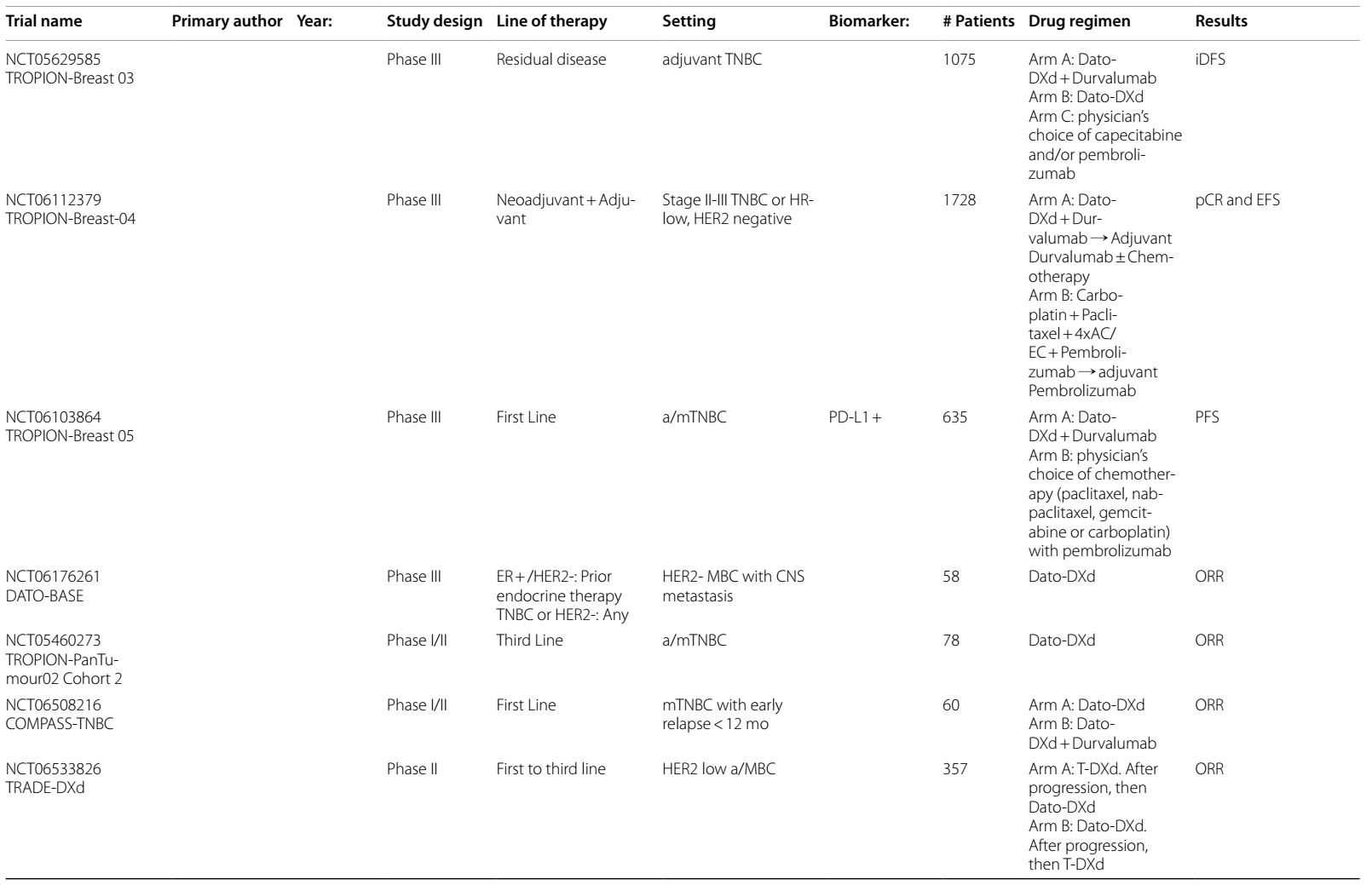
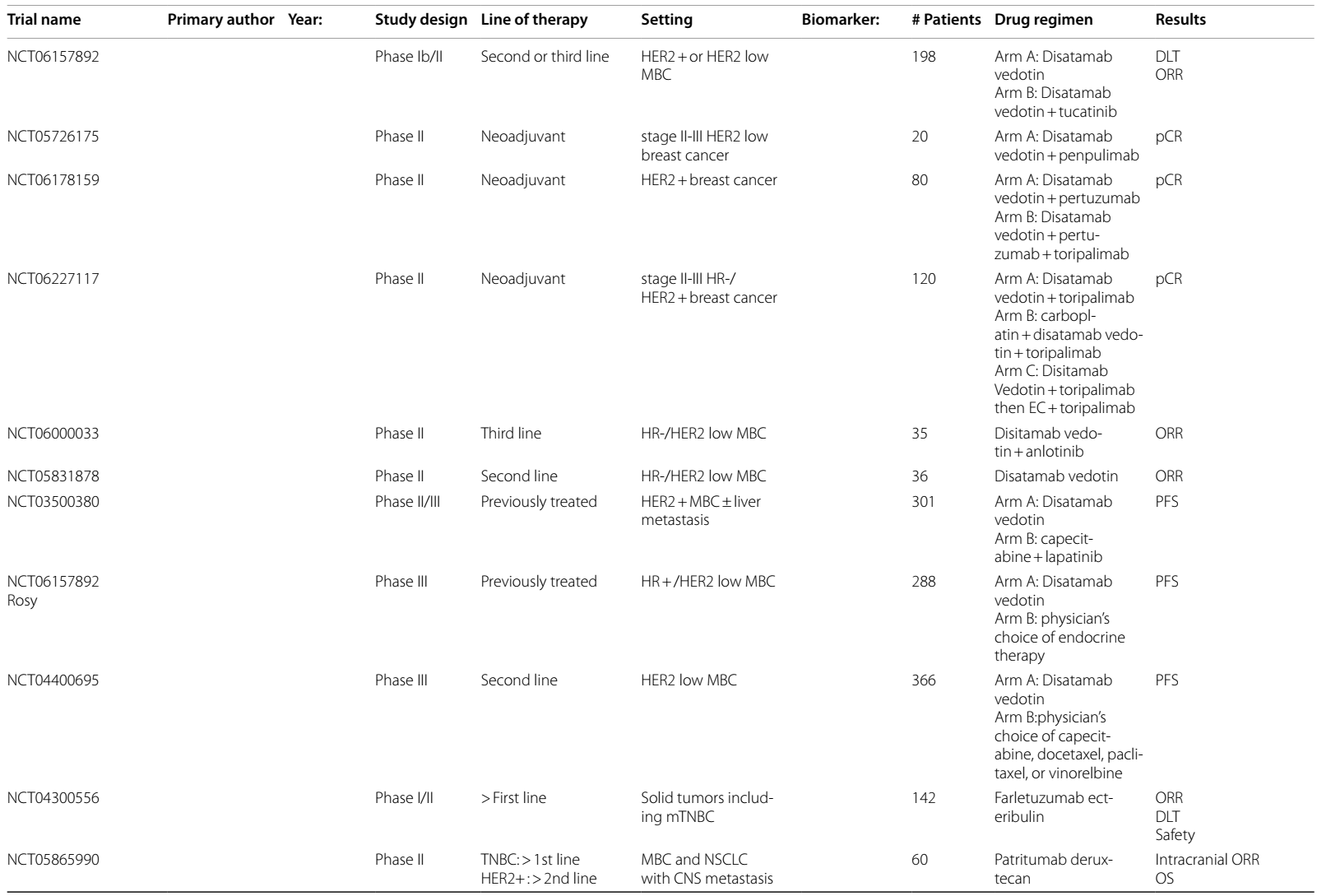
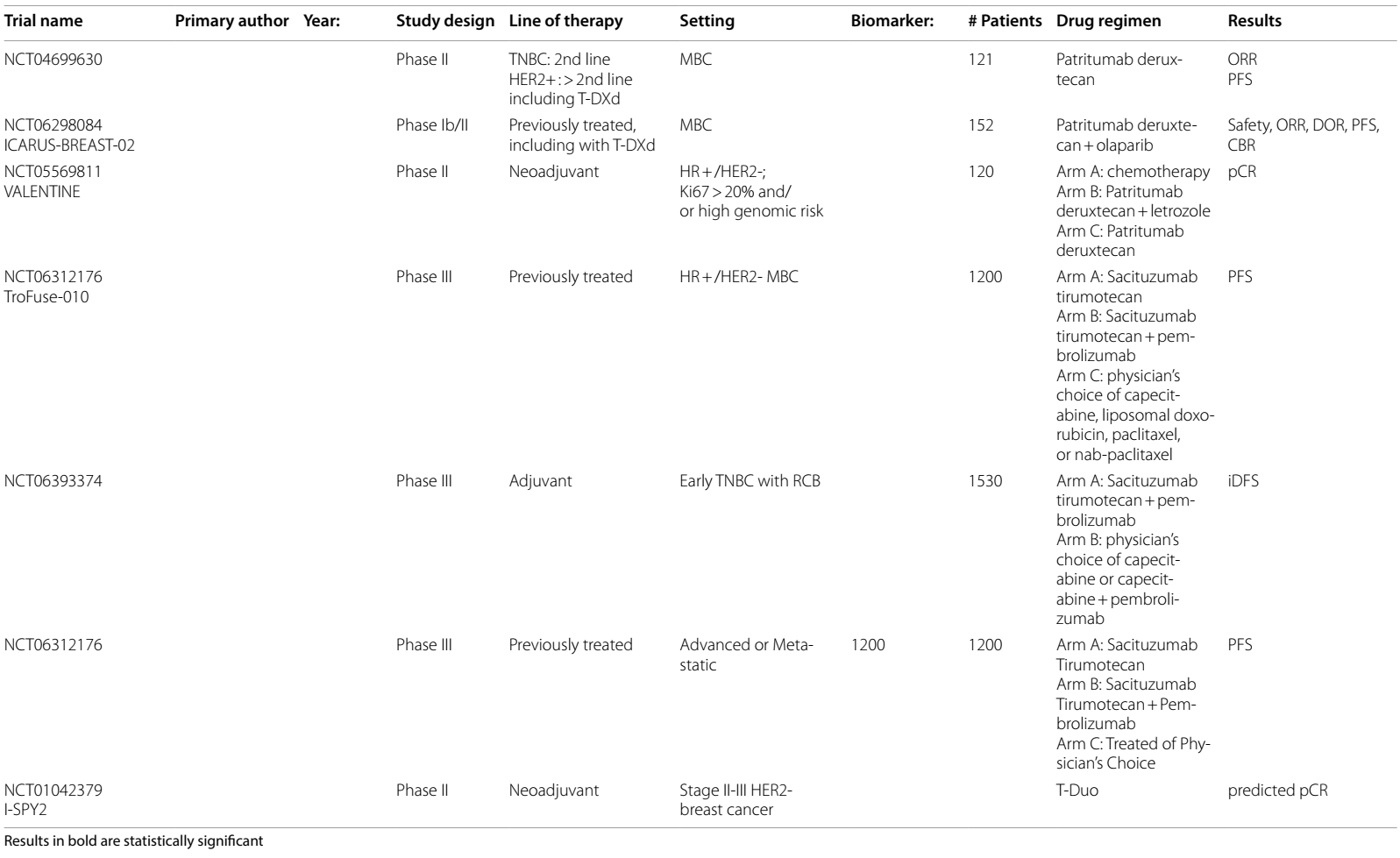
表2 ADCs在乳腺癌中当前和即将进行的临床试验
1. Heater NK, Warrior S, Lu J. Current and future immunotherapy for breast cancer. J Hematol Oncol. 2024 Dec 25;17(1):131. doi: 10.1186/s13045-024-01649-z.
2. Loi S, Giobbie-Hurder A, Gombos A, et al. Pembrolizumab plus trastuzumab in trastuzumab-resistant, advanced, HER2-positive breast cancer (PANACEA): a single-arm, multicentre, phase 1b–2 trial. Lancet Oncol. 2019;20(3):371–82.
3. Loibl S, Mano M, Untch M, et al. Abstract GS03-12: Phase III study of adjuvant ado-trastuzumab emtansine vs trastuzumab for residual invasive HER2-positive early breast cancer after neoadjuvant chemotherapy and HER2-targeted therapy: KATHERINE final IDFS and updated OS analysis. Cancer Res. 2024;84(9_Supplement):GS03-12-GS03-12. 10.1158/1538-7445.SABCS23-GS03-12.
4. Waks AG, Keenan TE, Li T, et al. Phase Ib study of pembrolizumab in combination with trastuzumab emtansine for metastatic HER2-positive breast cancer. J Immunother Cancer. 2022;10(10):e005119.
5. Hamilton EP, Kaklamani V, Falkson C, et al. Impact of Anti-HER2 treatments combined with atezolizumab on the tumor immune microenvironment in early or metastatic breast cancer: results from a phase Ib study. Clin Breast Cancer. 2021;21(6):539–51.
6. Emens LA, Esteva FJ, Beresford M, et al. Trastuzumab emtansine plus atezolizumab versus trastuzumab emtansine plus placebo in previously treated, HER2-positive advanced breast cancer (KATE2): a phase 2, multicentre, randomised, double-blind trial. Lancet Oncol. 2020;21(10):1283–95.
7. Cortés J, Kim S-B, Chung W-P, et al. Trastuzumab deruxtecan versus trastuzumab emtansine for breast cancer. N Engl J Med. 2022;386(12):1143–54.
8. Hurvitz SA, Hegg R, Chung W-P, et al. Trastuzumab deruxtecan versus trastuzumab emtansine in patients with HER2-positive metastatic breast cancer: updated results from DESTINY-Breast03, a randomised, open-label, phase 3 trial. The Lancet. 2023;401(10371):105–17.
9. Cortés J, Hurvitz SA, Im S-A, et al. Trastuzumab deruxtecan versus trastuzumab emtansine in HER2-positive metastatic breast cancer: long-term survival analysis of the DESTINY-breast03 trial. Nat Med. 2024;30(8):2208–15.
10. Hurvitz SA, Kim SB, Chung WP, et al. Trastuzumab deruxtecan versus trastuzumab emtansine in HER2-positive metastatic breast cancer patients with brain metastases from the randomized DESTINY-Breast03 trial. ESMO Open. 2024;9(5):102924.
11. Smit EF, Felip E, Uprety D, et al. Trastuzumab deruxtecan in patients with metastatic non-small-cell lung cancer (DESTINY-Lung01): primary results of the HER2-overexpressing cohorts from a single-arm, phase 2 trial. Lancet Oncol. 2024;25(4):439–54.
12. Raghav KPS, Siena S, Takashima A, et al. Trastuzumab deruxtecan (T-DXd) in patients (pts) with HER2-overexpressing/amplified (HER2阳性) metastatic colorectal cancer (mCRC): primary results from the multicenter, randomized, phase 2 DESTINY-CRC02 study. J Clin Oncol. 2023;41(16_suppl):3501–3501. 10.1200/JCO.2023.41.16_suppl.3501.
13. Meric-Bernstam F, Makker V, Oaknin A, et al. Efficacy and safety of trastuzumab deruxtecan in patients with HER2-expressing solid tumors: primary results from the DESTINY-PanTumor02 phase II trial. J Clin Oncol. 2024;42(1):47–58.
14. Aftimos PG, Turner N, O’Shaughnessy J, et al. 386MO Trastuzumab duocarmazine versus physician’s choice therapy in pre-treated HER2-positive metastatic breast cancer: Final results of the phase III TULIP trial. Ann Oncol. 2023;34:S340–1. [Google Scholar].
15. Modi S, Jacot W, Yamashita T, et al. Trastuzumab deruxtecan in previously treated HER2-low advanced breast cancer. N Engl J Med. 2022;387(1):9–20.
16. Curigliano G, Xichun H, Dent RA, et al. Trastuzumab deruxtecan (T-DXd) vs physician’s choice of chemotherapy (TPC) in patients (pts) with hormone receptor-positive (HR+), human epidermal growth factor receptor 2 (HER2)-low or HER2-ultralow metastatic breast cancer (mBC) with prior endocrine. J Clin Oncol. 2024;42(17_suppl):LBA1000–LBA1000. 10.1200/JCO.2024.42.17_suppl.LBA1000.
17. Schmid P, Wysocki P, Park YH, et al. Abstract PD11-08: PD11-08 Trastuzumab deruxtecan (T-DXd) + durvalumab (D) as first-line (1L) treatment for unresectable locally advanced/metastatic hormone receptor-negative (HR−), HER2-low breast cancer: updated results from BEGONIA, a phase 1b/2 study. Cancer Res. 2023;83(5_Supplement):PD11-08-PD11-08. 10.1158/1538-7445.SABCS22-PD11-08.
18. Kuemmel S, Gluz O, Reinisch M, et al. Abstract PD10-11: Keyriched-1- A prospective, multicenter, open label, neoadjuvant phase ii single arm study with pembrolizumab in combination with dual anti-HER2 blockade with trastuzumab and pertuzumab in early breast cancer patients with molecular HER2. Can Res. 2022;82(4_Supplement):PD10-11-PD10-11. 10.1158/1538-7445.SABCS21-PD10-11.
19. Huober J, Barrios CH, Niikura N, et al. Atezolizumab With neoadjuvant anti-human epidermal growth factor receptor 2 therapy and chemotherapy in human epidermal growth factor receptor 2–positive early breast cancer: primary results of the randomized phase III IMpassion050 trial. J Clin Oncol. 2022;40(25):2946–56.
排版编辑:肿瘤资讯-Jina











 苏公网安备32059002004080号
苏公网安备32059002004080号


