2025年美国临床肿瘤学会胃肠道肿瘤研讨会(ASCO GI)于1月23~25日在旧金山盛大召开,全球消化肿瘤领域的最新研究进展纷纷亮相。其中,“多中心、随机、III期SCIENCE研究的初步结果:比较化疗联合信迪利单抗、放化疗联合信迪利单抗与单纯放化疗用于可切除局部晚期食管鳞癌(ESCC)新辅助治疗的疗效”以LBA(Late-Breaking Abstract)脱颖而出,该研究聚焦于不同新辅助治疗方案在可切除局部晚期ESCC中的疗效和安全性,引发领域广泛关注。在ASCO GI现场,四川省肿瘤医院冷雪峰教授口头报告了该研究的初步结果。【肿瘤资讯】特邀冷雪峰教授进行了深度访谈,详细解读该研究的设计、成果以及未来的研究方向。
医学博士, 副主任医师,副研究员,研究生导师
日本国立癌症中心访问学者,省学术和技术带头人后备人选,省卫健委高层次人才
荣获美国AATS Thoracic Surgery Fellowship Program
国家卫健委第44期中日笹川医学奖学金
首届“人民好医生·金山茶花计划”杰出贡献奖(食管癌领域)
CSCO中国临床肿瘤学会全国“35 under 35”最具潜力青年肿瘤医师之一
日本食管学会(JES) 会员
中国抗癌协会 青年理事
中国抗癌协会食管癌专业委员会 委员
中国抗癌协会纵隔肿瘤专业委员会 委员
中国临床肿瘤学会(CSCO)食管癌专业委员会 委员
四川省预防医学会食管肿瘤防治与管理分会 主任委员
四川省医师协会胸外科医师分会 常委
四川省抗癌协会食管癌专业委员会 副主任委员
四川省预防医学会胸部肿瘤多学科防治分会 副主任委员
四川省预防医学会临床生物样本与数据管理分会 副主任委员
四川省国际医学交流促进会食管疾病专业委员会 副主任委员
四川省医学传播协会食管疾病专业委员会 副主任委员
四川省抗癌协会纵隔肿瘤专业委员会 常委

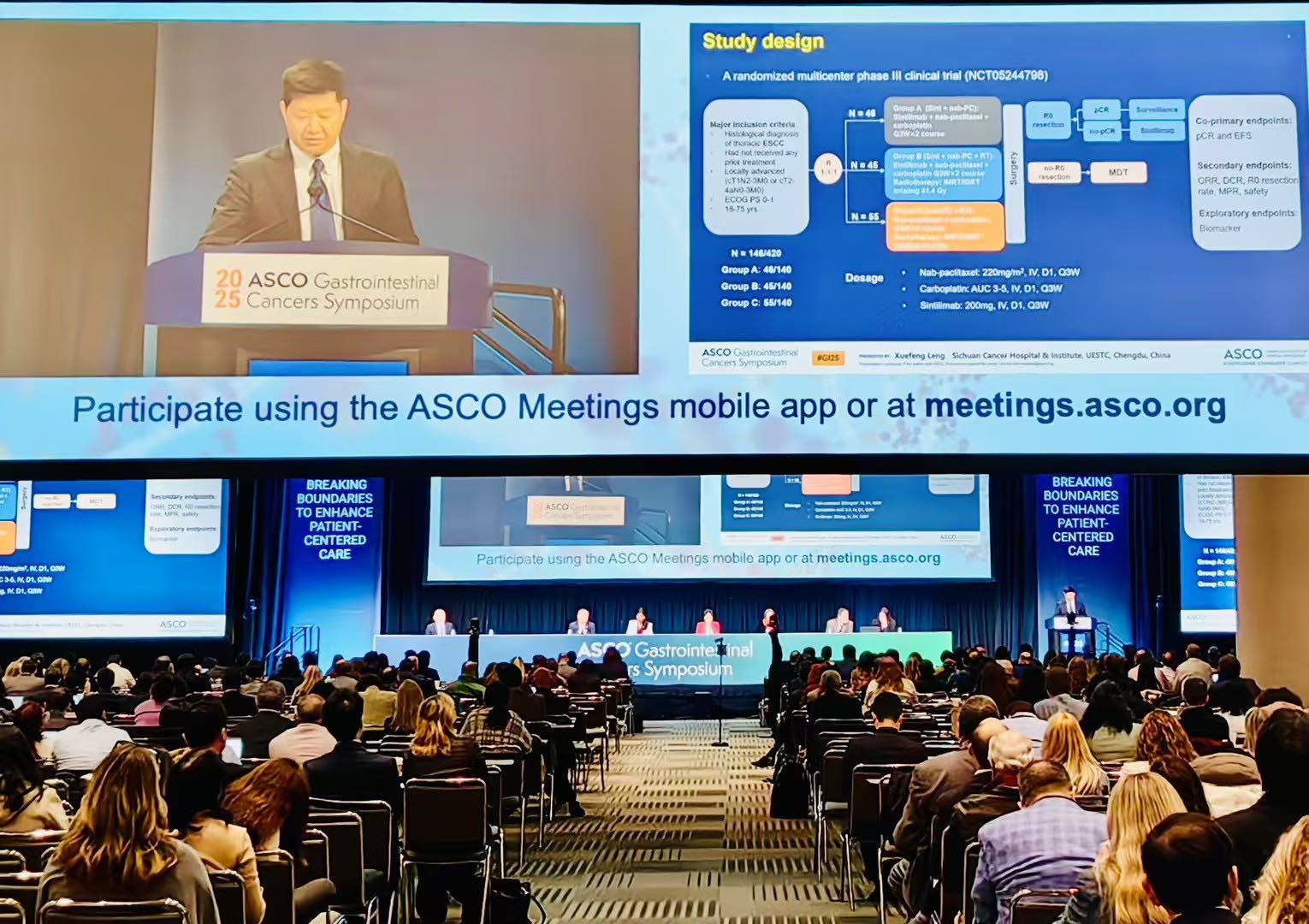

SCIENCE研究:前瞻性三臂设计直击ESCC新辅助治疗领域的关键挑战
冷雪峰教授:非常荣幸我们团队主导的SCIENCE临床研究能够入选2025 ASCO GI的LBA进行口头汇报,SCIENCE研究采用三臂设计,这是基于当前新辅助治疗领域内尚未明确的关键问题设计的。目前,化疗和放化疗是食管癌新辅助治疗的主要模式,也是临床指南所推荐的治疗模式。但在疗效、毒性以及适用人群方面,这两种模式仍存在一定差异。免疫治疗的加入,为食管癌新辅助治疗带来了更多新的可能性。然而,如何对现有的治疗模式进行最佳结合仍亟待验证。通过这种三臂临床研究设计,我们能够直接比较化疗联合免疫治疗、放化疗联合免疫治疗以及单纯放化疗的疗效和安全性(图1),从而为临床实践提供更全面的循证医学证据。
食管鳞癌(ESCC)新辅助治疗领域中,目前亟待解答的一些关键临床问题主要包括以下方面:第一,最佳治疗模式的选择,化疗与放化疗在不同患者中的适用性存在一定差异,免疫治疗与这两种模式相结合的最佳时机和最佳治疗方式也尚未得到明确回答。第二,治疗的个体化和精准化,通过本研究我们可以探索一些生物标志物来预测患者对免疫治疗或放化疗的应答程度,这将有助于未来实现对患者进行更加个体化和精准化的治疗。第三,作为肿瘤外科医生,在治疗食管癌患者时,必须关注远期疗效与安全性的平衡。如何在提高患者新辅助治疗过程中的病理完全缓解(pCR)率和长期生存的同时,尽量降低治疗相关的不良反应或不良事件,是我们需要深入思考和考虑的问题。最后是联合治疗策略的优化,食管癌患者的个体化差异较大,因此对于免疫治疗的剂量、疗程以及是否需要全程新辅助治疗等问题,仍需进一步探索。
免疫联合策略:SCIENCE研究的设计考量与机制探索
冷雪峰教授:在设计SCIENCE临床研究之初,我们就综合考虑了免疫治疗与化疗、放化疗联合应用的潜在协同机制,以及其在临床应用中的可行性和安全性。本研究选用了PD-1抑制剂信迪利单抗,理论上它可以通过增强抗肿瘤免疫反应,与化疗和放化疗实现作用机制的互补。对于联合治疗时机的选择,新辅助治疗阶段联合免疫治疗更多地考虑了局部晚期患者的肿瘤负荷相对较大这一特点。在这种情况下,联合治疗时的抗原释放相对充分,免疫治疗能够更好地在敏感患者中激活抗肿瘤免疫作用。此外,新辅助治疗的目的是控制病灶、缩小肿瘤、达到降期以及控制微转移灶,与免疫治疗也高度契合。
对于化疗联合免疫治疗,理论基础以及既往研究表明,化疗不仅可以直接杀伤肿瘤细胞,还可以通过调节免疫微环境来提升肿瘤细胞的免疫原性,比如通过促进肿瘤抗原的释放、减少免疫抑制细胞的数量等方面从而与免疫治疗产生协同效应。对于放化疗联合免疫治疗,放射治疗可以通过诱导肿瘤细胞死亡来释放肿瘤抗原,同时增强肿瘤微环境中免疫细胞的活性。因此,在该临床研究中将信迪利单抗与放化疗相结合,理论上可以实现双重增效的作用。
当然,联合放化疗仍然需要关注其可能会增加的一些不良反应和不良事件。在免疫治疗的疗程设计方面,主要考虑了患者的耐受性和新辅助治疗的时间窗口等,我们选择了与化疗或放化疗相匹配的给药频率,以确保治疗的连续性和有效性。此外,这项研究还涵盖了一些基础研究,例如循环肿瘤DNA(ctDNA)检测和生物标志物的探索性研究,也期待后续的研究结果能够进一步揭示其疗效相关机制。
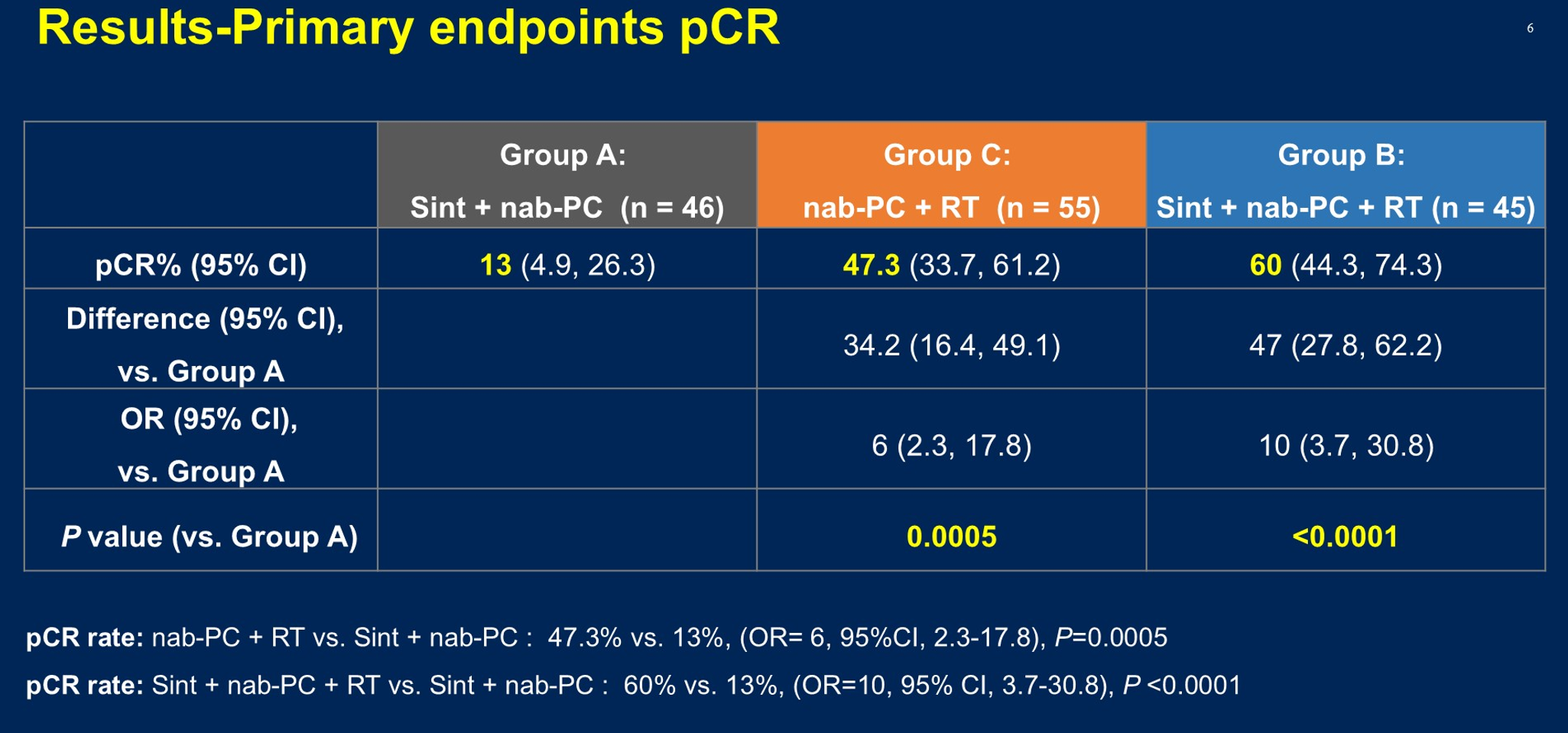
R0切除率100%,放化疗±免疫治疗组的pCR率(60%、47.3%)显著优于化疗联合免疫治疗组(13%)
冷雪峰教授:新辅助放化疗作为标准治疗模式,从CROSS研究、NEOCRTEC5010研究及临床实践数据显示,其pCR率普遍维持在40%水平。SCIENCE研究的初步结果进一步验证,新辅助放化疗可达47.3%的pCR率(图2)。从机制上看,放化疗组较高的pCR率或可归因于放射治疗的局部控制效应及其对免疫原性细胞的激活作用,这种效应在联合免疫治疗后得到进一步增强。化疗联合免疫治疗组相对较低的pCR率与真实世界研究及II期、III期临床研究数据相符,可能与化疗对局部控制能力的不足有关,同时化疗的免疫调节效应可能不足以像放疗那样完全激活抗肿瘤免疫反应。
从临床实践角度来看,研究结果强化了放化疗在新辅助治疗中的核心地位,免疫治疗的加入则为这种模式提供了新的优化可能性。当然,在推广应用过程中,需要关注放化疗联合免疫治疗可能带来的毒性增加,这需要依托各中心及多学科团队(MDT)的临床经验。通过个体化的治疗方案可以实现疗效和安全性的平衡。
关于无事件生存(EFS)这一研究终点,虽尚未公布结果,但基于放化疗联合免疫治疗组较高的pCR率和R0切除率,预期该组将展现较长的EFS。从远期疗效评估来看,pCR率的提升可能是转化为更好局部控制和远期生存的重要指标之一,这对新辅助治疗模式的优化具有非常重要的意义。
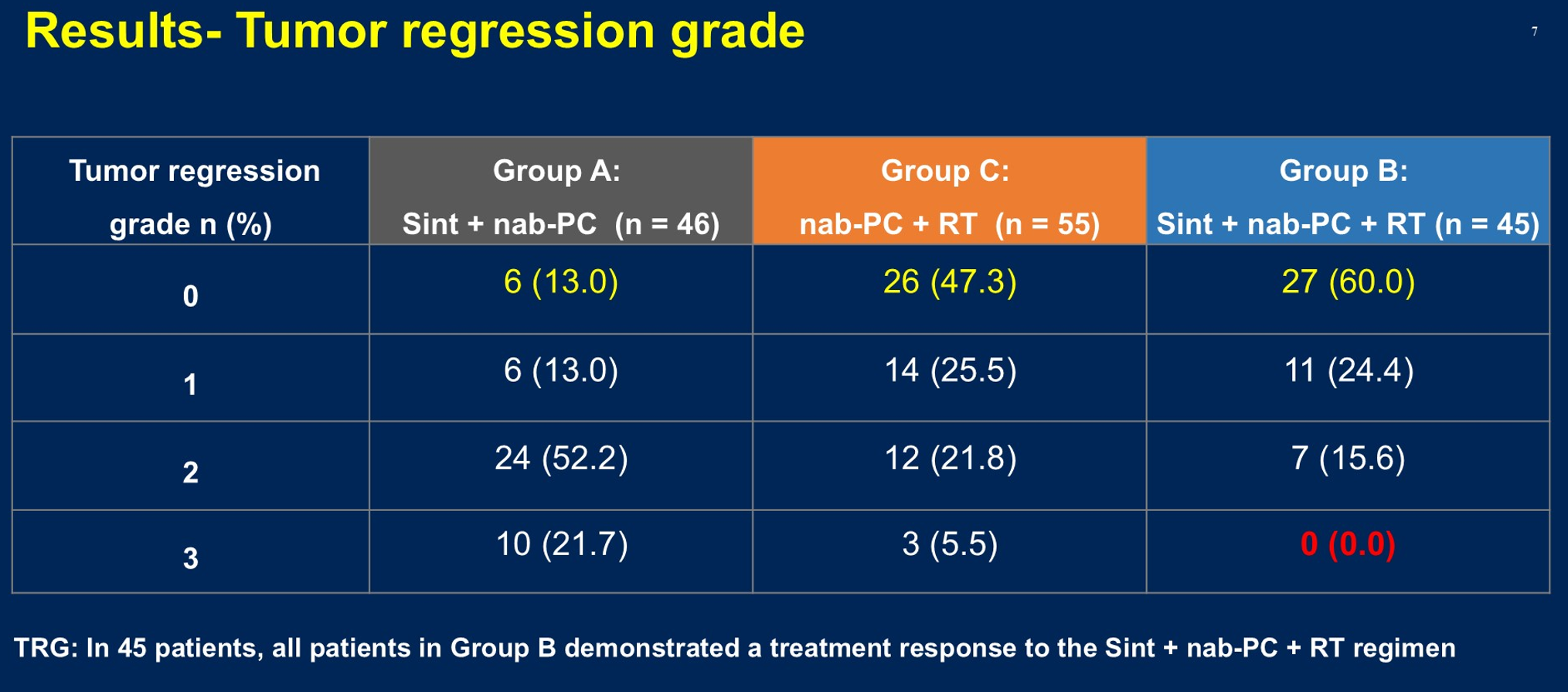
值得关注的是,在本次汇报中有一个特别有意思的发现,从肿瘤退缩分级(TRG)结果我们看到放化疗联合免疫治疗组的所有患者都显示出治疗反应(图3),这表明放化疗与免疫治疗的联合模式通过持续优化,可能成为未来非常的治疗策略。
从SCIENCE研究看ESCC新辅助治疗的未来发展方向
冷雪峰教授:本次SCIENCE研究的成果无疑为食管癌新辅助治疗领域带来了一些潜在的价值和突破。首先,其三臂设计提供了全球首个系统性评估化疗、放化疗与免疫治疗联合模式的直接对比数据,为临床治疗决策提供了更高质量的循证医学依据。其次,SCIENCE研究明确了免疫治疗的应用价值。研究结果表明,在放化疗基础上联合免疫治疗能够明显增效,这提示免疫治疗在新辅助治疗中具有成为未来标准治疗方案组成部分的潜力。第三,该研究推进了精准医学的发展。正如肺癌治疗的发展历程,食管癌治疗也将随着研究的不断推进越来越精准、个体化。通过大型临床研究、亚组分析以及生物标志物研究,可进一步优化患者的分层,为未来的个体化治疗奠定基础。还有一点至关重要,基于SCIENCE研究,我们中心以及参与此研究的其他中心,在患者个体化治疗和多学科协作方面都有了显著提升,在新辅助治疗策略中,这种模式能够推动多学科团队的紧密合作,根据患者的具体情况制定个体化的综合治疗方案。
展望未来,食管癌新辅助治疗的发展方向和突破点可能会集中在以下几个方面:一是治疗模式的进一步优化,探索放化疗联合免疫治疗的最佳剂量、疗程,以及未来序贯治疗可能性等;二是生物标志物的发现与应用,借助基因组学、免疫组学等研究手段,筛选出能够预测免疫治疗疗效和毒性的标志物,包括ctDNA等,未来让这些转化研究能够应用于临床,为患者提供更精准的诊疗决策;三是新型治疗手段的结合,例如其他的免疫检查点抑制剂(ICI)以及未来可能出现的抗体药物偶联物(ADC),不同的抗体联合与放化疗的配伍,或许会成为更具潜力的治疗模式;四是远期随访和真实世界研究,随着这些治疗模式的广泛应用,积累长期随访数据和真实世界的疗效证据,将为临床实践提供重要指导。
附III期SCIENCE研究摘要
摘要号:LBA329(2025 ASCO GI)
英文标题:Preliminary results from the multicenter, randomized phase III trial (SCIENCE): Comparing chemotherapy plus sintilimab and chemoradiotherapy plus sintilimab versus chemoradiotherapy for neoadjuvant treatment in resectable locally advanced esophageal squamous cell carcinoma
中文标题:多中心随机III期临床试验(SCIENCE)的初步结果:比较化疗联合信迪利单抗、放化疗联合信迪利单抗、单纯放化疗用于可切除局部晚期食管鳞癌新辅助治疗的疗效
研究背景
新辅助化疗(nCT)或放化疗(nCRT)联合手术是可切除局部晚期食管鳞癌(LA-ESCC)的标准治疗方法。尽管该治疗策略取得了重大进展,但复发率仍然很高。因此,这项多中心、随机、III期临床试验(SCIENCE)旨在评估和比较nCT和nCRT联合信迪利单抗以及单独nCRT在可切除LA-ESCC患者中的疗效。
研究方法
研究纳入了既往未接受过任何治疗的符合条件的胸段ESCC患者。患者的临床分期为局部晚期(cT1N2-3M0或cT2-4aN0-3M0)。患者按1:1:1的比例随机分配到三个新辅助治疗组之一:A组:信迪利单抗联合nCT(白蛋白结合型紫杉醇联合卡铂),共2个周期。B组:信迪利单抗联合同步nCRT(白蛋白结合型紫杉醇联合卡铂化疗和使用IMRT/IGRT放疗,总剂量为41.4Gy)。C组:单独同步nCRT。计划在新辅助治疗完成后6~8周进行手术切除。共同主要终点为病理完全缓解(pCR)率和无事件生存(EFS),由研究者根据RECIST 1.1标准进行评估。
研究结果
2022年11月至2024年6月期间,共纳入146例患者并随机分配到三组:A组(N=46)、B组(N=45)和C组(N=55)。大多数患者为男性(89.7%;131/146)和临床III期(72.6%;106/146),肿瘤位于胸段食管中段(51.4%;75/146)。所有患者均完成了新辅助治疗并接受了手术切除,R0切除率达100%。各组之间的pCR率存在显著差异,A组的pCR率为13%,B组为60%,C组为47.3%。与A组相比,B组和C组的pCR率均显著更高,B组 vs A组的差异为47%(95%CI 27.8%~62.2%;OR=10;95%CI 3.7%~30.8%;P<0.0001),C组 vs A组的差异为34.2%(95%CI 16.4%~49.1%;OR=6;95%CI 2.3%~17.8%;P=0.0005)。研究未报告围手术期死亡事件。A组、B组和C组分别有50%、86.7%和85.5%的患者观察到任意级别治疗期间出现的不良事件(TEAE)。此外,新辅助治疗期间≥3级TEAE的发生率在A组、B组和C组中分别为8.7%、31.1%和36.4%。
结论
这项III期临床研究表明,与信迪利单抗联合nCT相比,nCRT联合或不联合信迪利单抗可显著提高LA-ESCC患者的pCR率,且不会增加手术风险。需要持续监测EFS以验证这些结果。
Leng XF, He WW, Lyu JH, et al. Preliminary results from the multicenter, randomized phase III trial (SCIENCE): Comparing chemotherapy plus sintilimab and chemoradiotherapy plus sintilimab versus chemoradiotherapy for neoadjuvant treatment in resectable locally advanced esophageal squamous cell carcinoma. 2025 ASCO GI, LBA329.
排版编辑:肿瘤资讯-Skye












 苏公网安备32059002004080号
苏公网安备32059002004080号


