三阴性乳腺癌(TNBC)作为乳腺癌中侵袭性最强的亚型,约占美国乳腺癌新发病例的12%-15%1。相较于激素受体阳性乳腺癌,TNBC具有显著的免疫炎症表型,表现为更高的程序性死亡配体1(PD-L1)表达水平(中位CPS=7.5,50%患者CPS≥102),以及更丰富的肿瘤浸润淋巴细胞(TILs)和更高的肿瘤突变负荷(TMB)。这些特征共同构成了TNBC对免疫检查点抑制剂(ICIs)敏感性的分子基础。
近十年临床研究的重要突破在于,通过联合ICIs与传统化疗显著改善了TNBC患者的治疗结局。值得注意的是,ICIs的疗效模式在疾病不同阶段呈现异质性:在转移性TNBC中,PD-L1表达水平是ICI应答的关键预测标志;而在新辅助/辅助治疗阶段,ICIs的临床获益则突破PD-L1表达限制,呈现出“全人群获益”趋势。这一现象或与疾病进展过程中免疫微环境动态演变相关——随着肿瘤负荷增加,PD-L1表达及TILs水平逐渐耗竭,凸显早期免疫干预的重要性。
本文(上篇)基于领域综述3梳理晚期和转移性(a/m)TNBC的免疫治疗相关研究进展,为读者呈现该领域的前沿动态与发展趋势。
a/mTNBC的免疫治疗
帕博利珠单抗单药治疗
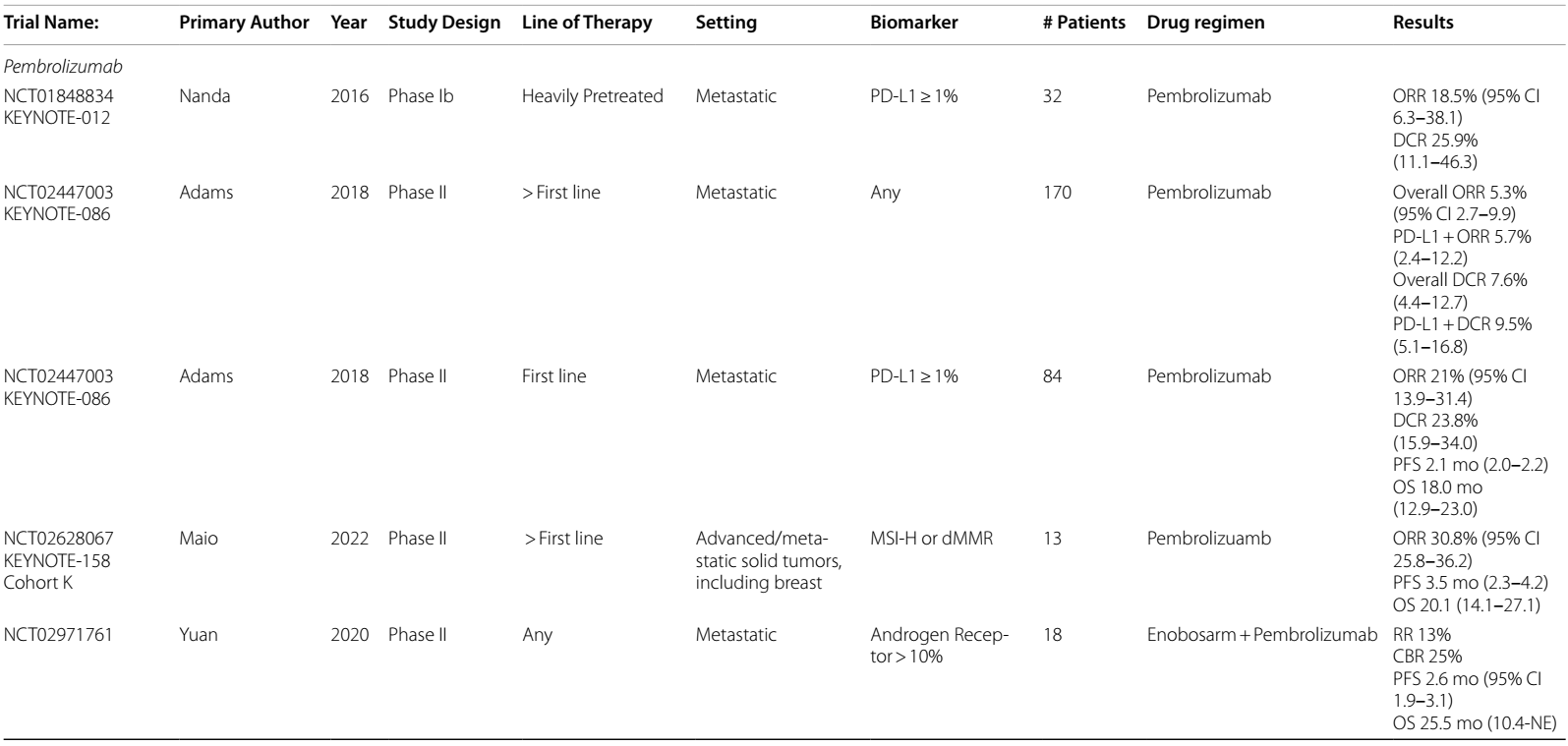
乳腺癌免疫治疗的首批研究,是以单药治疗方式用于治疗难治性、PD-L1阳性的a/mTNBC。2016年的KEYNOTE-012 1b 期试验4显示,对于PD-L1≥1% 的mTNBC患者,使用帕博利珠单抗单药治疗,客观缓解率(ORR)达到了令人鼓舞的18.5%。随后的 KEYNOTE-086 II 期5,6试验,分析了帕博利珠单抗单药治疗mTNBC的疗效,结果发现,在一线治疗 PD-L1 阳性疾病时,ORR 为 21%,而在一线治疗后,无论 PD-L1表达水平如何,ORR为5.7%。这些结果表明,在PD-L1阳性mTNBC患者中使用ICIs有益,且在治疗早期获益更为明显。
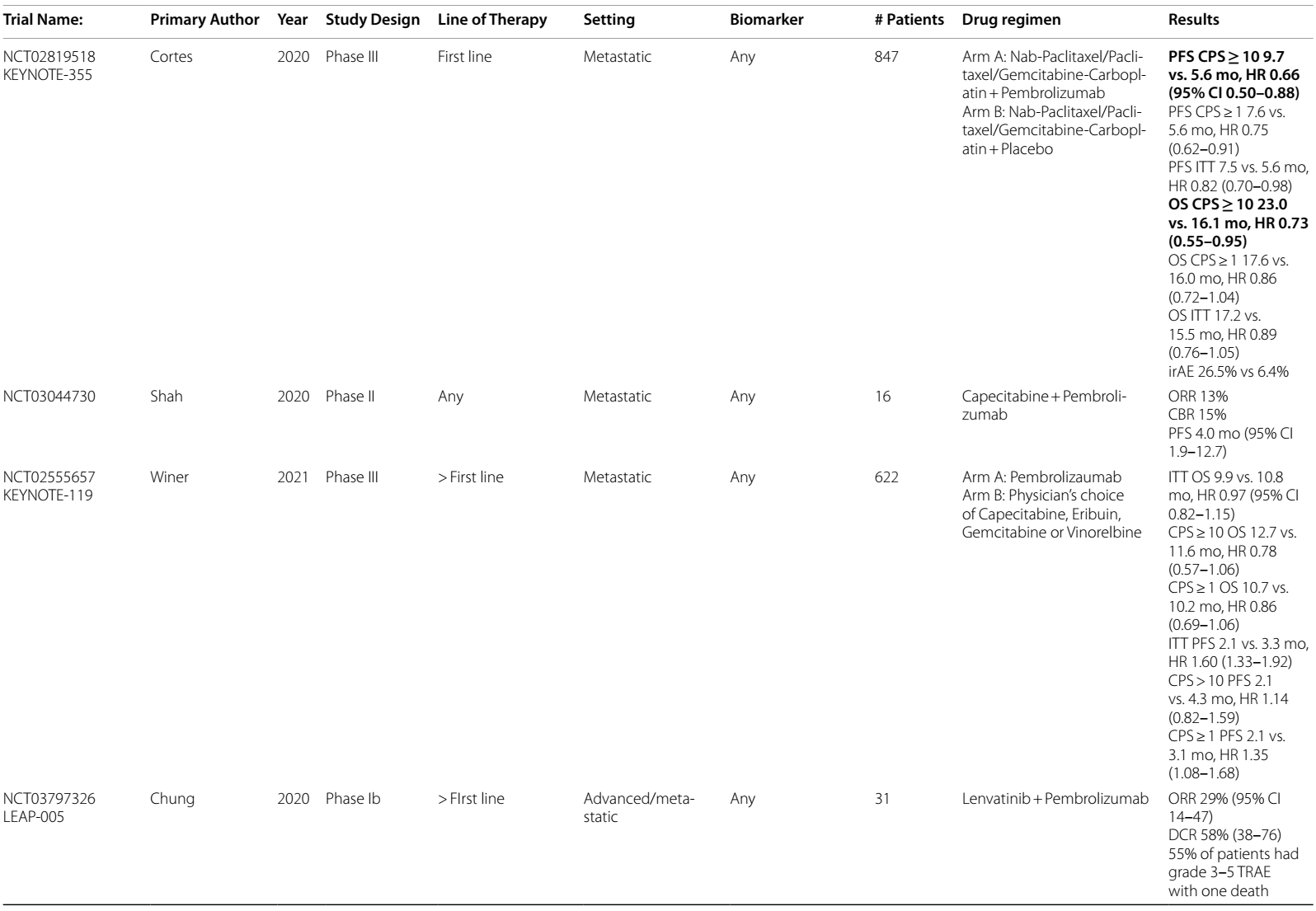
随后,III 期KEYNOTE-119 试验7,8在622例二线或三线治疗的患者中,比较了帕博利珠单抗单药与医生选择的化疗药物(卡培他滨、吉西他滨、艾立布林或长春瑞滨)的疗效。虽然在无进展生存期(PFS)或总生存期(OS)方面未观察到差异,在 PD-L1 CPS 较高的患者中观察到帕博利珠单抗的分级ORR,在CPS≥10的患者中观察到获益最大。
在一项针对所有微卫星高度不稳定(MSI-H)或错配修复缺陷(MMR)实体瘤的 II 期试验9中,包括 13 例乳腺癌患者,帕博利珠单抗单药治疗的 ORR 为 30.8%,PFS 为 3.5 个月。
帕博利珠单抗+化疗
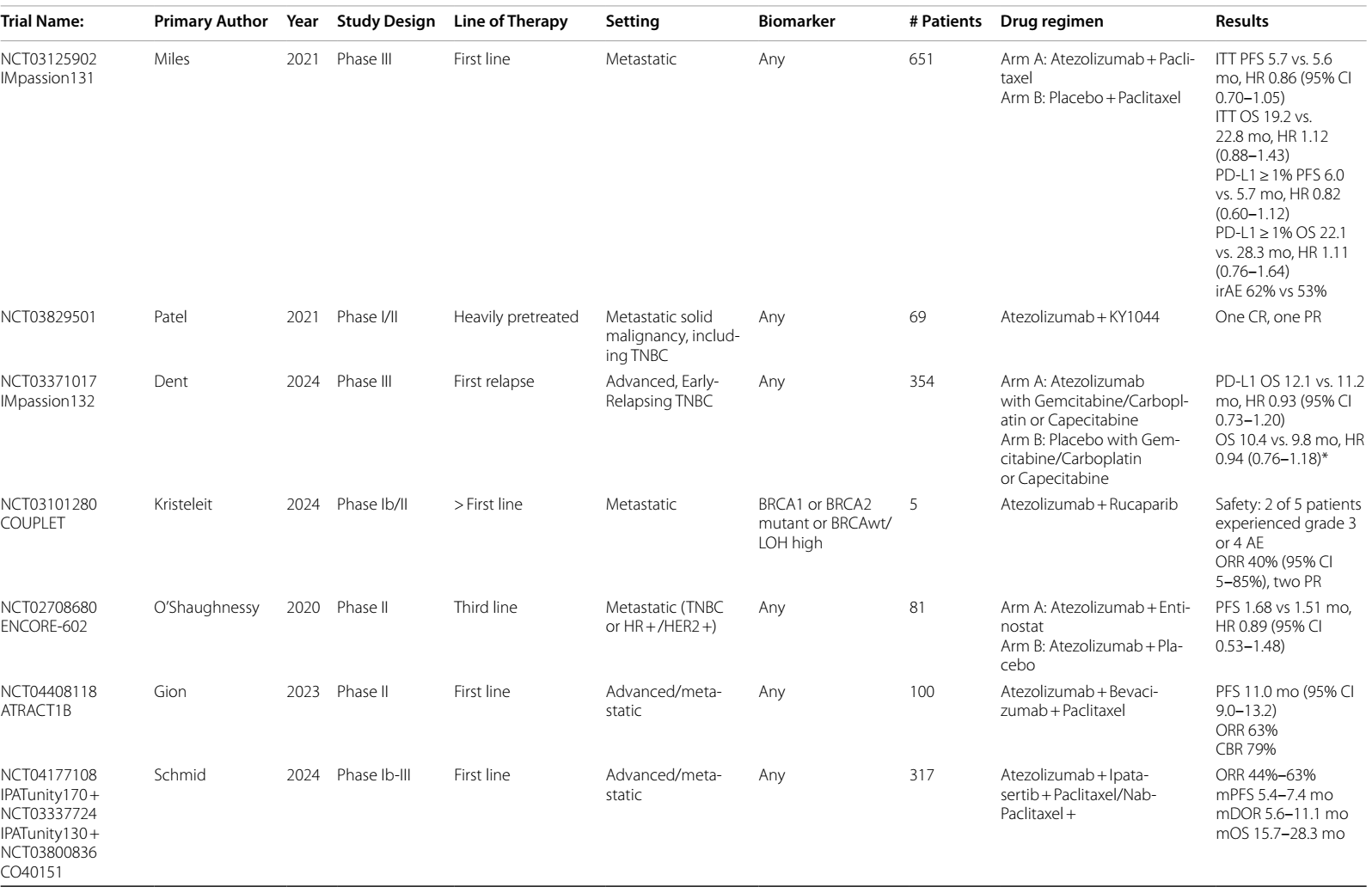
III期KEYNOTE-355试验10,11纳入了847例患者,比较了一线标准化疗联合帕博利珠单抗或安慰剂的疗效。PD-L1 CPS≥10且接受帕博利珠单抗治疗的患者,在 PFS(9.7个月 vs. 5.6个月,HR 0.65)和 OS(23.0个月 vs. 16.1个月,HR 0.73)方面有统计学意义上的显著改善,CPS≥1的患者也有改善趋势。接受紫杉醇或白蛋白结合型紫杉醇治疗的患者,相较于接受吉西他滨/卡铂治疗的患者,PFS获益更为显著。该试验纳入了早期(e)TNBC根治性治疗后无病生存期(DFI)超过6个月的患者。且探索性分析表明,早期复发(根治性治疗后6-12个月)的患者,从免疫治疗联合化疗中的获益较少(HR 1.44)11。2020 年,FDA加速批准帕博利珠单抗联合化疗用于一线治疗a/mTNBC,该方案目前已成为PD-L1阳性a/mTNBC患者的一线标准治疗方案。
阿替利珠单抗
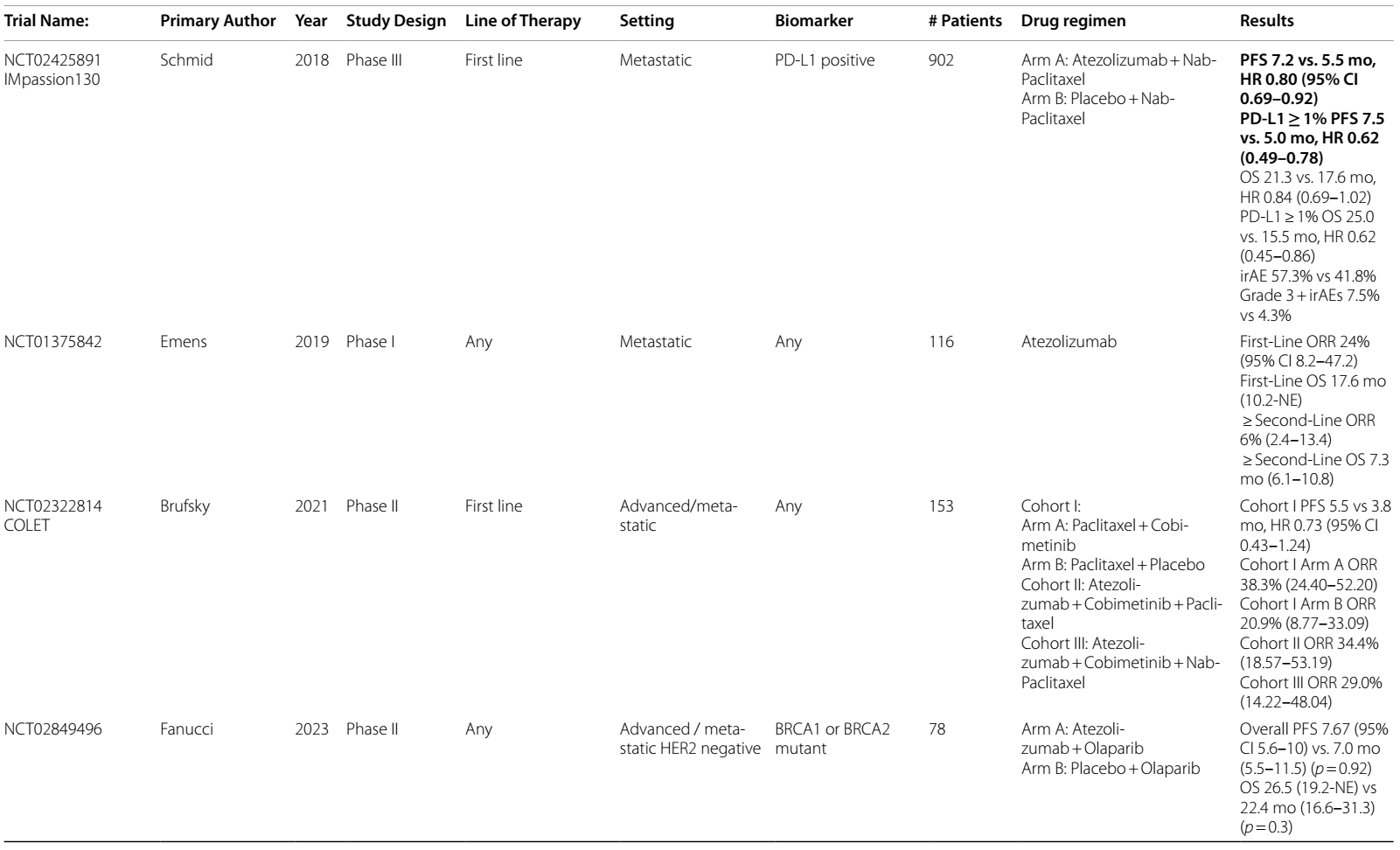
阿替利珠单抗单药用于一线治疗a/mTNBC时,ORR为24%12;在经过0-2线前期治疗后,阿替利珠单抗与白蛋白结合型紫杉醇联合使用时,ORR为39.4%13。III期IMpassion130研究14将902例PD-L1阳性aTNBC患者随机分组,这些患者自根治性治疗后至少一年,或为初发转移性疾病,分别接受白蛋白结合型紫杉醇+阿替利珠单抗/安慰剂治疗。在ITT中,阿替利珠单抗组与安慰剂组患者相比,PFS显著获益(7.2个月 vs. 5.5个月,HR 0.80);在PD-L1>1%的亚组中同样如此(7.5个月 vs. 5.0个月,HR 0.62)。尽管在ITT分析中,这些结果并未转化为OS的显著获益,但在PD-L1>1%的亚组中,观察到mOS获益为9.5个月(HR 0.62,因分层检验计划未评估显著性)。
阿替利珠单抗与其他化疗方案联合使用时,效果欠佳。III期IMpassion131试验15在651例患者中探索了紫杉醇+阿替利珠单抗或安慰剂的疗效,无论是在ITT分析还是PD-L1亚组分析中,PFS或OS均无差异,但发现对照组的 OS 达到了前所未有的22.8个月,这可能会影响结果。总体而言,IMpassion130和IMpassion131试验15结果存在差异的原因尚不清楚。可能的解释包括紫杉醇和白蛋白结合型紫杉醇的配方不同、IMpassion131研究中使用了类固醇进行预处理,或者各研究人群的肿瘤微环境存在差异15,16。尽管FDA最初基于IMpassion130的结果批准了阿替利珠单抗,但在IMpassion131结果公布后,该批准被撤销。
III期IMpassion132研究评估了阿替利珠单抗在早期复发 TNBC 患者中的可能获益,该患者是一种高危人群,定义为早期疾病末次化疗或手术后不到12个月复发。在本研究中,354例既往未接受过免疫治疗的患者被随机分配接受医生选择的化疗联合阿替利珠单抗或安慰剂治疗。最初,纳入任何 PD-L1 状态的患者,随后仅限于PD-L1 > 1%的患者。三分之二的患者DFI < 6个月。中位DFI或 OS 无差异17。这些结果,结合KEYNOTE-355中对复发<12个月患者的探索性分析,表明一些快速复发的 TNBC 患者可能对免疫治疗有内在耐药性。然而,正如下面将深入讨论的,目前eTNBC一线治疗的标准方案已包含免疫治疗,因此很少有患者在未接受过免疫治疗的情况下就发展到早期复发阶段。
化疗+ICI+抗血管生成药物
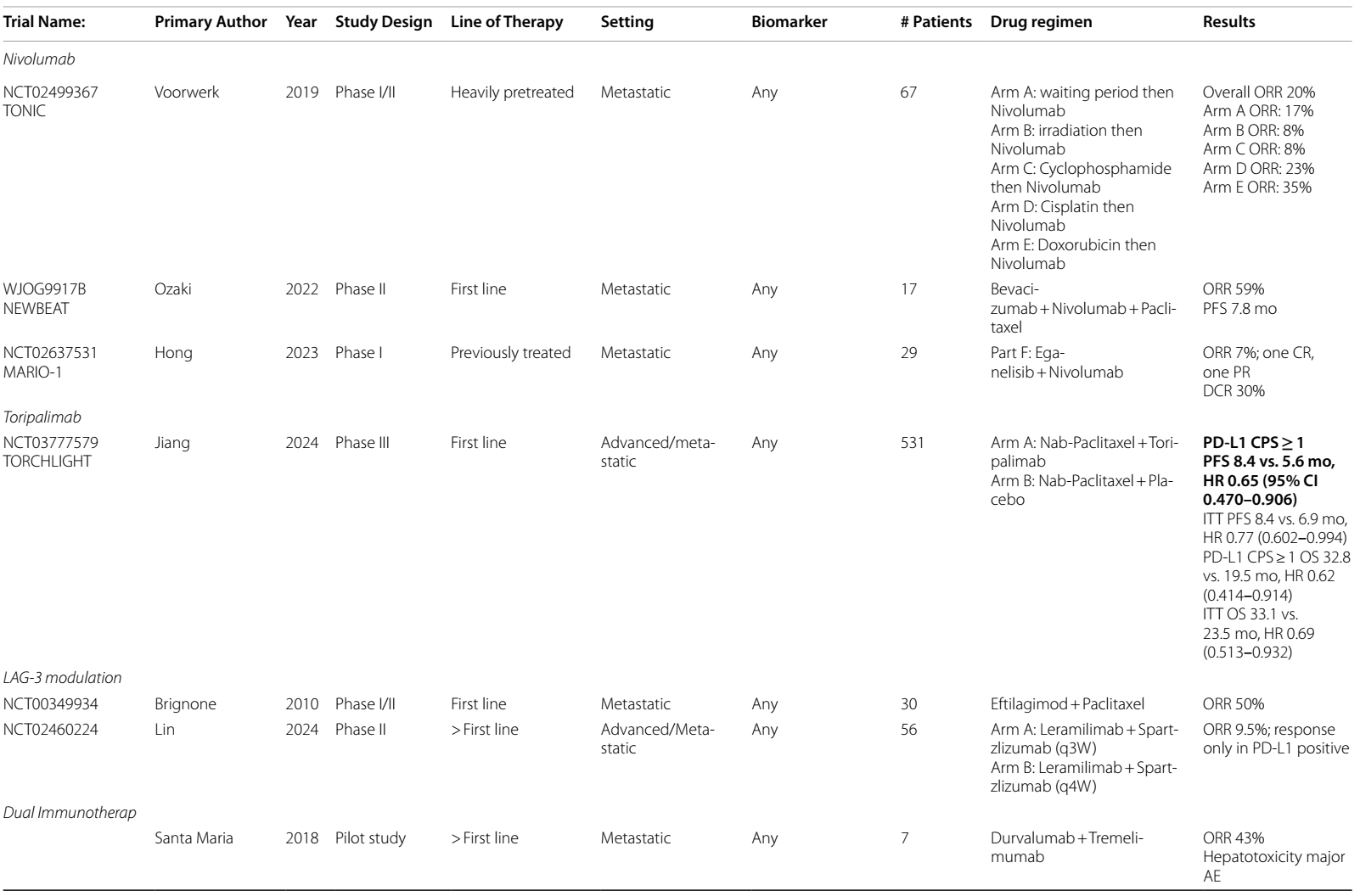
ATRACTIB Ⅱ期试验18挑战了ICIs仅在PD-L1阳性mTNBC患者中获益的观点。该研究在一线治疗aTNBC时评估了紫杉醇、阿替利珠单抗和贝伐珠单抗的联合方案,入组患者中97%为PD-L1阴性。结果显示mPFS为11.0个月,ORR为63%,包括13例CR和50例PR。NEWBEAT Ⅱ期试验19在转移性HR+/HER2-或TNBC患者一线治疗中评估了贝伐珠单抗联合纳武利尤单抗和紫杉醇方案,总体ORR达70%(TNBC亚组59%,HR+/HER2-亚组74%)。
双重ICIs联合治疗
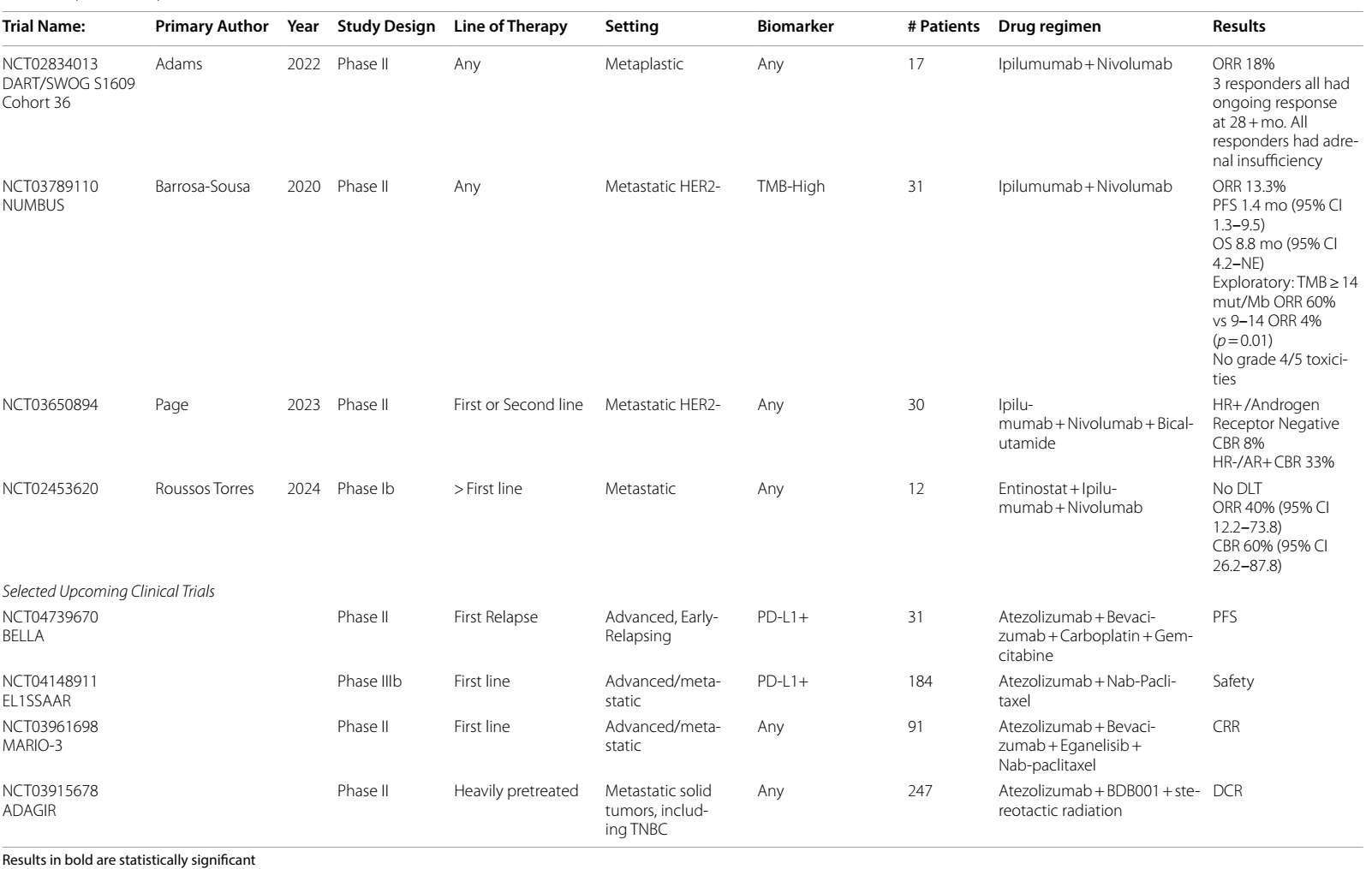
两种ICIs联合治疗在mTNBC中的临床试验显示一定临床获益,但也引发对更高毒性的担忧。一项7例患者的探索性研究20发现,度伐利尤单抗联合抗CTLA-4抗体tremelimumab在TNBC中ORR达43%。DART/SWOG S1609Ⅱ期试验21评估伊匹木单抗联合纳武利尤单抗方案,ORR为18%,但所有初始缓解患者在近3年后仍持续应答,不过所有缓解者均出现肾上腺功能不全。
PARPi联合ICIs
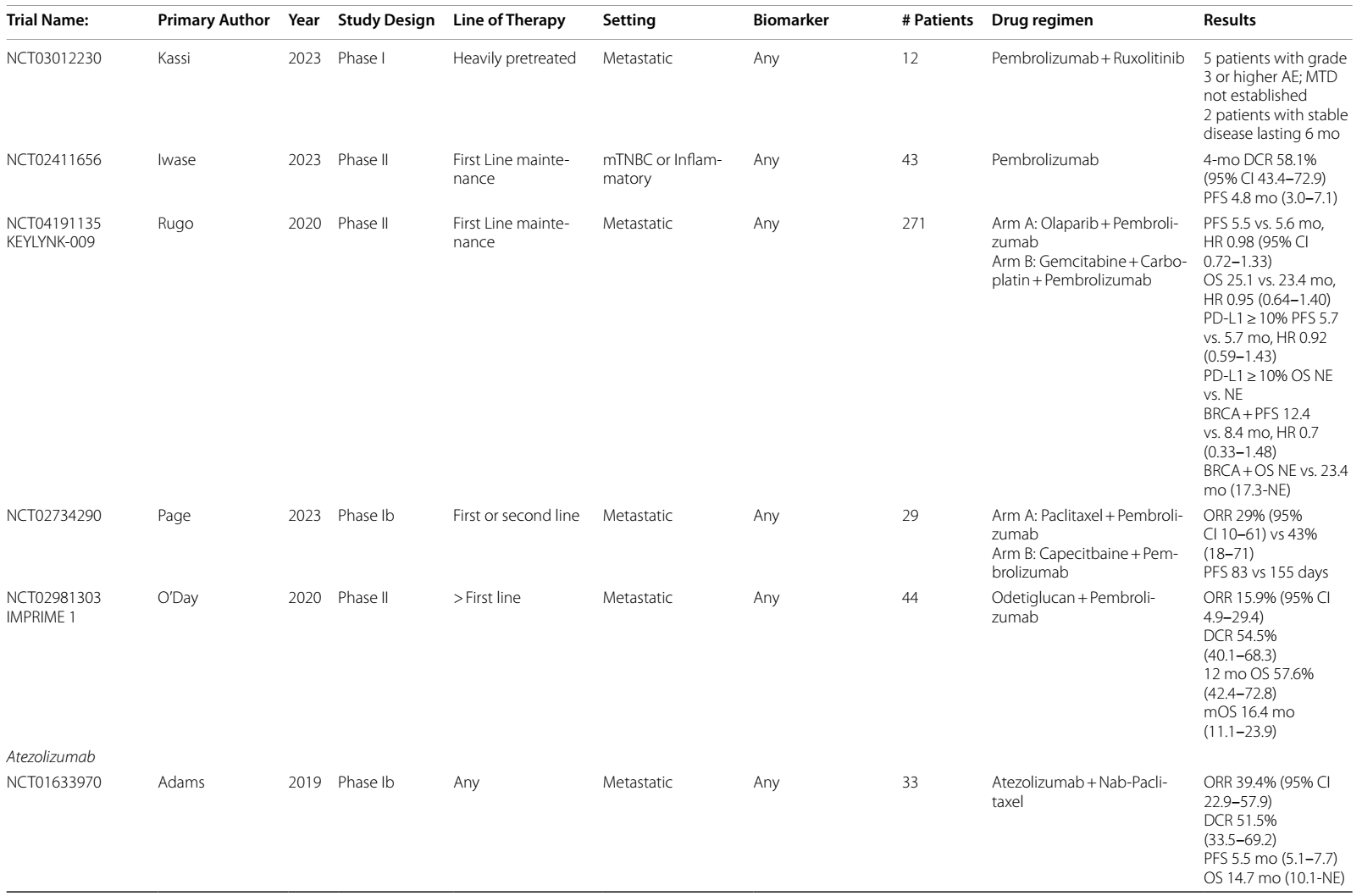
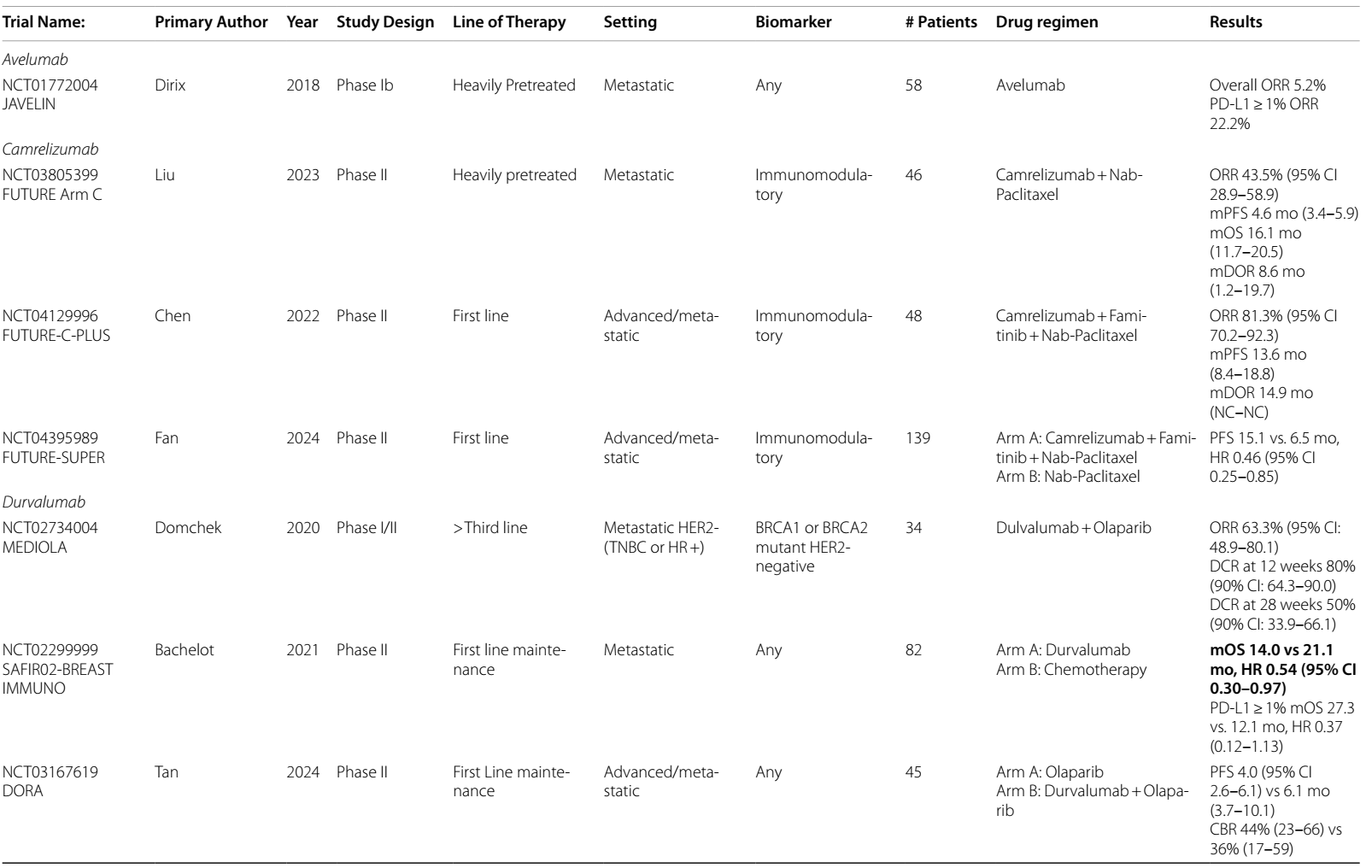
针对BRCA突变患者,PARPi联合ICIs的方案在Ⅱ期试验中显示出潜力。奥拉帕利联合度伐利尤单抗在经多线治疗的BRCA突变HER2阴性mBC患者中ORR达63.3%,3个月疾病控制率为80%22。但另一项在BRCA突变a/mTNBC中比较奥拉帕利单药与联合阿替利珠单抗的研究23显示,联合方案未改善PFS或OS,且不良事件更多。TOPACIO/KEYNOTE-162试验24纳入不同PD-L1状态的a/mTNBC患者,尼拉帕利联合帕博利珠单抗治疗显示BRCA突变患者ORR(47%)显著高于野生型(11%),但更新的PFS和OS数据尚未公布。
优化化疗初始缓解患者的维持治疗方案是当前研究热点。DORA II期研究25评估奥拉帕利单药或联合度伐利尤单抗在铂类化疗敏感的aTNBC患者中的维持作用,结果显示联合组mPFS为6.1个月,单药组为4.0个月,获益与BRCA或PD-L1状态无关。KEYLYNK-009 II期26试验比较帕博利珠单抗联合奥拉帕利与帕博利珠单抗联合化疗在诱导治疗后缓解的不可手术复发或mTNBC中的维持疗效,两组诱导后PFS(5.5 vs 5.6个月)和OS(25.1 vs 23.4个月)无差异,但BRCA突变亚组有PFS改善趋势。值得注意的是,与标准化疗方案相比,无化疗维持方案未改善患者报告结局27。另一项度伐利尤单抗维持免疫治疗对比化疗的探索性分析28显示,TNBC亚组OS延长7.1个月。总体提示化疗后缓解患者采用无化疗维持方案可能具有潜在价值。
TROP2 ADC
III期ASCENT试验29,30比较抗TROP2 ADC戈沙妥珠单抗(SG)与医生选择方案(TPC)在二线及以上a/mTNBC中的疗效,SG组PFS显著改善(4.8 vs 1.7个月,HR 0.41),OS绝对获益4.9个月(11.8 vs 6.9个月,HR 0.51),因疗效显著提前终止试验。基于此,SG于2020年4月获FDA批准用于经两线治疗的mTNBC。MORPHEUS-pan BC试验31中,SG联合阿替利珠单抗对比白蛋白紫杉醇+阿替利珠单抗(IMPassion030方案)一线治疗PD-L1阳性a/mTNBC,初步数据显示ORR 76.7% vs 66.7%,PFS 12.2 vs 5.9个月(HR 0.27)。
Dato-DXd是另一款抗TROP2 ADC,在TNBC中显示活性。I期TROPION-Pan Tumour 01研究32中,经多线治疗的a/mTNBC患者ORR达31.8%。Ib/II期BEGONIA试验33评估Dato-DXd联合ICI方案,其中队列7探索Dato-DXd联合度伐利尤单抗一线治疗a/mTNBC,早期结果显示ORR达79%,47%患者在11.7个月时仍持续缓解,且缓解与PD-L1表达水平无关。
其他在研ADC包括enfortumab vedotin,II期EV-202试验34中经多线治疗的mTNBC患者ORR达19%,mPFS 3.5个月。另一值得关注的抗TROP2 ADC——Sacituzumab tirumotecan(SKB264)在二线治疗a/mTNBC中较医生选择化疗显著改善OS35。
正在进行中的a/mTNBC临床试验
在 a/mTNBC领域,目前多项 III 期研究正致力于评估一线使用ADC联合ICI的治疗效果。
对于PD-L1阳性患者,ASCENT-04(NCT05382286)试验对一线使用 SG联合帕博利珠单抗,与医生选择的治疗方案联合帕博利珠单抗这两种治疗方式的疗效进行对比分析。TROPION-Breast-05(NCT06103864)试验则评估Dato-DXd 联合度伐利尤单抗,与 KEYNOTE-355 方案(化疗+帕博利珠单抗)的疗效差异。这些研究的结果,将有助于为PD-L1阳性的 a/mTNBC 患者确定最优的一线治疗方案。另外,在I/II期的MORPHEUS试验(NCT03424005)的另一分组中,正在开展阿替利珠单抗联合 ladoratizimab vedotin(LV),用于治疗既往未接受过 ICI 治疗的 a/mTNBC 患者的一线治疗研究。
而对于 PD-L1 阴性的 a/mTNBC 患者,为了确定最佳的一线治疗方案,III期ASCENT-03(NCT05382299)研究将 SG 与医生选择的治疗方案进行疗效比较;TROPION-Breast02(NCT05374512)试验则对 Dato-DXd 与医生选择的治疗方案进行对比。除此之外,II 期SACI-IO TNBC(NCT04468061)研究,评估了一线使用 SG 联合或不联合帕博利珠单抗的治疗效果;SNGLVA-002(NCT03310957)试验则探索了一线使用 LV 联合帕博利珠单抗的疗效。
表1 ICIs在a/mTNBC中当前和即将进行的临床试验

1. Howlader N, Altekruse SF, Li CI, et al. US Incidence of breast cancer subtypes defined by joint hormone receptor and HER2 status. J Natl Cancer Inst. 2014;106(5):dju055.
2. Danziger N, Sokol ES, Graf RP, et al. Variable landscape of PD-L1 expression in breast carcinoma as detected by the DAKO 22C3 immunohistochemistry assay. Oncologist. 2023;28(4):319–26.
3. Heater NK, Warrior S, Lu J. Current and future immunotherapy for breast cancer. J Hematol Oncol. 2024 Dec 25;17(1):131. doi: 10.1186/s13045-024-01649-z.
4. Nanda R, Chow LQM, Dees EC, et al. Pembrolizumab in patients with advanced triple-negative breast cancer: phase Ib KEYNOTE-012 Study. J Clin Oncol. 2016;34(21):2460–7.
5. Adams S, Schmid P, Rugo HS, et al. Pembrolizumab monotherapy for previously treated metastatic triple-negative breast cancer: cohort A of the phase II KEYNOTE-086 study. Ann Oncol. 2019;30(3):397–404.
6. Adams S, Loi S, Toppmeyer D, et al. Pembrolizumab monotherapy for previously untreated, PD-L1-positive, metastatic triple-negative breast cancer: cohort B of the phase II KEYNOTE-086 study. Ann Oncol. 2019;30(3):405–11.
7. Cortés J, Lipatov O, Im S-A, et al. KEYNOTE-119: Phase III study of pembrolizumab (pembro) versus single-agent chemotherapy (chemo) for metastatic triple negative breast cancer (mTNBC). Ann Oncol. 2019;30:v859–60. 10.1093/annonc/mdz394.010.
8. Winer EP, Lipatov O, Im S-A, et al. Pembrolizumab versus investigator-choice chemotherapy for metastatic triple-negative breast cancer (KEYNOTE-119): a randomised, open-label, phase 3 trial. Lancet Oncol. 2021;22(4):499–511.
9. Maio M, Ascierto PA, Manzyuk L, et al. Pembrolizumab in microsatellite instability high or mismatch repair deficient cancers: updated analysis from the phase II KEYNOTE-158 study. Ann Oncol. 2022;33(9):929–38.
10. Cortes J, Cescon DW, Rugo HS, et al. Pembrolizumab plus chemotherapy versus placebo plus chemotherapy for previously untreated locally recurrent inoperable or metastatic triple-negative breast cancer (KEYNOTE-355): a randomised, placebo-controlled, double-blind, phase 3 clinical trial. The Lancet. 2020;396(10265):1817–28.
11. Cortes J, Rugo HS, Cescon DW, et al. Pembrolizumab plus chemotherapy in advanced triple-negative breast cancer. N Engl J Med. 2022;387(3):217–26.
12. Emens LA, Cruz C, Eder JP, et al. Long-term clinical outcomes and biomarker analyses of atezolizumab therapy for patients with metastatic triple-negative breast cancer. JAMA Oncol. 2019;5(1):74.
13. Adams S, Diamond JR, Hamilton E, et al. Atezolizumab plus nab-paclitaxel in the treatment of metastatic triple-negative breast cancer with 2-year survival follow-up. JAMA Oncol. 2019;5(3):334.
14. Schmid P, Adams S, Rugo HS, et al. Atezolizumab and nab-paclitaxel in advanced triple-negative breast cancer. N Engl J Med. 2018;379(22):2108–21.
15. Miles D, Gligorov J, André F, et al. Primary results from IMpassion131, a double-blind, placebo-controlled, randomised phase III trial of first-line paclitaxel with or without atezolizumab for unresectable locally advanced/metastatic triple-negative breast cancer. Ann Oncol. 2021;32(8):994–1004.
16. Franzoi MA, De Azambuja E. Atezolizumab in metastatic triple-negative breast cancer: IMpassion130 and 131 trials—How to explain different results? ESMO Open. 2020;5(6):e001112.
17. Dent R, André F, Gonçalves A, et al. IMpassion132 double-blind randomised phase III trial of chemotherapy with or without atezolizumab for early relapsing unresectable locally advanced or metastatic triple-negative breast cancer. Ann Oncol. 2024;35(7):630–42.
18. Gion M, Cortez-Castedo P, et al. Abstract PS16-02: Efficacy and safety of first-line atezolizumab + bevacizumab + paclitaxel in patients with advanced triple-negative breast cancer: the ATRACTIB phase 2 trial. Cancer Res. 2024;84(9_Supplement):PS16-02-PS16-02. 10.1158/1538-7445.SABCS23-PS16-02.
19. Ozaki Y, Tsurutani J, Mukohara T, et al. Safety and efficacy of nivolumab plus bevacizumab, paclitaxel for HER2-negative metastatic breast cancer: Primary results and biomarker data from a phase 2 trial (WJOG9917B). Eur J Cancer. 2022;171:193–202.
20. Santa-Maria CA, Kato T, Park J-H, et al. A pilot study of durvalumab and tremelimumab and immunogenomic dynamics in metastatic breast cancer. Oncotarget. 2018;9(27):18985–96.
21. Adams S, Othus M, Patel SP, et al. A multicenter phase II trial of ipilimumab and nivolumab in unresectable or metastatic metaplastic breast cancer: cohort 36 of dual Anti–CTLA-4 and Anti–PD-1 blockade in rare tumors (DART, SWOG S1609). Clin Cancer Res. 2022;28(2):271–8.
22. Domchek SM, Postel-Vinay S, Im S-A, et al. Olaparib and durvalumab in patients with germline BRCA-mutated metastatic breast cancer (MEDIOLA): an open-label, multicentre, phase 1/2, basket study. Lancet Oncol. 2020;21(9):1155–64.
23. Fanucci KA, Pilat MJ, Derek Shyr Y, et al. Abstract CT145: Olaparib +/- atezolizumab in patients with BRCA-mutated (BRCAmt) locally advanced unresectable or metastatic (advanced) breast cancer: an open-label, multicenter, randomized phase II trial. Cancer Res. 2023;83(8_Supplement):CT145–CT145. 10.1158/1538-7445.AM2023-CT145.
24. Vinayak S, Tolaney SM, Schwartzberg L, et al. Open-label clinical trial of niraparib combined with pembrolizumab for treatment of advanced or metastatic triple-negative breast cancer. JAMA Oncol. 2019;5(8):1132.
25. Tan TJ, Sammons S, Im Y-H, et al. Phase II DORA study of olaparib with or without durvalumab as a chemotherapy-free maintenance strategy in platinum-pretreated advanced triple-negative breast cancer. Clin Cancer Res. 2024;30(7):1240–7.
26. Rugo H, Robson M, Im SA, et al. Abstract GS01-05: Pembrolizumab + olaparib vs pembrolizumab + chemotherapy after induction with pembrolizumab + chemotherapy for locally recurrent inoperable or metastatic TNBC: randomized open-label phase 2 KEYLYNK-009 study. Cancer Res. 2024;84(9_Supplement):GS01-05-GS01-05. 10.1158/1538-7445.SABCS23-GS01-05.
27. Cussac AL, Rugo HS, Robson ME, et al. 198P Pembrolizumab plus olaparib vs pembrolizumab plus chemotherapy after induction with pembrolizumab plus chemotherapy for locally recurrent inoperable or metastatic TNBC: patient-reported outcomes from KEYLYNK-009. ESMO Open. 2024;9:103220.
28. Bachelot T, Filleron T, Bieche I, et al. Durvalumab compared to maintenance chemotherapy in metastatic breast cancer: the randomized phase II SAFIR02-BREAST IMMUNO trial. Nat Med. 2021;27(2):250–5.
29. Bardia A, Hurvitz SA, Tolaney SM, et al. Sacituzumab govitecan in metastatic triple-negative breast cancer. N Engl J Med. 2021;384(16):1529–41.
30. Bardia A, Rugo HS, Tolaney SM, et al. Final results from the randomized phase III ASCENT clinical trial in metastatic triple-negative breast cancer and association of outcomes by human epidermal growth factor receptor 2 and trophoblast cell surface antigen 2 expression. J Clin Oncol. 2024;42(15):1738–44.
31. Schmid P, Loi S, De La Cruz ML, et al. 181O Interim analysis (IA) of the atezolizumab (atezo) + sacituzumab govitecan (SG) arm in patients (pts) with triple-negative breast cancer (TNBC) in MORPHEUS-pan BC: a phase Ib/II study of multiple treatment (tx) combinations in pts with locally advance. ESMO Open. 2024;9:103203.
32. Bardia A, Krop IE, Kogawa T, et al. Datopotamab deruxtecan in advanced or metastatic HR+/HER2– and triple-negative breast cancer: results from the phase I TROPION-pantumor01 study. J Clin Oncol. 2024;42(19):2281–94.
33. Schmid P, Wysocki PJ, Ma CX, et al. 379MO Datopotamab deruxtecan (Dato-DXd) + durvalumab (D) as first-line (1L) treatment for unresectable locally advanced/metastatic triple-negative breast cancer (a/mTNBC): updated results from BEGONIA, a phase Ib/II study. Ann Oncol. 2023;34:S337.
34. Giordano A, Awan AAA, Bruce JY, et al. Enfortumab vedotin (EV) in triple-negative breast cancer (TNBC) and HR+/HER2- breast cancer (BC) cohorts of EV-202. J Clin Oncol. 2024;42(16_suppl):1005–1005. 10.1200/JCO.2024.42.16_suppl.1005.
35. Binghe X, Yin Y, Fan Y, et al. Sacituzumab tirumotecan (SKB264/MK-2870) in patients (pts) with previously treated locally recurrent or metastatic triple-negative breast cancer (TNBC): results from the phase III OptiTROP-Breast01 study. J Clin Oncol. 2024;42(16_suppl):104–104.
排版编辑:肿瘤资讯-Jina











 苏公网安备32059002004080号
苏公网安备32059002004080号


