在肿瘤治疗领域,胆胰肿瘤生物学特性复杂,具有高度异质性和侵袭性,且传统治疗手段疗效有限,因此患者总体预后欠佳。在精准医学的推动下,随着医学研究不断深入,胆胰肿瘤治疗迎来曙光。2024年欧洲肿瘤内科学会(ESMO)年会公布了多项关于胆胰肿瘤研究的前沿进展,内容涵盖精准治疗靶点检测、新型治疗靶点开发、新兴治疗模式探索等诸多方面,为胆胰肿瘤的临床诊疗指明方向。基于此,深入解读胆胰肿瘤精准治疗前沿进展,对推动胆胰肿瘤发展具有重要意义。在此背景下,本期特邀华中科技大学同济医学院附属协和医院刘红利教授对ESMO大会公布的胆胰肿瘤最新进展进行深入解读,以剖析胆胰肿瘤领域的靶向诊疗前沿。
专家简介
华中科技大学同济医学院附属协和医院
主任医师、博士生导师
华中科技大学附属协和医院肿瘤中心 腹部肿瘤科主任
武汉市医学会肿瘤学分会 副主任委员
湖北省生物信息学会微生物信息学专委会 副主任委员
美国哈佛大学丹娜法伯癌症中心 博士后
中国老年医学学会肿瘤学分会 委员
中国研究型医院学会肿瘤专委会 常委
中国医药卫生文化协会肿瘤防治与科普分会 常委
中国抗癌协会CACA肿瘤运动康复专委会 常委
中国抗癌协会CACA大肠癌专委会 委员
中国抗癌协会CACA胃部肿瘤专委会 委员
中国生物医学工程学会肿瘤分子靶向治疗专业委员会 委员
中国医师学会女医师肿瘤专委会 委员
多方案齐发力
点亮胰腺癌患者生命新希望
1520P[1]:Real-World Assessment of NALIRIFOX for Advanced Pancreatic Ductal Adenocarcinoma: An Exploratory Analysis.
既往NAPOLI 3研究结果表明,与吉西他滨+白蛋白结合型紫杉醇方案相比,伊立替康脂质体、5-FU、亚叶酸钙和奥沙利铂(NALIRIFOX)方案一线治疗可为转移性胰腺导管癌患者带来生存获益。NALIRIFOX组中位生存期(mOS)为11.1个月,中位无进展生存期(mPFS)为7.4个月,客观缓解率(ORR)为42%,mDoR为7.3个月,最常见3-4级治疗不良事件为腹泻(20.3%)。
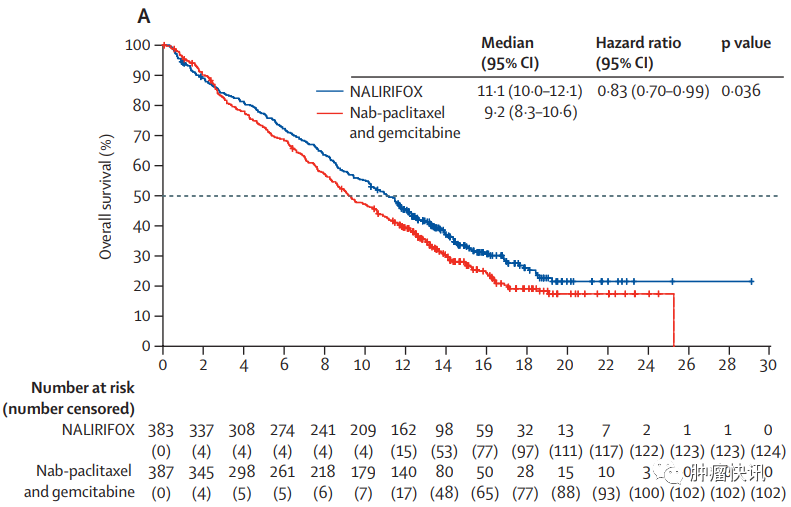
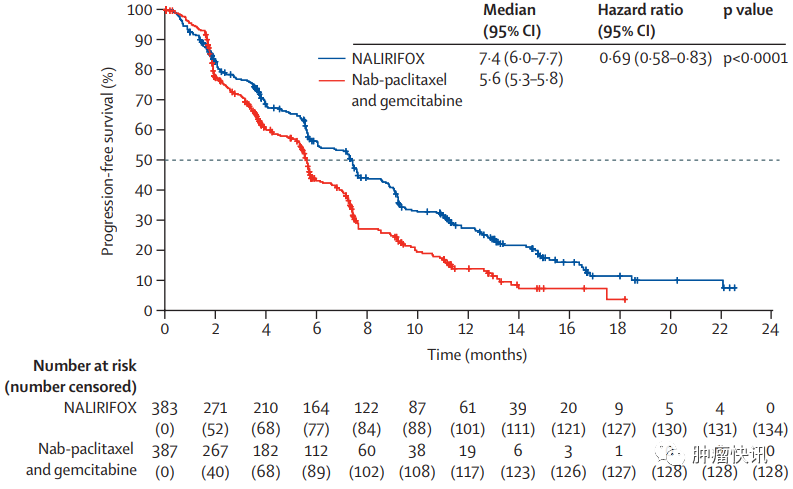
亚组分析显示,亚洲人群NALIRIFOX治疗ORR为70%,mPFS为10个月,mOS为14.5个月,与整体人群相比,亚洲人群可从NALIRIFOX治疗获益更多,且亚洲人群≥3级腹泻发生率5%,低于整体人群的20.3%,提示亚洲人群对于伊立替康脂质体耐受性可能更好。
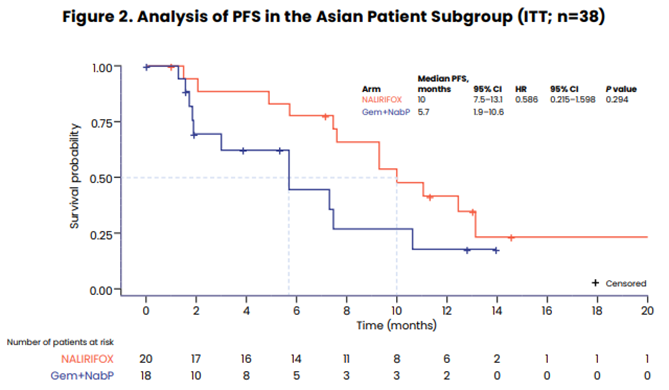
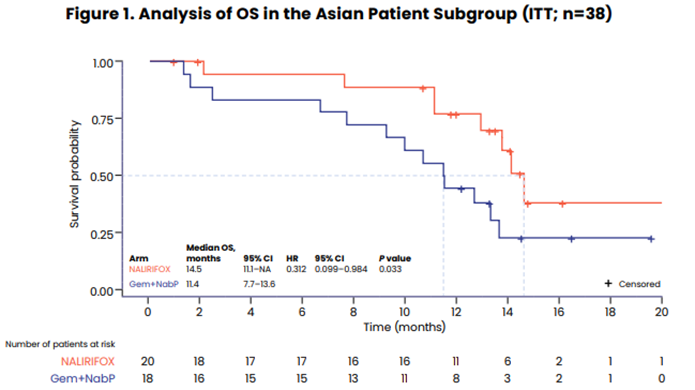
本研究旨在探索NALIRIFOX这一有前景的新一线治疗方案在早期真实世界中的有效性与可行性。分析人群为在奥地利三个癌症中心接受NALIRIFOX治疗不可切除或转移性胰腺导管腺癌患者。研究主要终点为总生存期(OS),次要终点包括无进展生存期(PFS)、ORR和安全性。2023年2月至2024年4月,共纳入40例患者。中位随访7.9个月(95% CI:6.44~10.36),中位PFS为5.3个月(95% CI:3.45~6.71),中位OS为12.7个月(95% CI:8.94~NR)。经研究者评估的确认ORR为63%,疾病控制率(DCR)为78%。17例(42.50%)患者发生3~4级不良事件,9例(22.50%)患者出现导致停药的治疗相关不良事件(TRAE),无导致死亡TRAE发生。该研究为NALIRIFOX在胰腺癌患者中的首次真实世界分析,表明NALIRIFOX还具有良好耐受性,与既往NAPOLI 3研究结果一致。
1504MO[2]:Phase II trial of Pembrolizumab and OLApaRib (POLAR) maintenance for select patients (pts) with metastatic pancreatic cancer (mPC) with (A) homologous recombination deficiency (HRD), (B) non-core HRD (ncHRD) and (C) exceptional response to platinum
奥拉帕利维持治疗可改善gBRCA1/2m (HRD) 转移性胰腺癌(mPC)患者PFS,6个月PFS率为50%,ORR为20%。假设选定的mPC具有较强免疫原性,则在奥拉帕利基础上联合PD-1抑制剂或可进一步改善患者生存获益。一项针对特定基因型和基因表型的Ⅱ期、开放标签三个队列研究(队列A,B,C)旨在探索帕博利珠单抗联合奥拉帕利作为维持治疗方案的疗效及安全性,纳入胚系/体细胞变异的BRCA1/2/PALB2突变且既往含铂治疗后PR/SD≥4个月(队列A)、无核心HRD且含铂治疗后PR/SD≥4个月(队列B)以及铂敏感但无HRD,且含铂治疗后PR/SD持续6个月以上(队列C)患者。队列A主要终点为6个月PFS率和ORR。队列B/C探索性阳性结果为可评估患者6个月PFS率≥70%(23/33个患者)或ORR >36%。
研究结果显示,队列A患者 6个月PFS率为62% (95%CI: 47~82)。队列B患者6个月PFS率为47%(95%CI: 27~80)。
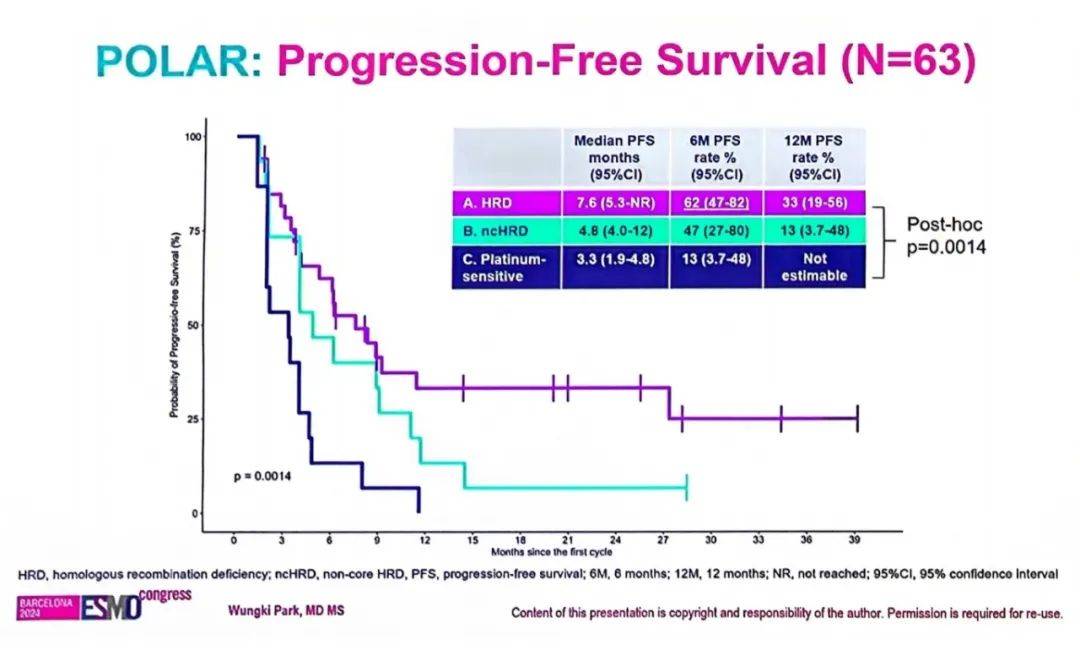
安全性方面,23例患者出现3~4级TRAE。该研究结果表明,POLAR维持治疗在选定的mPC中具有显著临床活性。
LBA63[3]A randomized phase I/II study of second line treatment with liposomal irinotecan and S-1 versus liposomal irinotecan and 5-fluorouracil in patients with metastatic pancreatic cancer following gemcitabine-based chemotherapy
mPC患者5年OS率不足5%,二线治疗选择有限,亟需新型治疗策略。一项国际多中心、开放标签、随机Ⅰ/Ⅱ期研究旨在比较伊立替康脂质体(nal-IRI)联合替吉奥(S-1)对比nal-IRI联合5-FU二线治疗吉西他滨化疗后mPC患者的疗效。
该研究在5个国际中心纳入年龄≥18岁、既往接受过以吉西他滨为基础治疗且ECOG评分为0或1分的胰腺癌患者。在I期研究(20例患者)中,确定了nal-IRI与S-1联合使用的最大耐受剂量(MTD)和剂量限制性毒性(DLT)。
在Ⅱ期研究中,患者接受25mg/m²的S-1口服,每天两次,连续14天,随后休息2周,并在第1天和第15天予70mg/m²的nal-IRI静脉注射(S-1组);对比给予70mg/m²的nal-IRI后,随后予400mg/m²的亚叶酸钙(LV)并在46小时内给予2400mg/m²的5-FU静脉注射,每2周一次(5-FU组),直至疾病进展。

根据PS对患者进行随机化分层。主要终点是PFS,次要研究终点包括OS和严重不良事件(SAE)发生率。
2021年11月至2023年5月,120例患者被随机分配至S-1组(n=61)或5-FU组(n=59)。S-1和5-FU的中位PFS分别为3.5个月和3.7个月(HR:1.265,95% CI:0.838~1.910,P=0.26)。
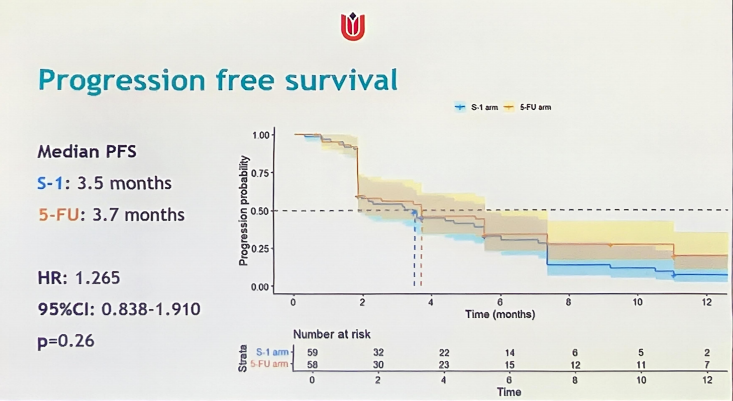
S-1和5-FU的中位OS分别为6.0个月和9.1个月(HR:1.468,95% CI:0.993~2.171, P=0.054)。S-1和5-FU的SAE发生率分别为39%和19% (P=0.029)。在接受一线吉西他滨化疗的mPC患者中,与nal-IRI联合5-FU/LV相比, nal-IRI联合S-1二线治疗方案未能改善PFS,而nal-IRI联合5-FU/LV治疗OS显示出获益趋势,不良反应显著降低。
专家点评
随着胰腺癌遗传学研究不断深入[4-6],为胰腺癌靶向治疗提供了新的治疗策略。免疫微环境的研究也在胰腺癌治疗中展现出巨大潜力,尽管胰腺癌被认为是一种“冷肿瘤”,但固有免疫细胞的富集为免疫治疗提供了新的靶点[7-9]。POLAR研究为胰腺癌治疗提供了新的思路,即通过精准的基因检测和个性化的治疗方案,提高患者的治疗效果和生存质量。
在临床研究方面,化疗仍是胰腺癌治疗的基石。与经典的AG方案相比,新型NALIRIFOX方案显示出更长OS,为一线治疗方案为晚期胰腺癌带来生存获益,且亚洲人群获益更多。在胰腺癌二线治疗研究中,nal-IRI联合S-1并未显示出显著生存获益优势。但在2023年ESMO GI大会上,在NALIRIFOX方案基础上,将5-FU替换为口服S-1的NASOX方案有效性和安全性与NALIRIFOX在NAPOLI-3研究中相当,mPFS为7.0个月,mOS为12.6个月,ORR达58.5%。此外,NASOX方案可通过避免中央静脉置管,为患者提供更大便利,有可能成为NALIRIFOX替代方案。如何在保障治疗安全性的基础上,进一步筛选治疗适宜人群,优化治疗联合策略与干预时机,提高治疗效率,延长PFS和OS,改善患者生活质量,值得未来深入探讨。
精准靶向定位与免疫联合突破
开启胆管癌治疗探索新世界
60P[10]:Baseline characteristics and molecular testing of patients with IDH1-mutated cholangiocarcinoma: Initial results from the phase IIIb ProvIDHe study
在III期ClarIDHy研究中,艾伏尼布作为一种口服突变型异柠檬酸脱氢酶1(mIDH1)基因编码蛋白抑制剂,在胆管癌(CCA)患者中已展示出疗效。艾伏尼布疾病控制率为53%,而安慰剂组仅为28%,艾伏尼布中位PFS改善近1倍(2.7个月 vs. 1.4个月,HR=0.37,P<0.0001)。此外,艾伏尼布显著延长患者OS,艾伏尼布组患者中位OS可达10.3个月,而70%安慰剂组患者交叉至艾伏尼布组,经校准交叉治疗后,安慰剂组中位OS仅为5.1月,艾伏尼布OS获益翻倍,降低死亡风险达51%(HR=0.49,P<0.001)。
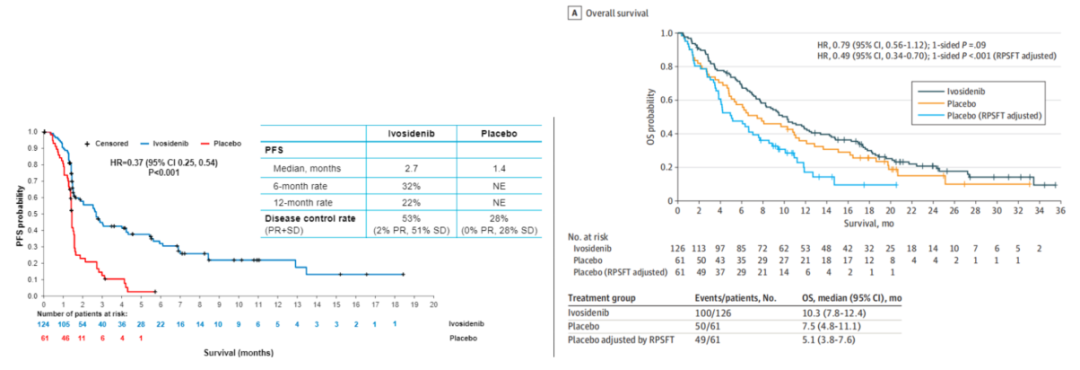
ProvIDHe研究进一步探究艾伏尼布在真实世界中的安全性和有效性,该研究是一项国际性、单臂Ⅲb期研究,纳入了接受过至少一线全身治疗的局部晚期或转移性mIDH1突变CCA成人患者。患者口服艾伏尼布500 mg,一日一次,在观察到临床获益的情况下持续治疗,直至出现不可接受的毒性,或直至疾病进展。本研究的主要终点是安全性。本次大会报道了患者基线特征和分子检测结果。截至2024年2月9日,来自10个国家158例患者被纳入研究并纳入全分析集。大多数(84.2%)患者在筛选时年龄<75岁,89.2%为IV期,72.8%存在肝转移。95%患者携带mIDH1 R132突变。检测到的常见共突变是PIK3CA(10.8%)、FGFR2(5.7%)和BRAF V600E(3.2%)。
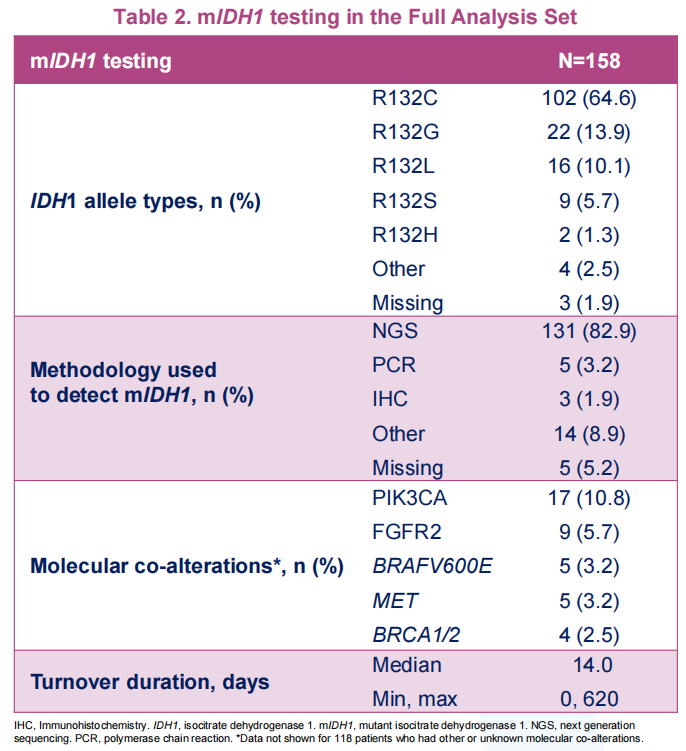
既往晚期/转移性患者治疗方案中位数为2,主要包括吉西他滨+顺铂(26.3%)单独治疗或联合免疫治疗(23.2%)。
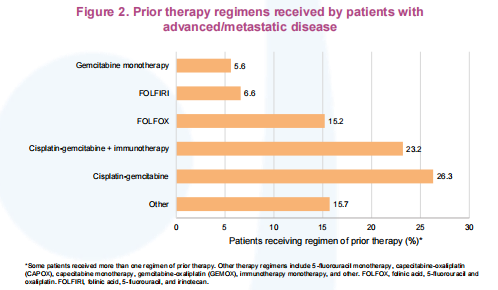
本次首次中期分析聚焦于参与ProvIDHe研究的患者的基线特征,包括针对晚期/转移性患者既往治疗方案及分子检测。研究仍在招募患者中,未来分析将聚焦于患者的治疗结果。
46P11:The comparison outcome of GEMOX and PD-1 inhibitors combined with or without lenvatinib for advanced intrahepatic cholangiocarcinoma (ICC): A prospective, single-center, open-label, double-arm phase II trial
仑伐替尼是一种多激酶抑制剂,具有抑制晚期肝内胆管癌(ICC)血管生成的作用。本研究旨在比较吉西他滨+奥沙利铂(GEMOX)和PD-1抑制剂联合或不联合仑伐替尼一线治疗晚期ICC的疗效和安全性。主要研究终点为mRECIST 1.1评估的ORR和不良事件。次要终点包括DCR、PFS和OS。
研究共纳入77例患者,中位随访时间23个月。G-P-l组和G-P组中位PFS分别为13个月和7.9个月(HR:0.38, 95% CI: 0.20~0.71, P=0.007),中位OS分别为18.5个月和14.6个月(P=0.19)。两组患者≥3级AE发生率分别为68.4%和64.1%(P>0.05)。
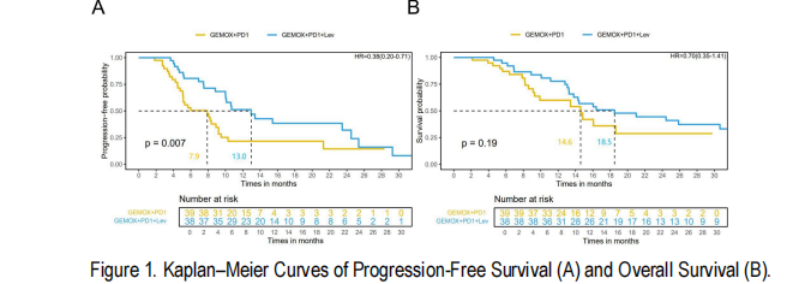
多因素Cox回归分析显示,是否联合仑伐替尼治疗是影响全组患者PFS的独立危险因素(P=0.002)。
专家点评
胆管癌是一种相对少见且预后较差的恶性肿瘤[12],通常在确诊时已处于晚期,使得治疗选择十分有限。近年来,随着对其分子生物学特性的深入研究,靶向治疗和免疫治疗逐渐成为新兴的治疗方向,展现出良好的前景。
IDH1突变在胆管癌中发生率约为10%~15%,其突变导致代谢产物2-羟基戊二酸(2-HG)在细胞内异常积累,进而影响细胞的代谢及表观遗传调控,促进肿瘤发生和发展。这一机制的发现为靶向IDH1的治疗策略奠定了基础,特别是IDH1抑制剂的开发为患者提供了新的治疗选择[13]。艾伏尼布(Ivosidenib)作为一种口服IDH1抑制剂,已在临床试验中显示出显著的疗效。ClarIDHy研究结果表明[14],艾伏尼布显著延长了晚期IDH1突变型胆管癌患者的PFS、ORR和OS,为患者带来了切实的临床益处。此外,ProvIDHe研究在真实世界环境中进一步验证了其安全性和有效性,为艾伏尼布的临床应用提供了重要支持。除了IDH1抑制剂,靶向FGFR2基因融合或重排的FGFR抑制剂在胆管癌患者中同样展现出良好的疗效,这表明针对不同靶点的治疗方案正逐渐丰富胆管癌的治疗选择。
与此同时,随着对肿瘤微环境理解的深入,免疫检查点抑制剂的应用也在胆管癌治疗中取得了一定的进展。针对肝内胆管癌,结合化疗、靶向治疗和免疫治疗的“四药三联方案”成为研究热点。尽管现有研究中,GEMOX与PD-1抑制剂联合或不联合仑伐替尼的中位OS差异未达到统计学显著性,但在PFS和ORR等方面显示出积极表现。此外,Cox回归分析确定联合仑伐替尼治疗为影响患者PFS的独立危险因素,提供了重要的临床依据。
然而,尽管靶向治疗已初见成效,仍面临多重挑战。一方面,靶向和免疫治疗并非对所有患者均有效,如何精准筛选适合特定治疗方案的患者群体仍是关键问题。另一方面,多药联合治疗可能带来更多的不良事件风险,尽管部分联合治疗的不良事件发生率在可接受范围内,但仍需对患者的不良反应进行密切监测和管理,以确保治疗的安全性和耐受性。
展望未来,胆管癌治疗的进一步研究将致力于优化治疗方案,提高治疗效果,降低不良事件发生风险,以实现个性化和有效的治疗策略,改善患者预后。随着新型治疗方案的出现以及精准检测技术的发展,胆胰肿瘤的个体化治疗有望实现突破,推动难治肿瘤患者的生存获益进一步提升。
[1] 2024 ESMO 1520P Real-World Assessment of NALIRIFOX for Advanced Pancreatic Ductal Adenocarcinoma: An Exploratory Analysis.
[2] 2024 ESMO 1504MO Phase 2 Trial of Pembrolizumab and OLApaRib (POLAR) Maintenance for Select Patients (pts) with Metastatic Pancreatic Cancer (mPC) with (A) Homologous Recombination Deficiency (HRD), (B) non-core HRD (ncHRD) and (C) Exceptional Response to Platinum
[3] 2024 ESMO LBA63 A randomized phase I/II study of second line treatment with liposomal irinotecan and S-1 versus liposomal irinotecan and 5-fluorouracil in patients with metastatic pancreatic cancer following gemcitabine-based chemotherapy
[4] 王旭,等.中国癌症杂志, 2023, 33(1):13.
[5] 徐华祥,等. 中国实用外科杂志,2023,43(7):743-749.
[6] 李天骄,等. 中国癌症杂志, 2024, 34 (1): 1-12.
[7] Meng Z, et al. Science Translational Medicine, 15(722): eadh9562.
[8] LAFARO KJ,et al. Am J Pathol,2019, 189( 1) : 44-57.
[9] ERKAN M,et al. Nat Rev Gastroenterol Hepatol,2012,9(8) : 454-467.
[10]2024 ESMO 60P Baseline characteristics and molecular testing of patients with IDH1-mutated cholangiocarcinoma: initial results from the phase 3b ProvIDHe study
[11] 2024 ESMO 46P The comparison outcome of GEMOX and PD-1 inhibitors combined with or without lenvatinib for advanced intrahepatic cholangiocarcinoma (ICC): a prospective, single-center, open-label, double-arm phase 2 trial
[12]Kodali S,et al. Gastroenterol Hepatol (N Y). 2024 Mar;20(3):151-158.
[13] Kelley, R. K, et al. Journal of Clinical Oncology, 42(16_suppl), e16016-e16016.
[14] Zhu AX, et al. JAMA Oncol. 2021 Nov 1;7(11): 1669-1677.
编号:M-ONIVD-CN-202409-00017
本文转自:论坛报
排版编辑:肿瘤资讯-展思懿











 苏公网安备32059002004080号
苏公网安备32059002004080号


