医路曼话,百家畅谈。2024年11月12日17:00良医汇【肿瘤资讯】携手大连医科大学附属第二医院乳腺肿瘤科李曼教授开展的系列乳腺癌线上培训课程——“半月曼谈”第六十一期如约举行。

本期11月12日17:00的精品云课堂名家齐聚,特邀中国医学科学院肿瘤医院MDT团队肿瘤内科樊英教授、放疗科景灏教授与影像诊断科李二妮教授参与,同大连医科大学附属第二医院乳腺肿瘤科李曼教授率领的MDT团队,包括乳腺肿瘤科徐岭植教授与影像科曹倩教授,针对人表皮生长因子受体2(HER2)阳性晚期乳腺癌病例展开讨论。


课程伊始,乳腺肿瘤科李曼教授介绍了本课堂自开播以来,专注于临床上的疑难乳腺癌病例,涵盖乳腺内外科、放疗科、影像科和病理科等多个学科,并邀请多学科专家共同探讨病例。

畅叙医情——病例分享
在“畅叙医情”环节,大连医科大学附属第二医院乳腺肿瘤科徐岭植教授分享了一例HER2阳性晚期乳腺癌病例。多学科专家们围绕该例患者的后续治疗方案进行了探讨。

病例资料
基本情况
患者,女,44岁,未绝经,既往史及家族史无特殊。
现病史:
2016.6行右乳腺癌改良根治术,术后病理结果:(右乳肿物)非特殊型浸润性乳腺癌2级,肿物2x1.2x0.5cm,20%为高核级导管原位癌,未见确切脉管内癌栓及神经侵犯。(腋窝淋巴结)可见癌转移9/16。免疫组化:肿瘤细胞ER(80%阳性),PR(90%阳性),HER2(2+),CK5/6(-),P53(30%阳性),TOPO II(Ⅰ级),Ki67指数10%,EGFR(-)。针对HER2(2+)行FISH检测,结果显示HER2基因扩增。术后行AC-T方案(表柔比星+环磷酰胺序贯多西他赛)辅助化疗8周期(末次化疗时间为2017.1),联合曲妥珠单抗靶向治疗满1年(至2017.10),化疗后行辅助放疗,放疗后予卵巢功能抑制制(OFS)+来曲唑内分泌治疗(自2017.2起)。
病情进展:2021.12因腰部疼痛就诊(距离辅助曲妥珠单抗结束时长:4年2个月,内分泌治疗时长:4年10个月)。
全身骨显像示:脊柱、双侧多根肋骨,骨盆诸骨及右侧股骨颈放射性核素多发异常浓聚,考虑多发骨转移。
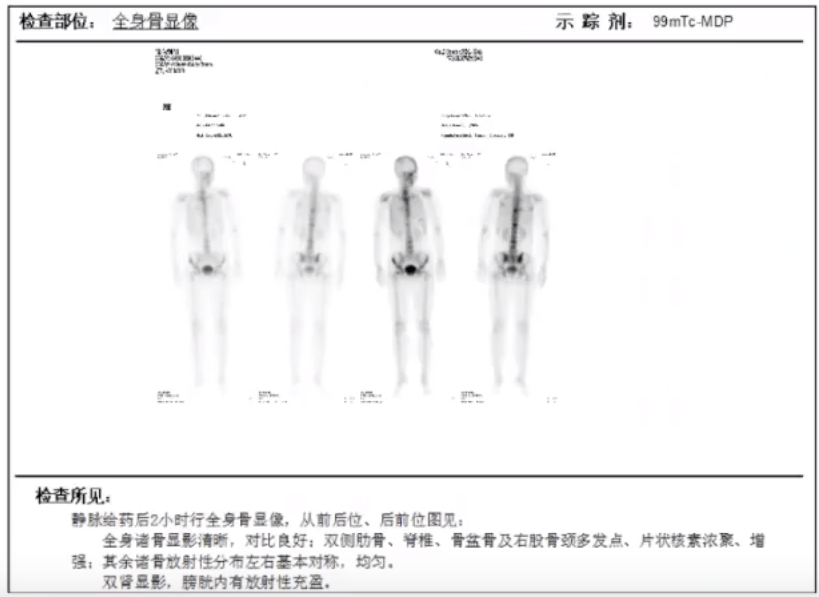
2022.1行CT引导下腰2椎体骨穿刺活检,病理结果示:(腰2椎体)穿刺组织可见腺癌,结合病史及免疫组化染色,符合乳腺癌转移来源。免疫组化:AE1/AE3(+),GATA-3(-),Mamgb(乳球)(+),ER(-),PR(-),HER2(2+),Ki67(局灶5%+,脱钙标本,仅供参考)。针对HER2(2+)行FISH检测,结果显示无荧光信号。
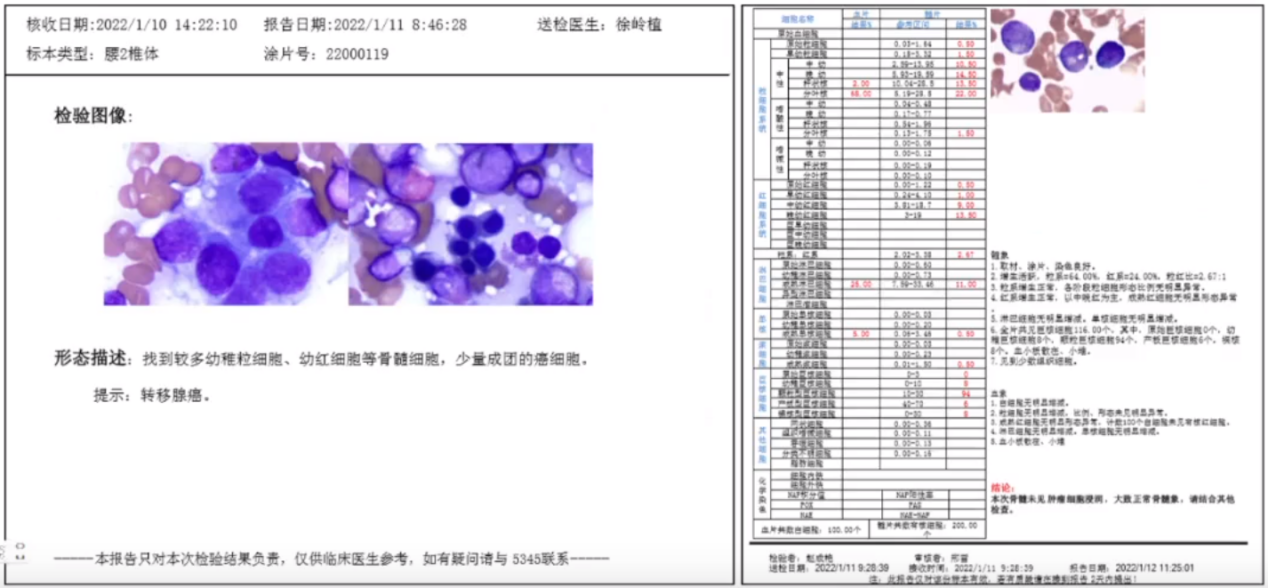
疾病诊断及治疗方案:
(1)右乳腺癌复发,骨转移 (2)右乳腺癌术后,ⅢA期,pT1cpN2aM0。
一线方案:先行TH方案,6个周期,后曲妥珠单抗维持治疗,联合唑来膦酸抗骨转移治疗(自2022.1起)。
2022.10全身骨显像和骨穿刺活检示:骨痛症状再发,范围较前扩大,程度持续加重,伴发热、贫血,抗感染效果欠佳。
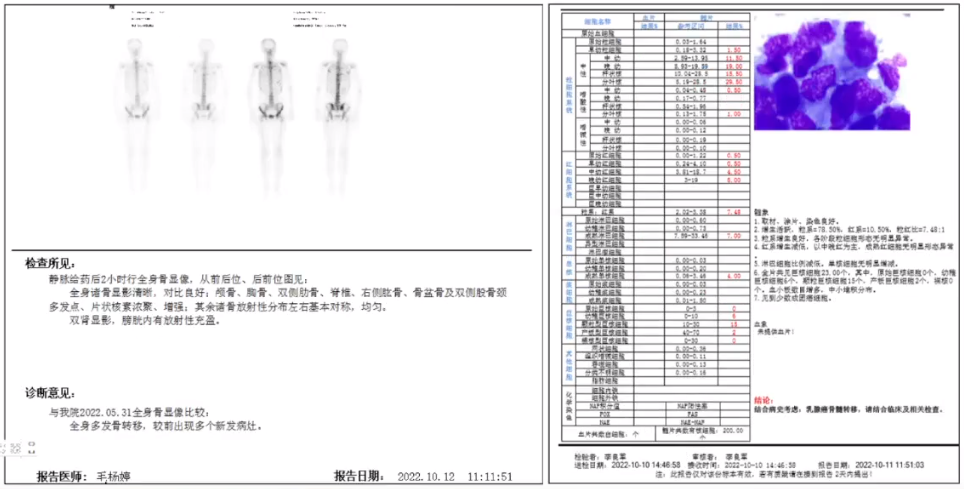
(1)右乳腺癌复发,骨转移,骨髓转移 (2)右乳腺癌术后,ⅢA期,pT1cpN2aM0。
二线方案:艾立布林联合吡咯替尼(自2022.11起),更换伊班膦酸抗骨转移治疗。治疗后,患者的骨痛缓解,发热病情得到控制,贫血状况纠正。不良反应包括腹泻、白细胞及中性粒细胞减少。
2023.5脑部CT示:新发颅脑转移(单发)。
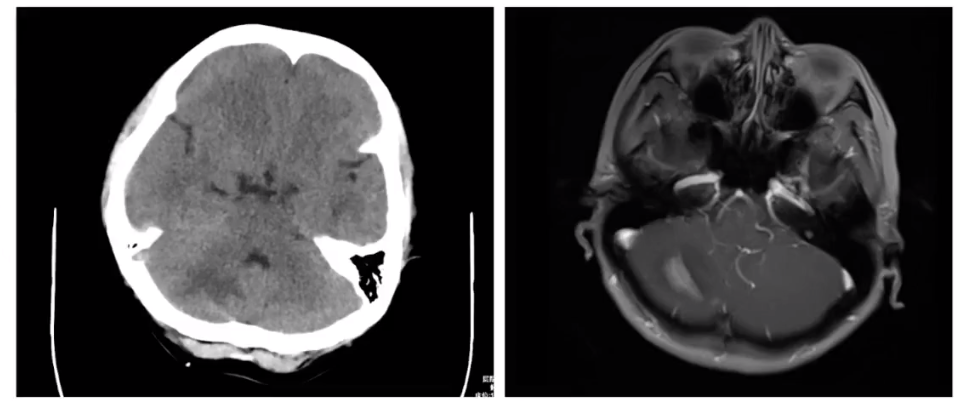
2023.5全身骨显像和骨穿刺活检示:全身多发骨转移,多个病灶较前范围缩小,核素浓聚程度减低,颅外病情为骨病灶/骨髓病灶仍存在。
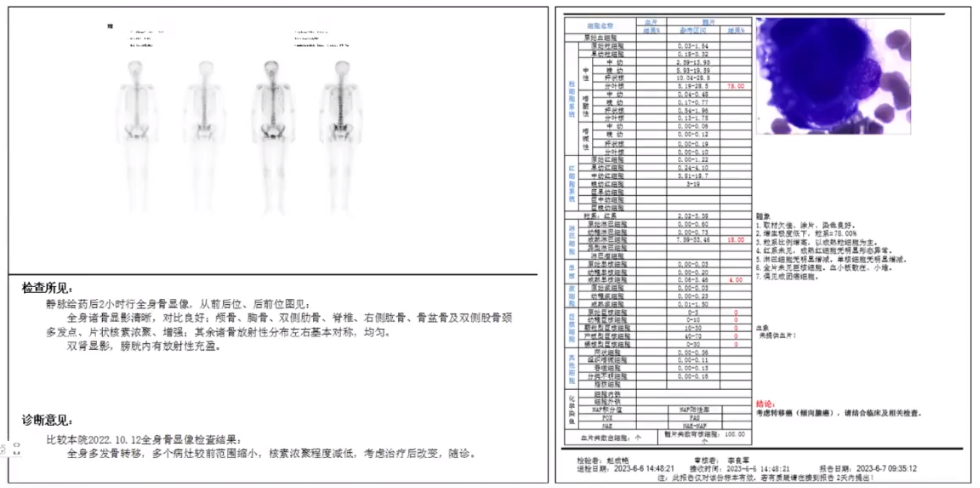
(1)右乳腺癌复发,骨转移,骨髓转移,脑转移 (2)右乳腺癌术后,ⅢA期,pT1cpN2aM0。
三线方案:T-DXd(自2023.6起),继续伊班膦酸抗骨转移治疗。T-DXd对颅内病灶的控制非常理想,治疗后颅内病灶明显缩小。
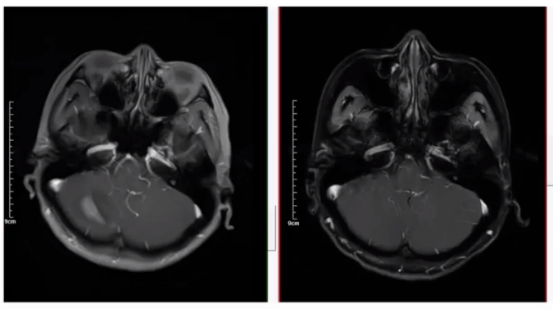
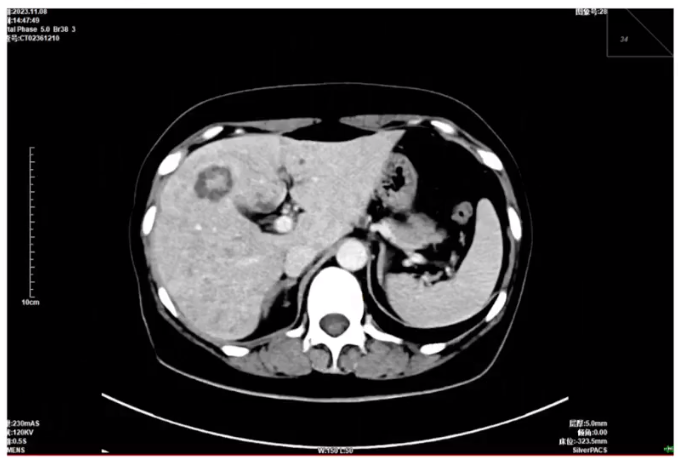
2023.11胸部CT示:新发肝转移(多发)。
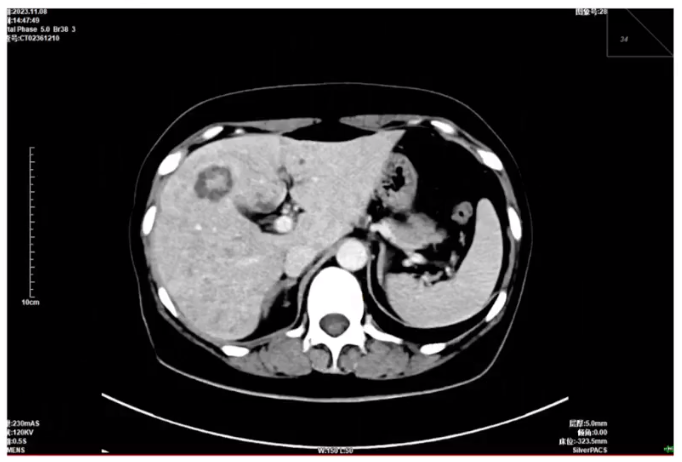
2023.11脑部增强MRI和骨髓穿刺活检示:颅脑病灶持续部分缓解(PR),骨髓病灶仍存在。

2023.11行超声引导下肝脏占位穿刺活检,病理结果示:(肝穿)肝穿刺组织中可见腺癌,结合病史,考虑乳腺癌转移来源。免疫组化:(乳腺MK243308-1)肿瘤细胞ER(阳性:30%弱+),PR(阴性:-),HER2[4B5](3+),Ki67(60%阳性)。

(1)右乳腺癌复发,骨转移,骨髓转移,脑转移,肝转移 (2)右乳腺癌术后,ⅢA期,pT1cpN2aM0。
四线方案:伊尼妥单抗+吡咯替尼+卡培他滨(自2023.11起),继续伊班膦酸抗骨转移治疗。治疗后,患者肝病灶疗效为PR,颅脑病灶疗效为持续PR。
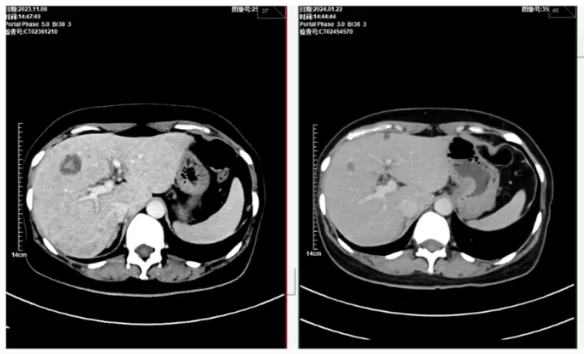
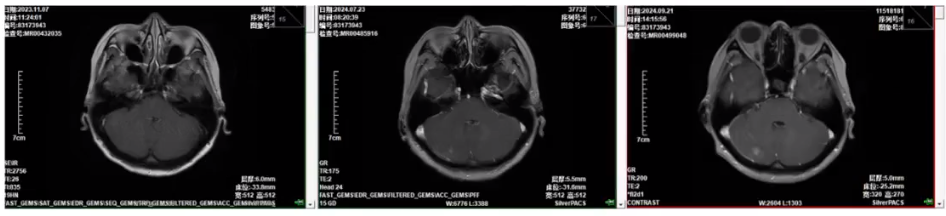
2024.7脑部CT示:颅脑病灶疗效为疾病进展(PD)(患者无神经系统受累症状)。
2024.9脑部CT示:颅脑病灶疗效仍为PD(患者仍无神经系统受累症状)。
2024.9腹部增强CT示:肝病灶疗效为PD(患者合并肝功能不全、高胆红素血症,皮肤、巩膜黄染及周身瘙痒)。
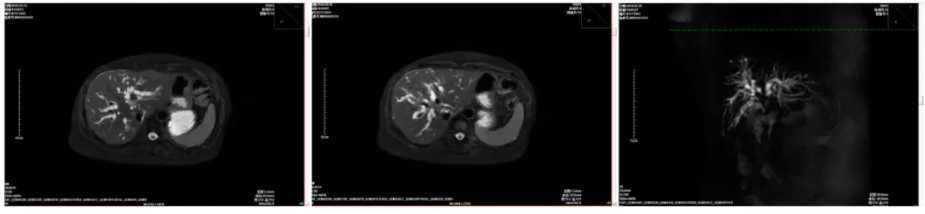
图13. 2024.9腹部增强MRI
肝胆脾胰增强MRI+水成像:肝内多发异常强化灶,考虑转移瘤可能性大;胆总管上段及肝左右胆管管壁增厚毛糙,并胆道梗阻征象,考虑恶性可能性大,胆管?转移所致?
超声引导下行PTCD,超声造影显示:胆总管及左右肝管内低回声造影动脉期呈高增强,门脉期及静脉期呈低增强。胆总管及左右肝管内低回声造影考虑Ca栓。
PTCD术后,患者肝功能不全、高胆红素血症病情缓解,皮肤、巩膜黄染及周身瘙痒缓解。
2024.10患者出现头晕症状,逐渐加重,持续不缓解,伴头痛、恶心、视物模糊,院外甘露醇效果欠佳,行腰椎穿刺术,测脑压大于330mmH2O。

疾病诊断:(1)右乳腺癌复发,骨转移,骨髓转移,脑转移,肝转移,胆管转移,脑膜转移 (2)右乳腺癌术后,ⅢA期,pT1cpN2aM0。
目前病情:患者接受伊尼妥单抗+甲氨蝶呤+阿糖胞苷鞘内注射治疗(每周2次,累计进行6次),头晕、头痛、恶心及视物模糊症状缓解,监测脑脊液压力逐渐下降,脑脊液细胞学前5次均阳性,第6次为阴性。
集思广医—多学科专家各抒己见
在讨论环节中,中国医学科学院肿瘤医院MDT团队肿瘤内科樊英教授、放疗科景灏教授与影像诊断科李二妮教授分别以多学科视角针对该病例的诊疗策略分享了看法,大连医科大学附属第二医院MDT团队乳腺肿瘤科李曼教授、乳腺肿瘤科徐岭植教授、影像科曹倩教授也基于不同角度和临床经验分享了诊疗建议。
问题讨论:
1、晚期二线治疗方案该如何考虑?
樊英教授:骨髓转移常常被忽视,大概20%-30%的患者可能存在骨髓转移,只是这些转移未被发现或未影响造血功能,因此血常规可能看起来正常。对于这类患者,晚期二线治疗建议选择对骨髓影响较小的化疗方案,并联合靶向治疗。如卡培他滨+吡咯替尼,或使用艾立布林这类对骨髓影响较小的药物,并考虑联合靶向治疗。对于血液指标不合格的患者,可以考虑小剂量的长春碱类治疗,待骨髓转移得到一定控制后,再逐渐恢复正常化疗,或使用对骨髓影响较小的顺铂进行治疗。

徐岭植教授:患者全身状况较差,伴有发热症状,经检查排除感染性发热,考虑为肿瘤性发热。考虑到骨髓受累,选择了副作用相对较小的艾立布林进行静脉化疗。同时,结合药物可及性,选择了吡咯替尼的靶向联合治疗。由于之前的唑来膦酸治疗效果不佳,改用了伊班膦酸进行抗骨转移治疗。

2、对于颅脑单发转移病灶,局部干预方式及时机考量?晚期三线治疗方案该如何考虑?
景灏教授:二线治疗后,患者的骨转移病灶有所缓解,但在脑部出现了一个单发病灶,目前患者无症状。考虑到患者之前接受过放疗,且长期未见胸壁和锁骨上下淋巴引流区复发,说明放疗效果较好。对于新出现的脑部病灶,如果内科治疗的预测效果不佳,可以考虑放疗。尽管该部位放疗有一定风险,但根据磁共振图像,病灶与脑干的距离尚可,因此放疗是一个可行的选项。最终是否进行放疗还需根据内科治疗的预后和患者的整体状况来决定。

樊英教授:患者的颅外病变控制良好,且放疗没有困难,应优先考虑对新发的颅内病灶进行放疗。如果颅外病变也在进展,可能需要调整治疗方案,如T-Dxd这类药物对颅内活动性或稳定性脑转移皆有良好效果,如果颅外病变需要调整治疗方案,则暂不急于放疗。但如果颅外控制良好,且病灶是单发的,则倾向于不更换方案,先进行局部放疗。
3、(1)如何解读胆管病变影像学特点、以及脑膜病变影像学特点?(2)全身治疗方案该如何考虑?
曹倩教授:影像学检查显示胆道梗阻症状明显,胆总管、肝门区胆管以及胆囊壁均有弥漫性增厚,且呈跳跃式、形态不规则。这些影像特征首先考虑是由转移瘤导致的胆道梗阻。关于脑膜病变,脑膜分为硬脑膜、蛛网膜和软脑膜三层,其中软脑膜和蛛网膜合称柔脑膜,转移瘤在柔脑膜的发生比例较高,常伴有颅内转移。影像学上,脑膜转移表现为局限性增厚,部分可见脑沟增强。对于该患者,考虑存在脑膜和脑的转移。临床上,影像学检查可能无法明确显示脑膜转移,但脑脊液穿刺可能发现肿瘤细胞,即使脑脊液检查阴性。因此,需要结合影像学检查、脑脊液检查和临床症状综合诊断。

李二妮教授:乳腺癌转移到胆管的病例非常罕见。患者之前有肝脏弥漫性转移的背景,影像学上显示肝内胆管既有扩张又有狭窄,不同于原发性胆管癌的典型表现。胆管扩张不均匀,可能是由于肝脏肿瘤或转移导致的压迫。对于脑膜转移,乳腺癌特别是HER2阳性和浸润性小叶癌更容易发生。脑膜转移在早期可能在影像学上不明显,但结合T2 FLAIR序列和增强序列可以更敏感地检测到。脑膜转移最常见的受累区域是小脑幕下,沿着脑沟分布的异常信号在T2 FLAIR上可能更明显,严重时在增强影像上也有体现。增强影像显示脑膜分布的强化信号,提示脑膜转移。
景灏教授:脑膜转移的病情非常凶险,治疗相对较少。大部分文献指出,弥漫性脑膜转移伴随明显神经系统症状的患者,放疗与不放疗的获益不大,除非伴有结节性、惰性病灶。考虑到该患者的病情较重且一般状况不佳,不建议进行过多局部干预,放疗的必要性需谨慎评估。
樊英教授:尽管患者面临严重的肝病和明显的脑膜转移症状,但通过治疗病情得到了一定控制。对于后续治疗,更倾向于继续抗HER2治疗,并考虑加入抗血管生成药物。对于多线治疗后的患者,可能还会考虑联合免疫治疗或mTOR抑制剂。此外,患者肝转移时的活检显示ER阳性,尽管表达不强,但与之前骨转移的表达不同,可能需要考虑内分泌治疗和CDK 4/6抑制剂。在没有标准治疗方案的情况下,这些治疗都值得尝试。如果患者能进行基因检测,那将有助于指导治疗。
李曼教授:患者携带PIK3CA突变,这可能导致患者对各种一线治疗敏感性不强,无进展生存期(PFS)和无病生存期(DFS)都较短,通常在治疗开始后的几个月内疾病出现进展。鉴于患者从HR阴性和HER2过表达型转变为ER阳性、PR阴性、HER2阳性的乳腺癌,后续治疗可能会考虑使用mTOR抑制剂联合内分泌治疗和抗HER2治疗。尽管患者已接受近三年的抗肿瘤治疗,一般状况仍较好。由于患者对曲妥珠单抗耐药,尝试使用伊尼妥单抗进行局部鞘内注射,取得了良好控制。对于是否应在鞘内注射稳定后进行全身治疗,仍还在探讨中。
总结
本次云课堂深入探讨了一例HER2阳性晚期乳腺癌患者的治疗。该患者经右乳腺癌改良根治术后,相继出现多发骨转移,骨髓转移,脑转移,肝转移,胆管转移和脑膜转移。从HR阴性/HER2过表达型转变为ER阳性/PR阴性/HER2阳性。专家们讨论了该患者的晚期多线治疗方案,以及对颅脑单发转移病灶的局部干预方式和全身治疗方案。提出了可以对颅脑单发转移病灶进行放疗,但伴有脑膜转移时则不建议进行放疗,应考虑以全身治疗为主。此次讨论不仅为该患者提供了治疗方向,也为类似病例的临床决策提供了宝贵的思路。感谢MDT团队的专家提供指导,并对参与云课堂的大家表示感谢。相信本次课程也让大家对该类乳腺癌的规范化诊治有了更深入的了解。“半月曼谈”更多精品课程将继续呈现,精彩不断,欢迎持续关注!
排版编辑:肿瘤资讯-G











 苏公网安备32059002004080号
苏公网安备32059002004080号


